高表达MRPL13 促进胃癌细胞增殖并影响患者预后:基于抑制p53信号
王 炼,夏勇生,张 震,刘馨悦,施金冉,王月月,李 静,张小凤,耿志军,宋 雪,左芦根
蚌埠医学院第一附属医院1胃肠外科,3检验科,4中心实验室,安徽 蚌埠 233004;2蚌埠医学院,安徽 蚌埠 233030;5组织移植安徽省重点实验室,安徽 蚌埠 233030;6炎症相关性疾病基础与转化研究安徽省重点实验室,安徽 蚌埠233030
胃癌(GC)在我国恶性肿瘤发病率中居第3位,且呈年轻化趋势[1,2],社会危害性极大[3,4]。以手术为主的肿瘤综合治疗虽取得较大进展[5],但胃癌的5年生存率仍无明显改善[6],而造成这一困境的主要原因是发病机制不明[7]。在精密复杂的分子信号调控下[8,9],癌细胞增殖、侵袭等恶性行为影响着胃癌的进展和预后[10],该领域的深入探索有望为精准靶向胃癌治疗提供借鉴。新近研究表明,线粒体核糖体蛋白L13(MRPL13)在乳腺癌、肺癌等实体肿瘤中高表达[11,12],促进肿瘤增殖并影响患者预后[13,14]。但MRPL13在胃癌中的表达及与预后的关系尚未见报道,其是否能够影响胃癌细胞的恶性行为以及其中的调控机制有待于探索。我们基于TCGA等癌症公共数据库和本机构胃癌临床数据库/生物标本库系统,分析MRPL13在胃癌组织中的表达及对预后的影响,通过富集分析预测MRPL13可能的作用机理,进一步采用动物实验和细胞学研究验证,旨在为临床诊疗提供新的靶点,为胃癌进展机制的揭示提供线索。
1 资料和方法
1.1 研究对象和分组
纳入2014年1月~2017年10月在我院完成胃癌根治术的患者。纳入标准:经临床及病理学检查诊断为原发性胃癌且无远处转移;实现根治性R0切除。排除标准:合并其他组织起源的恶性肿瘤;曾接受过其他抗肿瘤治疗;患者术后死于胃癌以外的因素。以免疫组化检测所得患者癌组织中MRPL13的表达量的中位数为界,将纳入的100例患者分为低表达组(n=50)和高表达组(n=50)。经我院伦理委员会审查(伦科批字[2022]第183号),同意开展此项研究。
1.2 资料采集和来源
采集患者以下资料:(1)一般临床资料:从永久保存的电子病例系统采集患者的性别、年龄、临床分期、病理诊断、术前外周血癌胚抗原(CEA)和糖类抗原19-9(CA19-9)等数据;(2)生存数据:通过电话随访的方式,收集患者术后5年生存状况或死亡原因,随访时间截止到2022年10月;(3)手术标本病理蜡块:从病理科调取免疫组织化学检查所需的癌组织及对应的癌旁组织的蜡块。
1.3 免疫组化检测MRPL13和Ki67的表达
将手术标本病理蜡块制作4 μm厚度切片,65 ℃烤片,依次进行脱蜡水化、抗原修复、血清封闭、孵育一抗及二抗、DAB显色、苏木精复染、封片后采集图片。使用Image J软件分析目标蛋白相对积分光密度(IOD)值。一抗信息如下:MRPL13(1∶200;Proteintech);Ki67(1∶400;Abcam)。二抗为过氧化物酶标山羊抗兔/鼠IgG聚合物,中杉金桥。
1.4 公共癌症数据库分析MRPL13表达和对生存期的影响
通过TIMER、UALCAN、GEPIA 和Kaplan-Meier Plotter数据库分别分析MRPL13在泛癌、胃癌和癌旁组织中的表达差异和其表达量与患者生存期的关系。通过cBioPortal数据库获取胃癌与MRPL13的相关基因,使用DAVID数据库进行KEGG和GO的富集分析预测其可能的生物学功能和机制。
1.5 体外研究调控MRPL13表达对胃癌细胞增殖、周期的作用和机制
1.5.1 胃癌细胞中MRPL13的表达调控和分组 用完全培养基(含10%胎牛血清的RPMI 1640)培养MGC-803细胞(国家生物医学实验细胞资源库)和SGC-7901(ATCC),待细胞生长至70%~80%,加入MRPL13的特异性干扰(siRNA:CACTTTTGCTAGAATATGG TATC)、过表达和对照慢病毒载体,6 h后更换完全培养基,培养3 d后用完全培养基(含1 μg/mL嘌呤霉素)筛选出稳定表达细胞株,免疫印迹实验验证基因调控效果。
1.5.2 细胞增殖分析 CCK8检测:将MGC-803和SGC-7901细胞(1×103/孔)分别接种于96孔板中,培养24 h后,加入10 μL/孔的CCK8溶液(索莱宝),培养4 h后置于酶标仪中测定A450nm。
克隆形成实验:在6孔板中分别接种MGC-803细胞(650/孔)和SGC-7901细胞(800/孔),培养14 d后用4%多聚甲醛固定,0.2%的结晶紫染色10 min,PBS洗去残余染液后采集图片。
1.5.3 流式细胞术检测细胞周期 收集各组胃癌细胞,经70%乙醇固定后,根据细胞周期检测试剂盒(索莱宝)说明书检测细胞周期。利用BD FACSCalibur流式细胞仪和Flowjo10.0软件收集和分析数据。
1.5.4 免疫印迹检测蛋白表达 RIPA裂解液提取胃癌细胞的总蛋白,经BCA法蛋白定量、变性和SDS-PAGE电泳,再湿转、封闭、孵育一抗和二抗、ECL化学发光,用多功能凝胶成像系统(BioRad)采集图片和ImageJ软件量化。一抗信息如下:MRPL13、CyclinD1、CDK6(1∶1000;Proteintech),p53、p21、β-actin(1∶1000;Abcam)。二抗为辣根酶标记山羊抗兔/鼠IgG,中杉金桥,1:3000。
1.6 裸鼠移植瘤模型观察MRPL13表达对胃癌生长、细胞周期的作用和机制
1.6.1 构建裸鼠移植瘤模型、分组和取材 从江苏集萃药康生物科技股份有限公司购买BALB/c-Nude裸鼠(雄性,6周龄,20±2 g)。消化各组细胞,离心并重悬成单细胞悬液,每只小鼠给予100 μL(1×108/mL)悬液接种到背部皮下,正常饲养14 d后,深度麻醉状态下处死小鼠,剥除瘤体,拍照称重。
1.6.2 免疫印迹检测细胞周期和信号通路蛋白表达 用RIPA裂解缓冲液提取剪碎的移植瘤组织的总蛋白。抗体和操作同1.5.4。
1.7 统计学方法
采用SPSS 26.0软件分析数据,χ2检验用于计数资料的组间比较(样本量小于5时用Fisher精确检验法),计量资料用均数±标准差表示,两组间比较用t检验,多组间比较用单因素方差分析和Tukey多重检验法,相关性分析用Spearman检验。Kaplan-Meier曲线分析术后生存率,Cox回归模型估计影响胃癌术后5年生存期的危险因素,受试者工作特征曲线(ROC)分析诊断价值。P<0.05为差异具有统计学意义。
2 结果
2.1 MRPL13在胃癌组织中表达升高且和Ki67表达量正相关
联合TCGA 和GTEx 数据库分析发现:MRPL13在多种恶性肿瘤(P<0.001,图1A)以及胃癌(P<0.05,图1B、C)中表达升高。对本院的手术标本蜡块进行免疫组化半定量分析发现:MRPL13在胃癌组织中高表达(P<0.05,图1D、E),且与细胞的增殖核抗原Ki67(P<0.05,图1D、F)呈现显著正相关(P<0.001,r=0.674,图1G)。
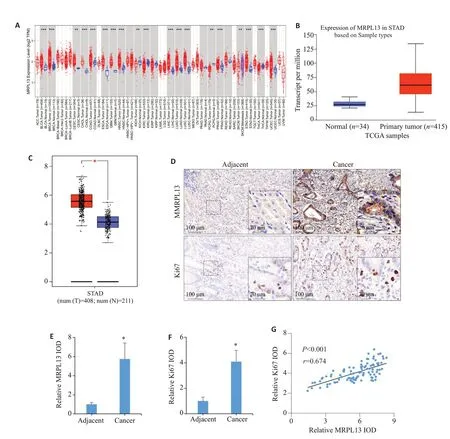
图1 胃癌组织中MRPL13和Ki67的表达及相关性分析Fig.1 Expression and correlation analysis of MRPL13 and Ki67 in gastric cancer tissues.A:Expression of MRPL13 in pan-cancer.B,C: Expression of MRPL13 in gastric cancer (Red asterisks indicate statistically significant differences).D:Immunohistochemical staining of MRPL13(Scale bar=100 μm).E:Relative IOD value of MRPL13.F:Relative IOD value of Ki67.G:Correlation between MRPL13 and Ki67.*P<0.05 vs adjacent tissue.
2.2 MRPL13的表达量和胃癌恶性进展参数正相关
MRPL13 高表达组中CEA≥5 μg/L、CA19-9≥37 kU/L、肿瘤大小≥5 cm、T3~4及N2~3期的比例显著高于低表达组(P<0.05)。Spearman 相关性分析发现MRPL13 表达量和外周血CEA(P<0.001,r=0.580)、CA19-9(P<0.001,r=0.645)均呈现显著正相关(表1,图2)。
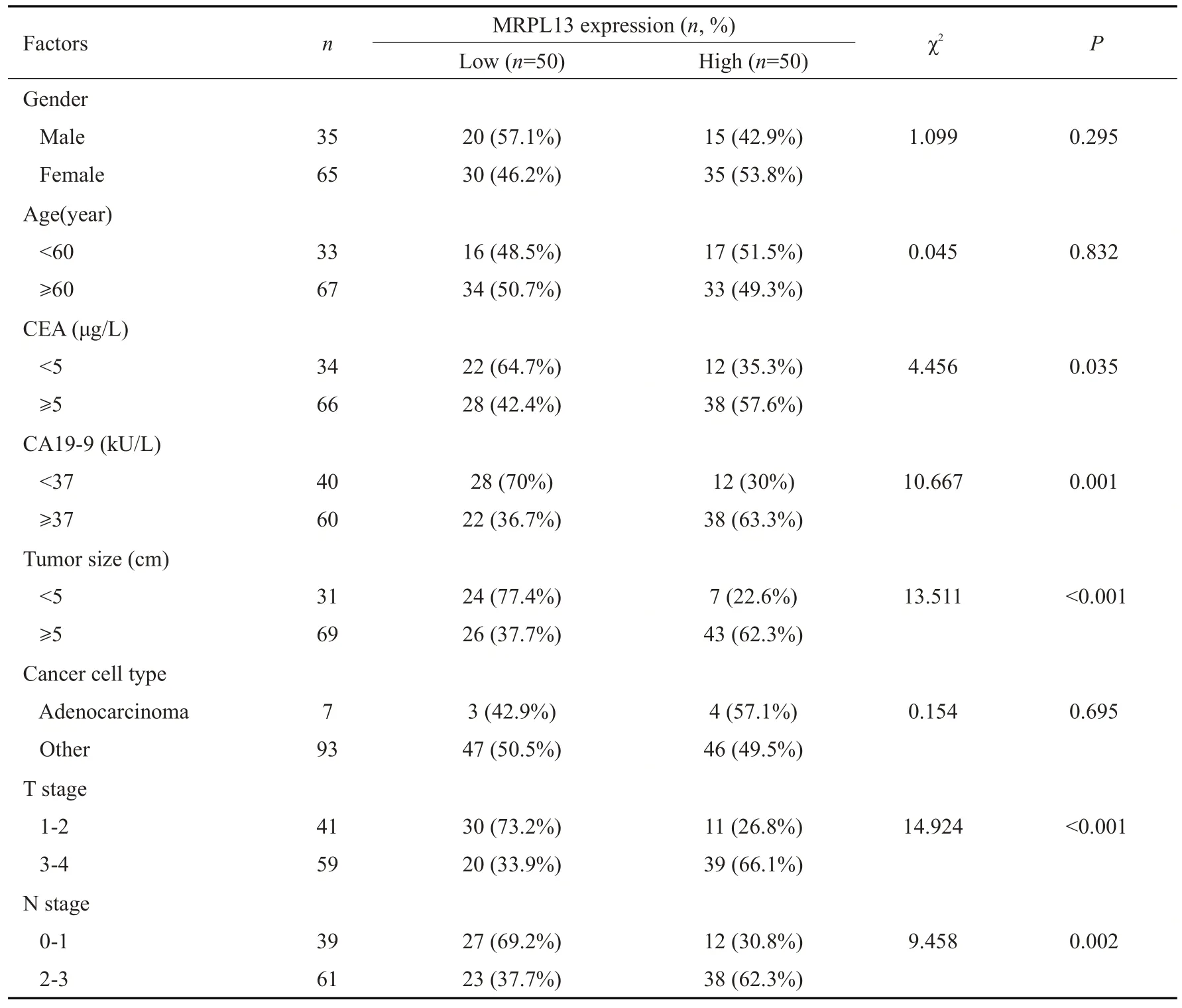
表1 胃癌组织中MRPL13的表达量与恶性进展参数间的关系Tab.1 Association of MRPL13 expression with malignant progression parameters in gastric cancer

图2 胃癌组织中MRPL13与外周血CEA、CA19-9间的相关性分析Fig.2 Correlation analysis between MRPL13 in gastric cancer and CEA and CA19-9 levels in peripheral blood.A:Correlation between MRPL13 and CEA.B:Correlation between MRPL13 and CA19-9.
2.3 MRPL13高表达降低胃癌患者术后5年生存期
基于Kaplan-Meier Plotter 数据库分析发现:MRPL13高表达降低胃癌患者生存期(P<0.05,图3A)。本机构的数据分析显示:MRPL13高表达组患者术后5年生存率低于低表达组(P<0.05,图3B)。此外,以MRPL13相对表达量6.125为截点值,预判术后5年死亡情况,结果显示:曲线下面积为0.789,敏感性为78.85%,特异性为79.17%(P<0.01,图3C)。
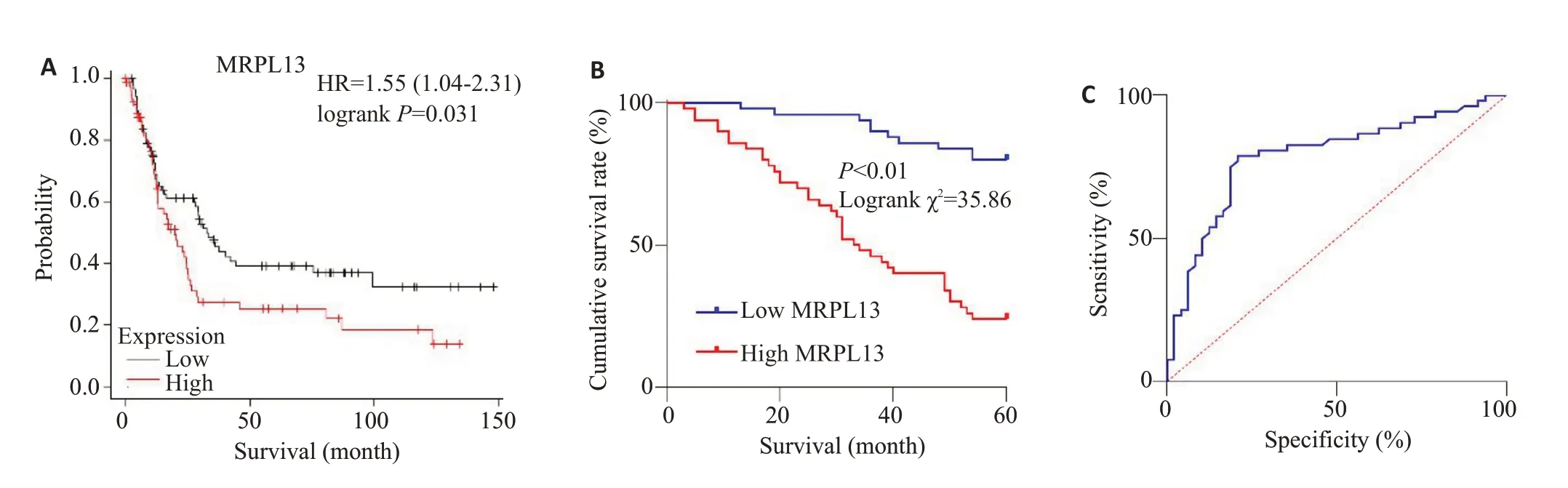
图3 MRPL13高表达降低胃癌患者术后5年生存期Fig.3 High expression of MRPL13 is associated with decreased postoperative 5-year survival rate of gastric cancer patients.A:Kaplan-Meier analysis.B:Kaplan-Meier survival curve.C:Predictive value of MRPL13 for 5-year survival after radical gastrectomy.
2.4 MRPL13高表达是影响胃癌患者术后5年生存期的独立危险因素
采用单因素和多因素分析影响患者术后5 年生存期的独立危险因素,结果为:MRPL13高表达、CEA≥5 μg/L、CA19-9≥37 kU/L、T3~4期及N2~3期(P<0.05,表2)。
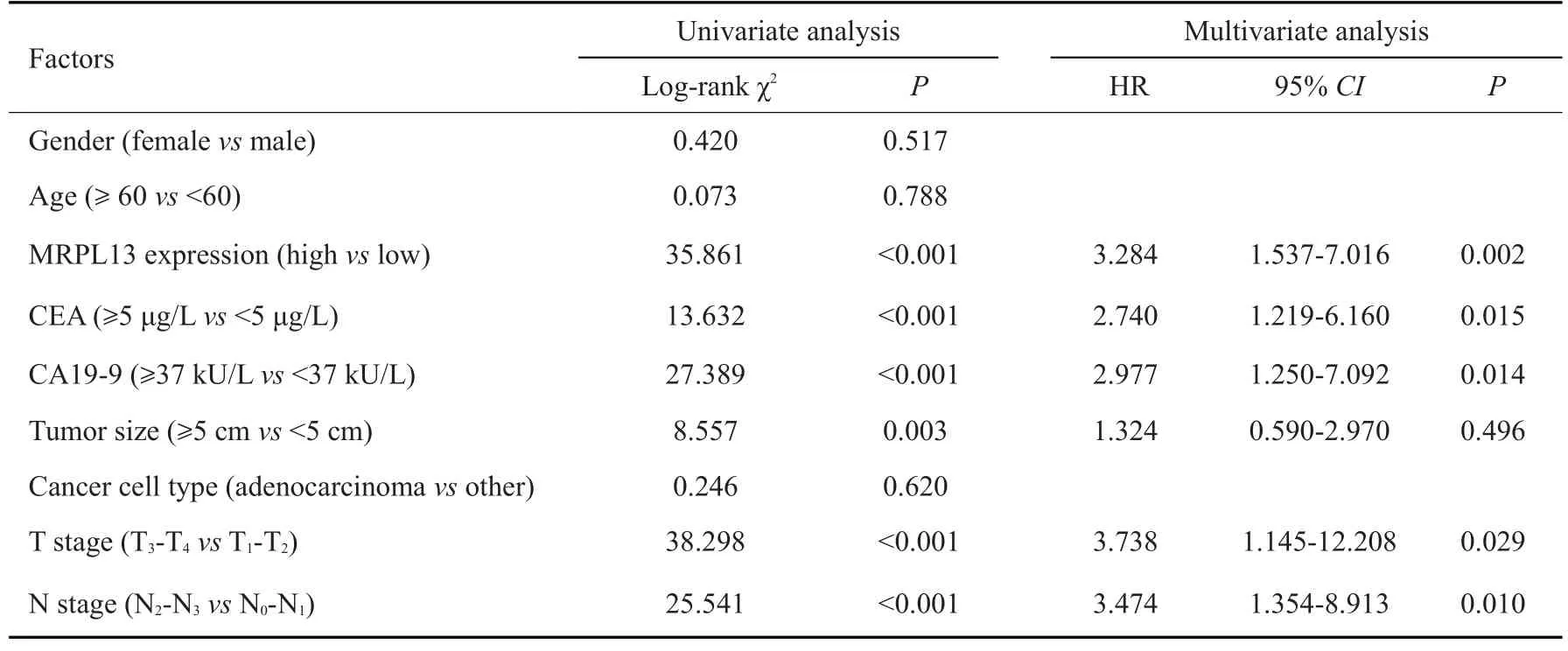
表2 胃癌患者术后5年生存期的影响因素分析Tab.2 Factors affecting 5-year survival of patients following radical gastrectomy
2.5 生信富集分析预测MRPL13可能和细胞周期、p53信号有关
通过KEGG和GO富集分析发现,MRPL13的功能可能与调控细胞周期和p53信号有关(图4)。
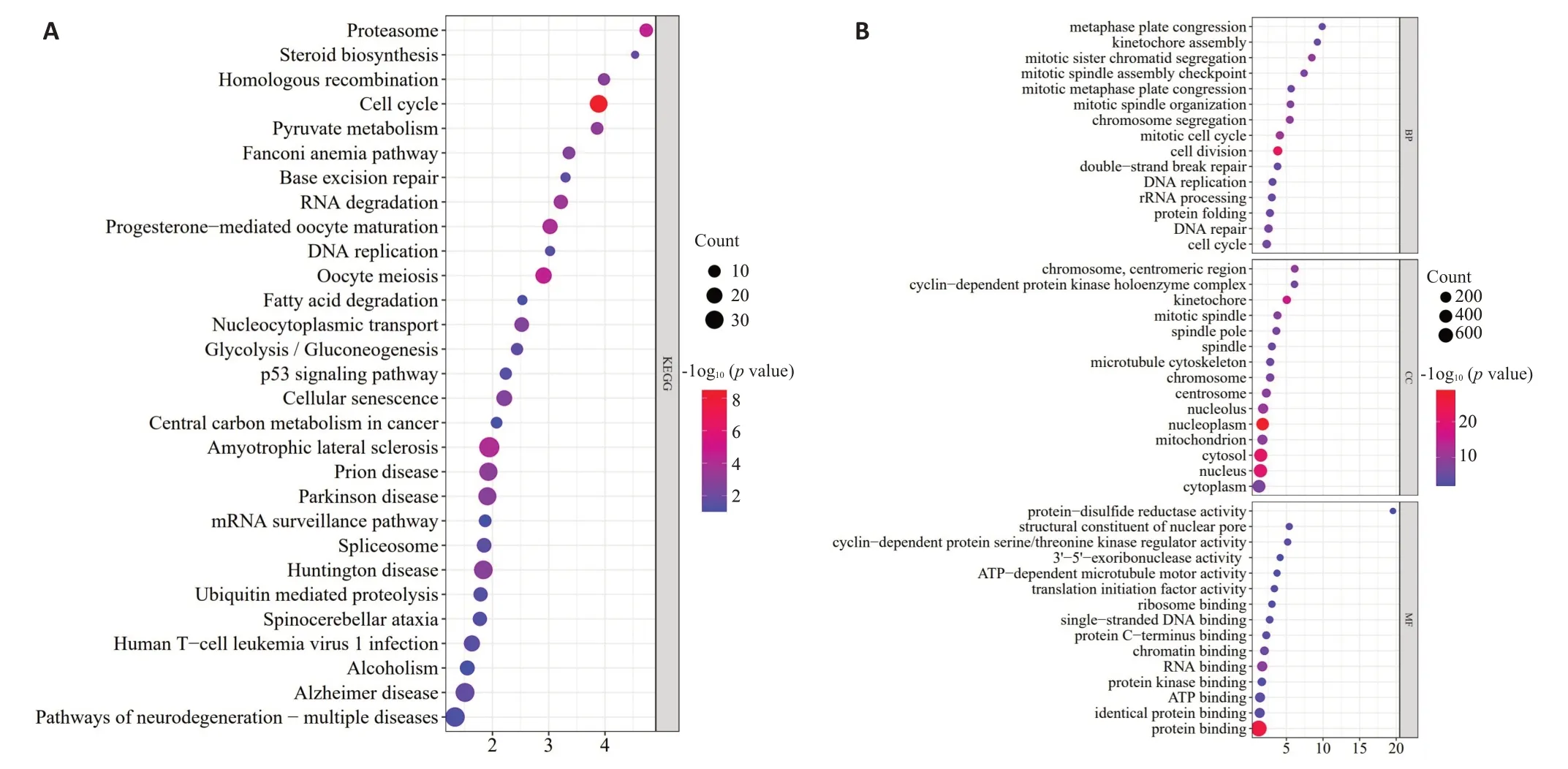
图4 MRPL13的KEGG和GO富集分析Fig.4 KEGG and GO enrichment analysis of MRPL13.A:KEGG enrichment analysis.B:GO enrichment analysis.
2.6 MRPL13体外促进胃癌细胞G1/S期转变和增殖
慢病毒调控胃癌细胞系(MGC-803和SGC-7901)MRPL13的表达量(P<0.05,图5A、B)。CCK-8(P<0.05,图5C)和克隆形成(P<0.05,图5D、E)实验表明:下调MRPL13抑制胃癌细胞增殖,而上调促进。流式结果发现:下调MRPL13抑制胃癌细胞的G1/S期转变,而上调相反(P<0.05,图5F、G)。免疫印迹结果表明:上调MRPL13促进胃癌细胞表达CyclinD1和CDK6(P<0.05,图5H、I),下调反之。

图5 MRPL13促进胃癌细胞的G1/S期转变和增殖Fig.5 High expression of MRPL13 promotes G1/S phase transition and proliferation in MGC-803 and SGC-7901 cells.A,B:Expression of MRPL13;C:A value of CCK-8;D,E:Colony-forming assay.F,G:Cell cycle.H,I:Expression of cyclin D1 and CDK6.n=3.LV:overexpression;Si:siRNA.*P<0.05 vs Control.
2.7 MRPL13在体内促进裸鼠移植瘤生长
分别用MRPL13上调、下调和对照的MGC-803和SGC-7901细胞构建裸鼠皮下成瘤模型,观察2周后发现:MRPL13上调组中移植瘤的体积和质量明显高于对照组,而下调组中移植瘤体积和质量均明显低于对照组(P<0.05,图6A~C)。免疫印迹结果显示:在移植瘤中,上调MRPL13促进CyclinD1和CDK6表达,而下调则抑制(P<0.05,图6D、E)。
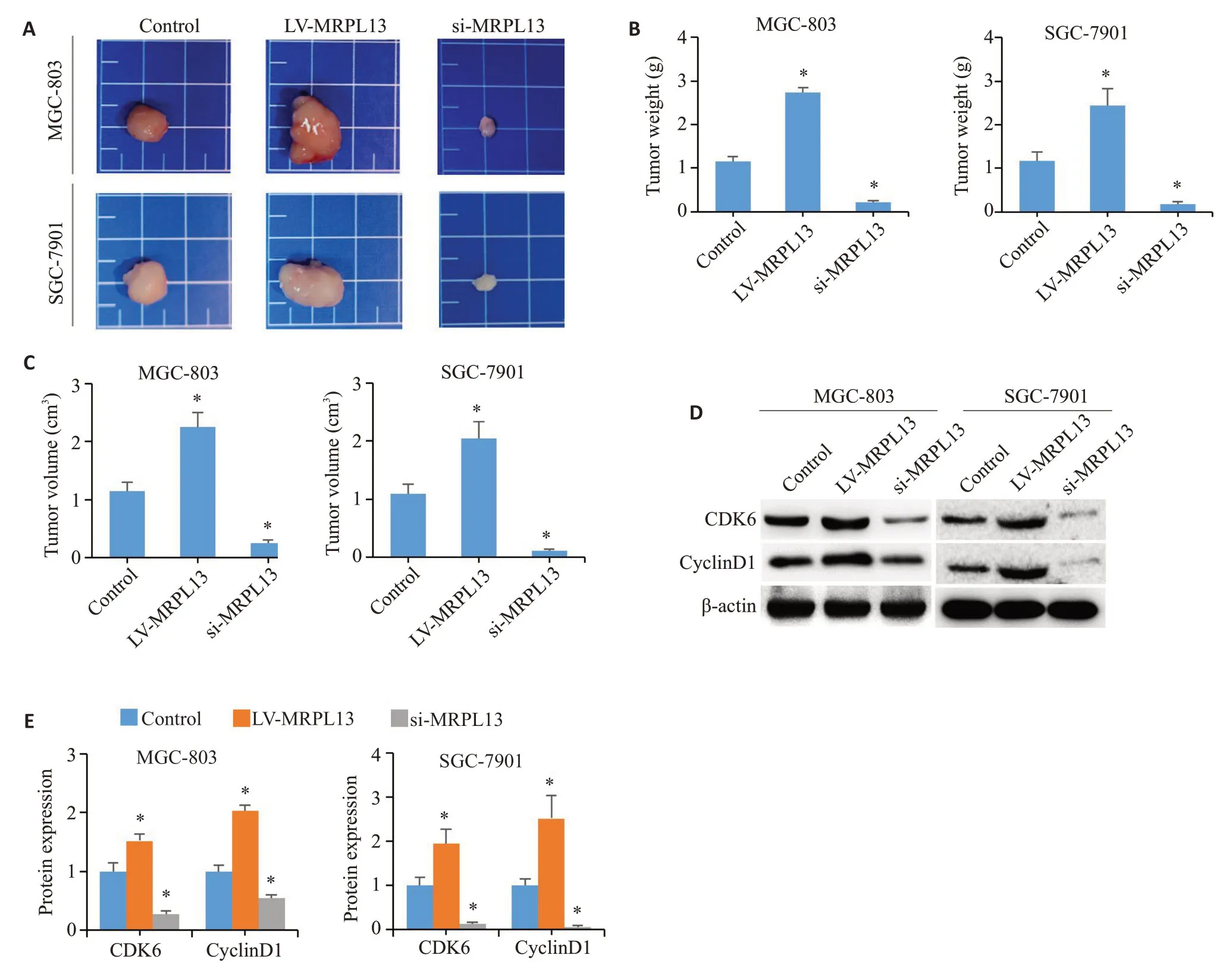
图6 MRPL13在体内促进裸鼠移植瘤生长Fig.6 High expression of MRPL13 promotes tumor growth in nude mice.A: Representative pictures of transplanted tumors.B:Transplanted tumor weight.C: Transplanted tumor volume.D,E: Expression of cyclin D1 and CDK6 in xenografts.n=3.LV: overexpression;Si: siRNA.*P<0.05 vs Control.
2.8 MRPL13可能通过抑制p53信号促进胃癌细胞周期进程和增殖
免疫印迹分析显示:上调MRPL13显著抑制胃癌细胞和裸鼠移植瘤中p53 和p21 的表达,而下调MRPL13则体外和体内促进p53和p21的表达(P<0.05,图7)。

图7 胃癌中MRPL13的表达升高抑制p53信号Fig.7 High expression of MRPL13 suppresses p53 signaling in gastric cancer.A,B:Expression of p53 and p21 in MGC-803 and SGC-7901 cells.C,D:Expression of p53 and p21 in transplanted tumors.n=3.LV:overexpression;Si:siRNA.*P<0.05 vs Control.
3 讨论
胃癌细胞恶性增殖不仅是影响进展和预后的关键因素[15,16],还是关键的治疗靶点[17,18]。通过对肿瘤公共数据库和本机构胃癌患者病例的联合分析,证实MRPL13在胃癌组织中表达升高且影响肿瘤恶性进展和术后生存期,体内外研究进一步发现MRPL13可通过抑制p53信号促进胃癌细胞周期进展。
受肺癌和乳腺癌中MRPL13表达研究的启发[11,19],我们通过公共癌症数据库和本机构病例两种分析途径进行分析并证实MRPL13 在胃癌组织中也呈现高表达。既往研究显示MRPL13可能参与恶性肿瘤的增殖过程[11,12],我们的数据显示其在胃癌组织中的表达水平和肿瘤增殖标志物Ki67显著正相关。为进一步阐明MRPL13的表达是否影响胃癌的临床进展,我们分析发现MRPL13高表达和CEA、CA19-9、T和N分期等肿瘤进展指标相关。尚未见MRPL13表达对于胃癌远期预后作用的报道,我们尝试分析并证实MRPL13高表达是影响胃癌患者5年生存期的独立风险因素。虽然以上发现MRPL13的表达水平影响胃癌进展和预后,但其作用途径和机制并不明确。
MRPL13作为线粒体核糖体蛋白家族成员具有多种生物学功能至今尚未完全阐明[11,20]。我们通过网络公共数据库富集分析发现,MRPL13与细胞周期调控有关。尚未发现有关MRPL13参与胃癌细胞周期进程调控的报道,我们采用慢病毒转染的方式调控胃癌细胞系MRPL13的表达,首先观察其对细胞增殖和周期的影响。由克隆形成和CCK-8实验结果得出,上调MRPL13促进胃癌细胞增殖;同时MRPL13表达的增加促进胃癌细胞G1/S转化、细胞周期相关蛋白CyclinD1和CDK6表达;而下调则抑制胃癌细胞增殖和周期。以上体外研究结果提示MRPL13具有调控胃癌细胞周期并促进细胞增殖的作用。此外,我们进一步采用裸鼠皮下成瘤模型证实了MRPL13在体内同样促进胃癌细胞增殖和细胞周期进程,而下调MRPL13表达可以抑制胃癌增殖和细胞周期。
为阐明MRPL13作用胃癌细胞的机制,我们通过KEGG富集分析发现MRPL13与p53信号有关。而p53作为一个抑癌基因[21,22]参与多种人类肿瘤的恶性转化[23,24],在DNA损伤修复和细胞周期调控中发挥关键作用[25-27]。我们进一步通过动物和细胞实验研究发现,MRPL13可体内外抑制p53信号通路的活化。该部分结果提示MRPL13促进胃癌细胞增殖和细胞周期进程可能和抑制p53信号有关。
我们的研究有以下价值:首先,研究发现MRPL13在胃癌中表达较高并影响预后,为临床上胃癌的预后判断提供了新的参考。既往虽无关于MRPL13影响胃癌预后的报道,但有研究表明MRPL13参与了乳腺癌的进展和预后[13]。泛癌分析发现MRPL13在多种恶性肿瘤中高表达,包括胃癌、乳腺癌和食管癌等。因此,这一研究在对其他肿瘤的病程进展和预后评估方面具有一定的借鉴作用。此外,本研究还发现MRPL13可能通过抑制p53信号促进胃癌细胞增殖和周期进程,拓展了对MRPL13生物学功能的认识,丰富了对胃癌的分子治疗靶标的研究[1,28-31]。
该研究存在以下不足:目前的研究属于回顾性研究,即使结合了公共癌症数据库,但限于样本量等因素,本研究临床部分结果还有待大规模的前瞻性研究来验证。本文尽管通过体内外研究结合的方式证实了MRPL13可能通过p53信号影响胃癌增殖和细胞周期,但在研究过程中我们认识到了MRPL13生物学功能的多样性,其还可能通过其他途径影响胃癌的恶性增殖。
综上,本研究发现MRPL13在胃癌中表达升高并影响远期预后,其可能通过抑制p53信号促进胃癌细胞增殖和细胞周期进程。