心脏祖细胞来源的外泌体可减轻心肌梗死小鼠的心肌损伤:基于mTOR途径诱导Treg细胞分化
何艳娟,李卓颖,申 琳,石丁华,李申堂
1长沙市第四医院儿科,湖南 长沙 410006;2中南大学湘雅三医院儿科,湖南 长沙410013
心肌梗死(MI)是缺血性心脏病/冠状动脉疾病的常见表现,是导致心血管疾病(CVD)患者死亡的重要原因[1]。心肌梗死时炎症反应明显加剧。虽然中度炎症有助于消化和清除受损细胞与细胞外基质,促进组织修复,但MI后过度和持续炎症随后将引发左室重塑和心力衰竭[2]。因此,控制炎症反应是减轻心肌损伤的重要策略之一。越来越多的证据显示,调节性T 细胞(Treg)在急性心肌梗死和心肌重塑中发挥重要保护作用[3]。MI后,Treg被募集到心脏抑制T细胞活化、减轻炎症反应发挥心肌保护作用[4]。Treg耗竭加重心脏炎症和左室功能障碍,而其扩增或过继转移有利于心肌梗死后心脏愈合[5]。因此,Treg在心肌梗死早期心脏重塑中发挥保护作用。
心脏祖细胞(CPCs)是心脏组织广泛分布的一类复合细胞,在应激和损伤条件下可活化并分化为新的心肌和血管细胞,已逐渐成为促进心脏再生和修复最有希望的干细胞类型之一[6]。心脏结构与功能的维持依赖于心脏内不同类型细胞间以及心脏与周围组织/器官间的通讯。外泌体是一种由细胞分泌的纳米级囊泡,在细胞间的物质、信号传递中具有重要作用[7]。近年来发现,不同细胞来源的外泌体对心肌损伤发生发展过程中的心肌保护起到至关重要的作用[8]。已有研究显示,心肌受损时,虽然CPC分化为心肌细胞途径受阻,但会通过某种机制减少心肌细胞凋亡[9]。心脏祖细胞来源外泌体(CPC-Exos)是CPCs发挥心肌保护功能的重要介质[10]。将CPC-Exos注射到小鼠体内能够抑制心肌细胞凋亡,修复瘢痕组织并改善心肌功能,减轻心肌损伤,其心肌保护作用的发挥与外泌体囊泡中含有的多种物质有关[11]。然而,CPC-Exos是否调控心肌梗死时Treg细胞分化国内外尚无研究报道。
本研究将从动物、细胞、分子水平探讨CPCs-Exos对MI时Treg分化的影响,旨在为MI的治疗提供新的理论与实验依据。
1 材料和方法
1.1 试剂
CD4 磁珠(美天旎生物技术有限公司),Cytofix/Cytoperm 破膜/固定试剂、红细胞裂解缓冲液、FITCCD4 抗体APC-CD25 抗体PE-Foxp3 抗体APC-IL-10抗体(BD),RPMI 1640(Giboco),anti-CD3 抗体,anti-CD28 抗体(Biolegend),mTOR 抗体、p-mTOR 抗体(CST)。
1.2 实验动物
C57BL/6雄性小鼠购自于长沙斯莱克景达实验动物有限公司,饲养于中南大学动物学部,实验前适应性喂养1周。所有动物均按照中南大学动物伦理委员会批准的动物饲养和指南进行(伦理号:2020-S562)。
1.3 小鼠心肌梗死模型的构建
取30只6~8周雄性C57BL/6小鼠,随机分成3组,即对照组、MI组、CPCs-Exos组。所有小鼠实施异氟烷吸入麻醉,去颈前毛发,作一前正中切口,分离气管,插入气管导管,接小动物人工呼吸机,连接II导联心电图(ECG),侧位开胸,并剪开心包、暴露心脏。MI组小鼠将尼龙线放置于左前降支冠状动脉下方并将其结扎。Control组小鼠则只暴露心脏,不结扎;CPCs-Exos组小鼠结扎左冠状动脉前降支后(LAD)后尾静脉注射CPCs-Exos。结扎缺血成功的标志:左心室顶前壁变白,ECG显示宽大的QRS波、ST段抬高、T波高。
1.4 CPC-Exos的提取
取6周龄雄性C57BL/6小鼠,断颈处死,取心脏,冲洗残留血液,剪碎至1 mm3,0.1%胶原酶消化25 min,细胞筛过滤,制备成心脏单细胞悬液。之后,通过免疫磁珠分选法分离得到Sca-1+细胞即CPCs。分离的CPCs细胞在含M199、EGM-2、无外泌体的10%FBS、10 nmol/L b-FGF、1%MEM非必需氨基酸和1%青霉素-链霉素的完全培养基中培养和保存。
收集的CPCs培养指定时间后,收集细胞上清液进行差速离心。具体步骤如下所示:300 g离心10 min,去除悬浮细胞;收集上清液,2000 g离心10 min,去除死细胞;收集细胞上清液,10 000 g离心10 min,去除细胞碎片;收集上清,0.22 μm滤器过滤细胞和细胞碎片;收集培养上清,100 000 g离心70 min,弃上清,加入100 μL PBS重悬管底沉淀(含外泌体)。
1.5 naïve CD4+T细胞的分离提取
取6周龄雄性C57BL/6小鼠,断颈处死,取脾脏,切碎后用PBS冲洗,再用红细胞裂解缓冲液(BD)裂解,裂解后的悬液加入胶原酶I和DNase I,并在RPMI 1640(Giboco)培养基、37 ℃条件下培养30 min,滤网过滤后再次用红细胞裂解缓冲液裂解,制成单细胞悬液。采用CD4+T细胞纯化试剂盒(美天旎)分离提取naïve CD4+T细胞,分选获得的naïve CD4+T细胞在RPMI 1640培养基中培养备用。
1.6 naïve CD4+T细胞活化
往六孔细胞培养板中加入500 μL/孔稀释的anti-CD3抗体(Biolegend,5 μg/mL),4 ℃过夜或37 ℃恒温箱中预包被2 h。用预冷无菌PBS洗涤之后,将分离的CD4+T细胞接种于预包被anti-CD3抗体的培养板中(1×106/孔),加入anti-CD28抗体(Biolegend,2 μg/mL)与CPCs-Exos或mTOR激活剂、mTOR抑制剂,培养24 h后检测相关指标。
1.7 流式细胞术检测Tregs细胞或CD4+IL-10+T细胞百分比
收集待处理细胞,加入Cytofix/Cytoperm破膜/固定试剂(BD)后在4 ℃下孵育20 min以渗透细胞膜。然后,加入FITC标记的抗CD4抗体(BD)、APC标记的抗CD25抗体(BD)与PE标记的抗Foxp3抗体(BD)对细胞表面进行染色,或破膜后加入FITC标记的抗CD4抗体与APC标记的抗IL-10抗体(BD),孵育30 min离心,去上清,加入100 μL PBS重悬细胞,上机检测。
1.8 Western blotting检测蛋白表达
将个CD4+T细胞按1×106/孔接种至六孔板中,依照不同分组处理后,收集细胞并低速离心弃上清,PBS清洗3次,采用RIPA裂解总蛋白,BCA试剂盒测定蛋白浓度。取30 μg总蛋白进行聚丙烯酰胺凝胶电泳,电泳结束后将其转移至PVDF膜并用5%脱脂牛奶室温封闭1 h,加入相应一抗(1∶1000),4 ℃孵育过夜,TBST清洗3次,加入二抗(1∶4000),室温孵育1h,TBST清洗3次,加入适量ECL 发光液显影,以GAPDH 为内对照,分析mTOR(CST公司)与p-mTOR(CST)的表达水平。
1.9 TTC染色
C57BL/6 小鼠结扎24 h 后取出心脏并采用预冷PBS清洗,用塑料薄膜包裹后-20 ℃冰箱速冻30 min。将心脏均匀切成5层,置于1%TTC溶液中(PBS新鲜配置)37 ℃避光孵育30 min。观察并分析心肌组织梗死面积,其中灰白色为梗死区,砖红色为非梗死区。染色后用4%甲醛固定心肌标本,拍照,采用图像分析软件分析并计算心肌梗死面积。
1.10 血清酶学检测
从右心室收集小鼠血液于1.5 mL干净EP管中,4 ℃静置2 h,3000 r/min离心20 min,轻轻吸取小鼠血清并保存于-80 ℃备用。全自动生化仪检测小鼠血清中LDH、CK-MB含量。
1.11 统计学处理
数据采用均数±标准差表示。图形绘制和统计学分析采用GraphPad Prism 8软件。两组间均数比较采用t检验;多组间比较采用单因素方差分析,两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 心脏祖细胞外泌体的提取和鉴定
流式细胞术结果显示99%为Sca-1+细胞即CPCs(图1A)。为明确CPCs培养上清提取物为外泌体,我们采用Western blot检测其是否带有外泌体表面的蛋白标记物,结果如图1B所示,以细胞蛋白为对照组,利用超高速离心提取的心源性祖细胞培养基内物质携带有外泌体形成所必需的分子标志物CD63、CD81 以及TSG101,提示外泌体提取成功。对CPCs-Exos大小进行分析,结果显示其总体分布为40~160 nm(图1C)。

图1 心脏祖细胞来源外泌体的鉴定Fig.1 Identification of CPCs-Exos.A:CPCs-Exos were identified by flow cytometry(n=3).B:CD63,CD81 and TSG101 expression levels in CPCs-Exos and CPCs(n=3).C:Analysis of the size of CPCs-Exo.
2.2 CPCs-Exos减轻MI所致心肌损伤
为了判断CPCs-Exos能否减轻MI所致心肌损伤,我们采用TTC染色观察梗死面积大小。如图2A所示,对照组TTC染色心肌组织未出现灰白色区域,而心肌梗死组小鼠出现明显灰白色区域(灰白色为梗死区,砖红色为非梗死区),外泌体组则梗死面积显著缩小。心肌酶学结果显示,与Control组相比,MI组小鼠CK-MB(P=0.0002)、LDH水平(P<0.001)显著增加(图2B、C)。与MI相比,CPCs-Exos组CK-MB(P=0.003)、LDH(P=0.003)含量显著降低(图2B、C)。
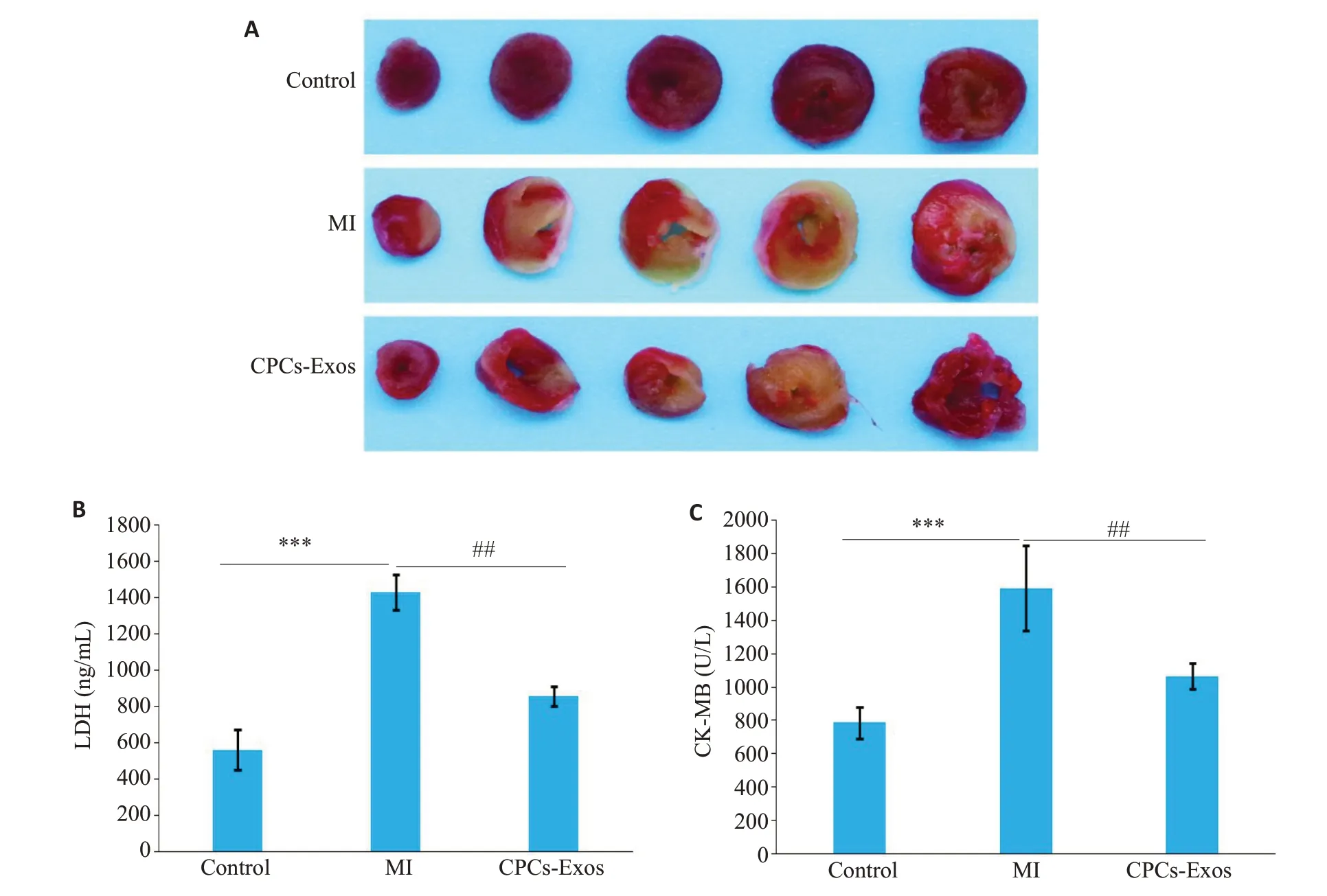
图2 CPCs-Exos减轻MI所致心肌损伤Fig.2 CPCs-Exos alleviate myocardial injury in mice with MI.A:TTC staining(n=3).B:LDH contents in sera(n=4).C:CK-MB contents in sera(n=4).***P<0.001;##P<0.01.
2.3 CPCs-Exos促进MI小鼠心肌组织Treg细胞分化
流式细胞术结果显示,与对照组相比,左冠状动脉结扎小鼠CD4+CD25+Foxp3+Treg 细胞分化增多,且表达抑炎性细胞因子IL-10 的CD4+T 细胞百分比显著增加(图3A、B)。进一步采用CPCs-Exos处理心肌梗死小鼠发现小鼠心脏组织中CD4+CD25+Foxp3+Treg(P=0.001)与CD4+IL-10+T(P=0.004)细胞百分比均显著增加(图3C、D)。
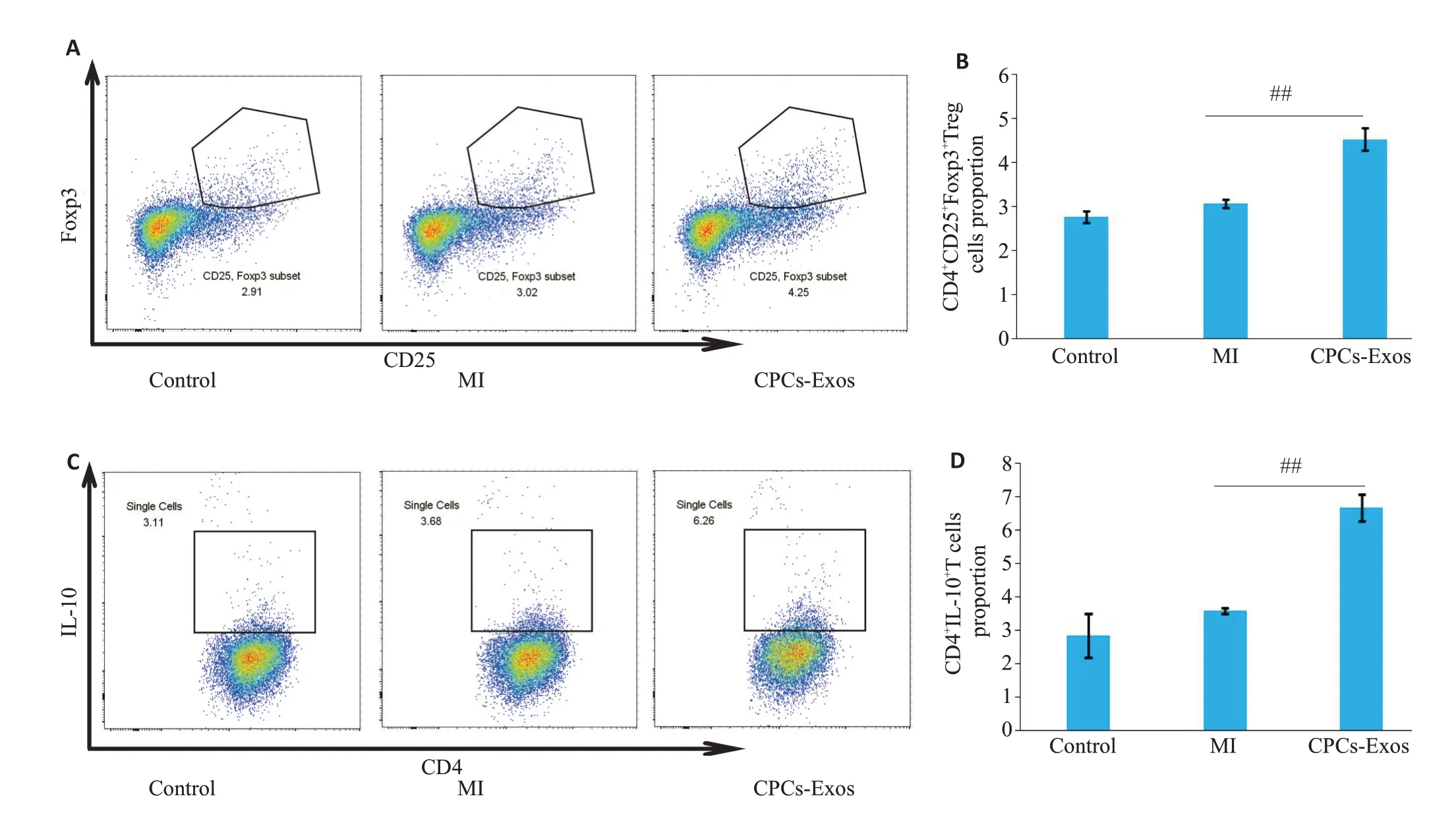
图3 CPCs-Exos促进MI小鼠心肌组织Treg细胞分化Fig.3 CPCs-Exos promote the differentiation of Tregs.A,B:CD4+CD25+Foxp3+Treg proportion in the cardiac tissue detected by flow cytometry(n=3).C,D:CD4+IL-10+T cell proportion in the cardiac tissue(n=3).##P<0.01.
2.4 CPCs-Exos促进Treg细胞分化
流式细胞术结果显示,与对照组相比,采用anti-CD3与anti-CD28抗体活化处理后CD4+CD25+Foxp3+Treg细胞分化增多(P=0.03),且表达抑炎性细胞因子IL-10的CD4+T细胞显著增加(P=0.004,图4A、B)。进一步采用CPCs-Exos 处理活化的CD4+T 细胞发现CD4+CD25+Foxp3+Treg(P=0.01)与CD4+IL-10+T细胞百分比均显著增加(P=0.004,图4C、D)。

图4 CPCs-Exos促进Treg细胞分化Fig.4 CPCs-Exos promotes the differentiation of Treg in vitro.A,B:CD4+CD25+Foxp3+Treg proportions in activated CD4+T cells(n=3).C,D:Percentage of CD4+IL-10+T cells detected by flow cytometry(n=3).*P<0.05,**P<0.01;##P<0.01.
2.5 心脏祖细胞来源外泌体调控mTOR信号通路
Western blotting 结果显示,与对照组相比,采用anti-CD3与anti-CD28抗体活化处理后CD4+T细胞中mTOR(P=0.04)、p-mTOR(P=0.04)蛋白水平有增加趋势(图5)。进一步采用CPCs-Exos处理活化的CD4+T细胞mTOR(P=0.009)、p-mTOR(P=0.009)蛋白水平表达显著增加,差异有统计学意义(图5)。

图5 CD4+T细胞中mTOR、p-mTOR表达水平Fig.5 Expression levels of mTOR and p-mTOR in CD4+T cells.*P<0.05;##P<0.01.
2.6 心脏祖细胞来源外泌体通过mTOR信号通路调控Treg细胞分化
流式细胞术结果显示,与对照组相比,采用mTOR激活剂处理后CD4+CD25+Foxp3+Treg(P=0.04)细胞与CD4+IL-10+T(P=0.01)细胞百分比均显著增加(图6),加入mTOR抑制剂后CD4+CD25+Foxp3+Treg(P=0.04)、CD4+IL-10+T(P=0.04)百分比下降明显(图6),差异有统计学意义。

图6 CPCs-Exos通过mTOR信号通路调控Treg细胞分化Fig.6 CPCs-Exos promotes differentiation of Treg in vitro through the mROR signaling pathway.A,B: CD4+CD25+Foxp3+Treg proportion in CD4+T cells treated with anti-CD3 and anti-CD28 antibody plus mTOR activator or inhibitor(n=3).C,D:CD4+IL-10+T cell proportion(n=3).*P<0.05;#P<0.05.
3 讨论
MI是缺血性心脏病/冠状动脉疾病的常见表现,是导致心血管疾病(CVD)患者死亡的重要原因[12]。众多研究发现CPCs-Exos在MI所致心肌损伤中发挥至关重要的作用。CPCs-Exos富含的妊娠相关血浆蛋白-A能够介导胰岛素样生长因子-1的释放,促进细胞内Akt与细胞外调节蛋白激酶的磷酸化,抑制Caspase-3/7活化,减少心肌细胞凋亡,减轻心肌损伤[13]。此外,还有研究发现人类新生儿来源的CPCs-Exos能够改善缺血再灌小鼠心功能[14]。本研究整体动物水平实验结果显示CPCs-Exo能够降低心肌梗死面积,减少LDH、CK-MB含量,减轻心肌损伤。
Treg 为抑制炎症反应的关键免疫细胞。活化的Tregs可通过CD39依赖的途径减轻心肌损伤[15]。二甲基鞘氨醇可通过磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B通路募集Tregs而减轻MI并促进心肌修复[16]。IL-2/抗IL-2复合体可诱导Tregs的扩增而促进心肌修复并减轻MI[17]。临床实验已发现维达列汀可通过募集Treg细胞而增强MIRI基础治疗的疗效[18]。因此,调控Treg细胞分化有望成为MI所致心肌损伤的潜在治疗策略。本研究整体动物与离体细胞水平发现CPCs-Exos 处理后CD4+CD25+Foxp3+Treg细胞百分比显著增加。IL-10为Treg细胞发挥抑炎功能的关键细胞因子,本课题组进一步采用流式细胞术检测CD4+T细胞中IL-10的含量,结果显示CPCs-Exos能够促进提高CD4+IL-10+T细胞比例,提示CPCs-Exos能够促进Treg细胞分化,增强其免疫抑制功能。
哺乳动物雷帕霉素靶蛋白(mTOR)是一种非典型的丝氨酸/苏氨酸激酶,在蛋白质合成、细胞骨架组装、细胞分化、增殖、存活及老化过程中起关键作用,该蛋白异常表达会引起一系列的疾病。近来,一些研究证实mTOR对Tregs的分化、迁移和识别至关重要[19]。氨基酸能够活化mTORC调控Tregs的功能[20]。派姆单抗通过活化mTOR而抑制人类Foxp3+iTregs的分化[21]。酸性微环境通过PI3K/mTOR信号通路调控Tregs分化并介导其功能而减轻肝脏缺血再灌注损伤[22]。围生期双酚A暴露诱导的雄性仔鼠Treg/Th17失衡与PI3K/Akt/mTOR信号通路的活化有关[23]。TGF-β1可通过PP2A的活化及mTORC调节的糖酵解的抑制而促进nTregs内Foxp3 的表达[24]。本课题组前期研究发现CPCs-Exos可通过Akt/mTOR信号通路促进H9C2细胞的生长[25]与抑制柯萨奇病毒B3诱导的心肌细胞凋亡[26]。然而,CPCs-Exos能否通过mTOR信号通路调控Treg细胞的分化目前尚无研究阐明。本研究首先采用anti-CD3与anti-CD28抗体处理naive CD4+T细胞,使其活化后加入CPCs-Exos。接着分别加入mTOR激活剂与抑制剂,观察mTOR对Treg细胞分化的影响。结果显示,mTOR激活剂能够促进CD4+CD25+Foxp3+Treg细胞分化,mTOR 抑制剂则降低Treg 细胞,提示CPCs-Exos通过调控mTOR信号通路介导Treg细胞分化。
综上所述,CPCs-Exos能够促进MI小鼠Treg细胞的分化,其机制可能与增强mTOR的活性有关。我们的研究为CPCs-Exos减轻心肌炎症、发挥心肌保护作用等提供理论基础与实验依据。