等离子体活化乳酸溶液对常见食源性致病菌的杀灭效果
李佳鸿,严龙飞,戴凡炜,陈敏惠,王玲,陈飞平,罗政,叶明强*
(1.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(2.南京农业大学食品科技学院,江苏南京 210095)
食源性致病菌污染是我国食品安全的重要危害之一。我国每年都会发生由大肠埃希氏菌、沙门氏菌、李斯特菌和金黄色葡萄球菌等引起的食物中毒事件,严重危害我国人民健康和食品安全[1]。在食品从原料生产到终端消费的过程中,其生产、运输、加工、销售等环节均易受到不同程度的致病菌污染,从而导致食源性疾病的发生,危害消费者健康。
等离子体冷杀菌技术是近年来新兴的一种非热杀菌技术,具有安全清洁、绿色环保、简单高效等特点,在食品安全领域备受关注。等离子体活化水(Plasma-Activated Water,PAW)是通过等离子体发生装置在水表面或水下进行等离子体放电处理后制得富含活性基团的水溶液[2,3]。因等离子体活化水具有良好的流动性、无毒无残留等优点,相较于大气压等离子体冷杀菌技术在食品领域更受学者青睐。近年来,国内外学者对等离子体活化水的灭菌机理、理化性质、生产应用均有报道,康超娣[4]研究发现P.deceptionensisCM2经活化60 s的PAW处理6 min后可灭活3.43 lg CFU/mL的细菌;鉏晓艳等[5]研究发现活化60 min的PAW处理30 min后对巴氏葡萄球菌的抑菌率为95.25%;汪家权等[6]发现用活化60 min的PAW处理金黄色葡萄球菌生物膜30 min后能灭活约4.8个对数值的细菌。
乳酸是自然界中广泛存在的有机酸,被公认为天然抗菌剂,美国食品及药物管理局认定其为“公认安全的”,常用于冷鲜肉、新鲜果蔬等食品的抑菌保鲜以及食品加工中[7,8]。Huang等[9]研究发现用40 ℃、1%乳酸清洗染菌菠菜幼叶5 min,可有效杀灭2.7个对数值的大肠杆菌O157:H7;Youssef等[10]研究发现使用2%~5%的乳酸可以有效抑制牛肉表面的大肠埃希氏菌的生长;Mahmoud[11]研究发现用150 mg/mL的乳酸溶液浸泡牡蛎10 min后可使牡蛎表面的创伤弧菌降低至检测限以下;Aline等[12]研究发现5%乳酸在染菌鸡皮贮藏期间能有效抑制空肠弯曲杆菌和肠炎沙门氏菌的生长。
PAW的杀菌效果随着处理时间延长而提高,但过长的处理时间易导致新鲜蔬果、肉类及其制品等食品的品质下降。研究表明PAW与抑菌物质复配使用可以提高杀菌效率[13]。Jing等[14]发现分别用一定浓度乳酸溶液制成的等离子体活化乳酸溶液(Plasma-Activated Lactic Acid,PALA)和PAW处理沙门氏菌,前者细菌形态有更明显的破坏,细胞内氧化应激损伤水平更高。此外,乳酸的存在可以进一步降低溶液的pH值,并改变细胞膜的通透性[15],使由等离子体产生的活性物质更易进入细胞内。本研究以纯培养大肠埃希氏菌、金黄色葡萄球菌、单核增生李斯特菌和沙门氏菌等常见食源性致病菌为模型,研究PALA对纯培养食源性致病菌的杀灭效果,为食品保鲜及安全生产提供理论基础以及技术支撑。
1 材料与方法
1.1 实验材料
大肠埃希氏菌(Escherichia coli,GDMCC 1.223=CMCC(B)44102)、单核增生李斯特菌(Listeria monocytogenes,GDMCC 1.347=ATCC19115)、金黄色葡萄球菌(Staphylococcus.Aureus,GDMCC 1.441=ATCC6538)、沙门氏菌(Salmonella enteritidis,GDMCC1.237=CMCC(B)50115),广东省科学院微生物研究所;平板计数琼脂(Plate Count Agar,PCA)、营养肉汤培养基(Nutrient Broth,NB)、营养琼脂培养基(Nutrient Agar,NA),广东环凯微生物科技有限公司;氯化钠、硫代硫酸钠,福晨(天津)化学试剂有限公司;乳酸,天津市大茂化学试剂厂。
1.2 主要仪器设备
PG-1000ZD型低温等离子液体处理发生器,南京苏曼等离子科技有限公司;5810R型高速离心机,德国Eppendorf公司;GR60DP型高压灭菌器,致微(厦门)仪器有限公司;DY-200B全温培养摇床,天津市泰斯特仪器有限公司;Master Touch-Q15型去离子纯水机,上海和泰仪器有限公司;LRH-150F型生化培养箱,上海一恒科学仪器有限公司;PB-10标准型pH计,德国Sartorius公司。
1.3 实验方法
1.3.1 制备菌悬液
参考相启森等[16]的方法并稍作改进,分别从-80 ℃冰箱中取出单核增生李斯特菌、沙门氏菌、大肠埃希氏菌和金黄色葡萄球菌等菌种冻干管,室温解冻后挑取一环菌液于营养琼脂培养基上活化培养24 h,选取活力旺盛的单菌落接种至营养肉汤液体培养基中,于37 ℃、160 r/min恒温摇床培养12 h。取20 mL培养物于50 mL离心管,于25 ℃、4 000 r/min离心5 min,弃去上清液后加入等体积无菌生理盐水并混匀,制成浓度约为8 log CFU/mL的菌悬液备用。
1.3.2 等离子体活性乳酸溶液的制备
参照赵莹等[17]的方法并略作修改,选用空气为工作气体,调整低温等离子液体处理发生器工作电压为19 kV,工作电流0.024 mA,电流频率为20 kHz,取250 mL一定浓度的乳酸溶液于500 mL烧杯中,将等离子体射流装置喷枪置于烧杯液面下约10 mm处理一定时间,制得一定浓度PALA备用。
1.3.3 单因素实验
保持低温等离子液体处理发生器的工作状态不变,分别考察PALA体积分数(0%、0.05%、0.1%、0.2%,V/V)、活化时间(0、30、60、90和120 s)、反应时间(0、2、4、6、8、10 min)对纯培养大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌、单核增生李斯特菌的影响,以微生物实验结果评价PALA的杀菌效果,确定最佳因素水平。在考察单一变量对4种食源性致病菌的影响时,其余变量均保持最高水平。
1.3.4 微生物测定
参照《GB 4789.2-2016 食品安全国家标准食品微生物学检验菌落总数测定》并略做修改[18],取2 mL菌悬液和等体积等离子体活化乳酸于10 mL离心管中,均质后静置反应一定时间后加入50 μL 0.1 mol/L Na2S2O3以终止反应[19]。用质量分数为0.85%无菌NaCl进行梯度稀释后,吸取1 mL稀释液与约10 mL冷却至46 ℃的PCA混匀,待琼脂冷却凝固后倒置于37 ℃培养箱中培养18~24 h,进行菌落计数并统计,结果以lg CFU/mL表示。
1.4 数据处理及分析
所有实验均独立重复3次,结果以平均值±标准偏差显示,采用SPSS 26.0软件进行单因素方差分析,利用Duncan’s多重比较进行显著性差异分析。采用Origin 2020进行绘图。
2 结果与分析
2.1 不同体积分数PALA对食源性致病菌的影响
由图1a、1b可知,在保持PALA活化时间为120 s、反应时间为10 min不变的前提下,大肠埃希氏菌及沙门氏菌2种革兰氏阴性菌菌落总数随着PALA体积分数的升高而不断下降,大肠埃希氏菌菌落总数减少了7.48个对数值,沙门氏菌菌落总数减少了4.43个对数值,其中在PALA体积分数达到0.2%时,大肠埃希氏菌的杀灭率达100%;而在图1c、1d)中,金黄色葡萄球菌及单核增生李斯特菌的菌落总数随PALA体积分数升高而缓慢降低,金黄色葡萄球菌菌落总数减少了3.28个对数值,单核增生李斯特菌菌落总数减少了3.29个对数值,其中金黄色葡萄球菌的菌落总数在0.1%和0.2%体积分数的PALA处理后无显著差异(P<0.05);对比图1a、1b和图1c、1d,发现阳性对照组0.00%浓度(即等离子体活化水,Plasma-Activated Water,PAW)可以杀灭2.95 log CFU/mL的大肠埃希氏菌和沙门氏菌,而仅能杀灭0.79 log CFU/mL金黄色葡萄球菌和0.70 log CFU/mL单核增生李斯特菌。这与相启森等[16]研究结果一致。这是因为革兰氏阳性菌G+相比革兰氏阴性菌G-具有更厚的细胞壁,其肽聚糖结构更为致密,能在一定程度上阻碍PALA中活性基团对其细胞膜的氧化。研究表明,在等离子体放电过程中会产生大量的活性氧(Reactive Oxygen Species,ROS)和活性氮(Reactive Nitrogen Species,RNS)基团,这些活性基团向水扩散的过程中进一步反应生成ONOO-、NO2-、NO3-、HO2·、H2O2、O3、1O2(单线态氧)等活性化学物质,在酸性环境下HO2·会促使细胞膜脂质氧化,并与其他活性物质共同作用,促使微生物细胞裂解[20-23]。PALA生成过程中产生的ROS和RNS部分反应见表1。随着环境中的H+的增加,PALA中活性基团的氧化能力进一步增强,加快微生物细胞膜脂质的氧化破裂,诱导微生物细胞氧化应激,造成微生物细胞损伤和死亡[24-27]。

表1 PALA产生过程中部分化学反应Table 1 Part of the chemical reaction for PALA production

图1 不同浓度PALA对4种食源性致病菌菌落总数的影响Fig.1 Effects of different concentrations of PALA on the total number of colonies of four foodborne pathogens
4种食源性致病菌的菌落总数均随着PALA的体积分数升高而降低。这与赵电波等[28]发现一致。赵电波等[28]研究发现,等离子体活性水联合苯乳酸处理大肠杆菌O157:H7,其杀灭率随苯乳酸浓度的升高而增强。因0.2%的PALA对4种致病菌杀灭效果最好,经处理后大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌以及单核增生李斯特菌分别减少了7.48、4.43、3.28和3.29 log CFU/mL,杀菌率达99.9%以上(P<0.05),故选择体积分数为0.2%的PALA进行后续实验。
2.2 不同反应时间对食源性致病菌的影响
由图2可知,在保持PALA体积分数为0.2%、活化时间为120 s不变的前提下,PALA对4种致病菌的杀菌率随着反应时间的增加而增大,在10min时大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌以及单核增生李斯特菌分别减少了7.76、4.56、4.48和4.27 log CFU/mL,4种致病菌的杀菌率均达到99.9%(P<0.05)。周小霞等[29]研究发现经处理30 min后有5.53 log CFU/mL的金黄色葡萄球菌生物膜被灭活,PAW对金黄色葡萄球菌生物膜的灭活效果随等离子体处理时间的延长而增加,这与本研究结果一致。图2a中的大肠埃希氏菌在反应10 min后杀菌率可达100%(P<0.05),图2b~d中沙门氏菌、金黄色葡萄球菌和单核增生李斯特菌的杀菌率达99.9%以上(P<0.05)。而沙门氏菌在反应10 min后仍有3.39 log CFU/mL,相比同为G-的大肠埃希氏菌对PALA的敏感性更低。这可能是沙门氏菌可以通过改变流出系统、孔蛋白和膜渗透性来增强自身的耐药性[30],降低PALA对其细胞膜的氧化损伤,防止胞内蛋白质、核酸等流失。

图2 不同反应时间对4种食源性致病菌菌落总数的影响Fig.2 Effects of different reaction times on the total number of colonies of four foodborne pathogens
2.3 不同活化时间PALA对食源性致病菌的影响
由图3可知,在保持PALA体积分数为0.2%、反应时间为10 min不变的前提下,空白对照组(CK)与阳性对照组(活化0 s,即0.2%乳酸溶液)对4种致病菌的影响较小,未经活化的0.2%乳酸溶液仅能杀灭0.39 log CFU/mL大肠埃希氏菌、0.26 log CFU/mL金黄色葡萄球菌、0.09 log CFU/mL沙门氏菌和0.25 log CFU/mL单核增生李斯特菌,说明单纯的乳酸溶液无法高效杀灭食源性致病菌,这与汪陈洁[8]的研究结果相似。在保持浓度和反应时间不变的情况下,随着活化时间的增加,PALA对4种致病菌的杀灭率逐渐升高:活化30 s可杀灭菌落总数0.09~1.49 log CFU/mL;活化60 s时可杀灭菌落总数1.98~2.39 log CFU/mL;活化90 s时可杀灭菌落总数2.37~3.53 log CFU/mL;活化120 s时杀灭菌落总数均大于3.9 log CFU/mL。这可能因为PALA中的活性物质需要一定时间积累并达到一定浓度才能高效杀灭微生物,当活化时间较短时,溶液中的ROS和RNS等未能积累达到杀灭微生物的阈值。研究表明,ROS和RNS会导致溶液的氧化还原电位(Oxidation-Reduction Potential,ORP)升高,而ORP是影响细菌失活的重要原因之一,且ORP值随等离子体活化时间的延长而增加并逐渐趋于平稳[4,24,27]。
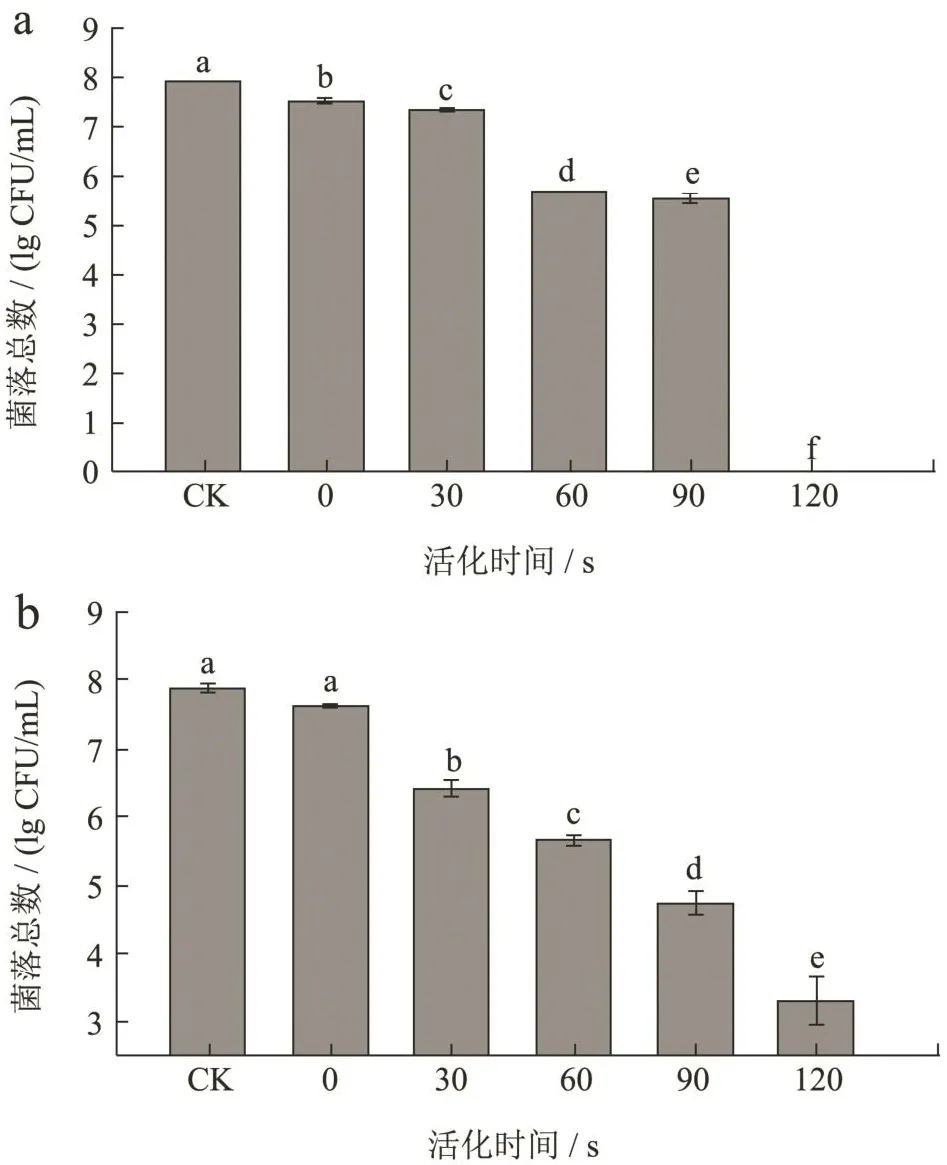

图3 不同活化时间PALA对4种食源性致病菌菌落总数的影响Fig.3 Effects of different activated times on the total number of colonies of four foodborne pathogens
3 结论
综上所述,PALA能够有效杀灭大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌和单核增生李斯特菌,且其杀灭效果随PALA体积分数的升高、活化时间以及反应时间的延长而提升。经活化120 s最终体积分数为0.2%的PALA反应10 min,4种纯培养食源性致病菌杀灭率均达99.9%(P<0.05),其中约杀灭了大肠埃希氏菌7.71 log CFU/mL、沙门氏菌4.52 log CFU/mL、金黄色葡萄球菌4.03 log CFU/mL、单核增生李斯特菌3.90 log CFU/mL。在今后的研究中应进一步明确PALA的杀菌机理,系统评价PALA对食品表面微生物的杀灭效果以及对食品感官、理化性质、营养价值和贮藏期等指标的影响,为未来PALA在食品领域产业化、规模化的应用提供理论基础及技术支撑。

