多重PCR技术在植物病原物检测中的应用
曹子健, 邱艳红, 王爽, 赵娟, 郑素月, 乔广行, 秦文韬*
(1.北京市农林科学院植物保护研究所,北京 100097; 2.河北工程大学园林与生态工程学院,河北 邯郸 056038; 3.北京市农林科学院蔬菜研究所,北京 100097; 4.北京市颐和园管理处,北京 100097)
受气候环境、种植模式、经济全球化等因素的影响,重大植物病害频发,引发了一系列严重的生态环境及农业安全问题,成为全球农业面临的重要挑战[1-2]。病原物能侵染不同生长阶段的植物引起严重的植物病害,危害农业安全。对病原物进行检测和诊断有助于掌握植物病害的流行病学、地理分布等重要信息,从而对植物病害综合管理和控制策略提供依据,有效避免植物病原物的引入和传播[3],因此,建立高效准确的病原早期预警和快速诊断体系是防控植物病害的关键[4]。
早期植物病原的诊断依赖于症状识别和简单的分离培养技术。传统检验技术远不能满足当前农业精准化发展需求。随着技术的发展逐渐出现了蛋白水平鉴定、核酸分子检测、光谱分析检测及多技术联合检测等方法。其中,以聚合酶链式反应(polymerase chain reaction,PCR)技术为基础衍生出的一系列核酸分子检测方法凭借检测速度快、准确率高、灵敏度高等优点得以快速发展并广为利用。1988 年,Chamberlain 等[5]首次报道了多重PCR(multiplex PCR,mPCR)技术,并将其用于同步扩增多个序列以检测基因的缺失情况。由于具有高效、操作简便、成本低廉以及系统性的明显优势,该技术在近几十年来得以迅速发展,在植物病原检测上的应用尤为突出。因此本文系统综述了多重PCR 技术在植物病原真菌、细菌、病毒、线虫检测中的应用现状,并分析了该技术目前存在的问题,展望了该技术未来的发展前景,以期为植物病原物的早期诊断和植物病害的科学防控提供技术支撑,同时也为该技术更好地应用提供借鉴。
1 多重PCR技术的原理
多重PCR 技术在传统PCR 技术的基础上发展而来,可在单一反应体系中针对多个位点扩增以实现多种靶标病原的检测(图1),具有通量高、成本低的优点[6]。由于多重PCR 是在同一反应中利用多对引物进行靶标扩增,随着引物的增加,引物间的相互作用会降低检测灵敏度,增加检出难度[7],因此在构建多重PCR 体系时,要求引物之间的退火温度尽可能相近,引物对的扩增产物能够区分,且在反应过程中引物间不能交叉。经过多年发展,多重PCR 衍生出多种类型,根据靶标类型可分为巢式PCR(nested PCR,nPCR)、系统型特异多重PCR(phylotype-specific multiplex PCR,Pmx-PCR)、多重串联PCR(multiplexed tandem PCR,MT-PCR)等;依据PCR种类又包括实时荧光定量PCR(quantitative real-time PCR,qPCR)、反转录PCR(reverse transcription-PCR,RT-PCR)、数字PCR(digital PCR,dPCR)等;依据PCR 反应平台分为微流控的PCR、固相载体的PCR 等[8-9]。目前,多重PCR 不仅能进行基因分型以及多病原快速检测,还可以用来研究某些微生物群落的结构,并评估微生物的群落动态或对环境变化的响应[10]。
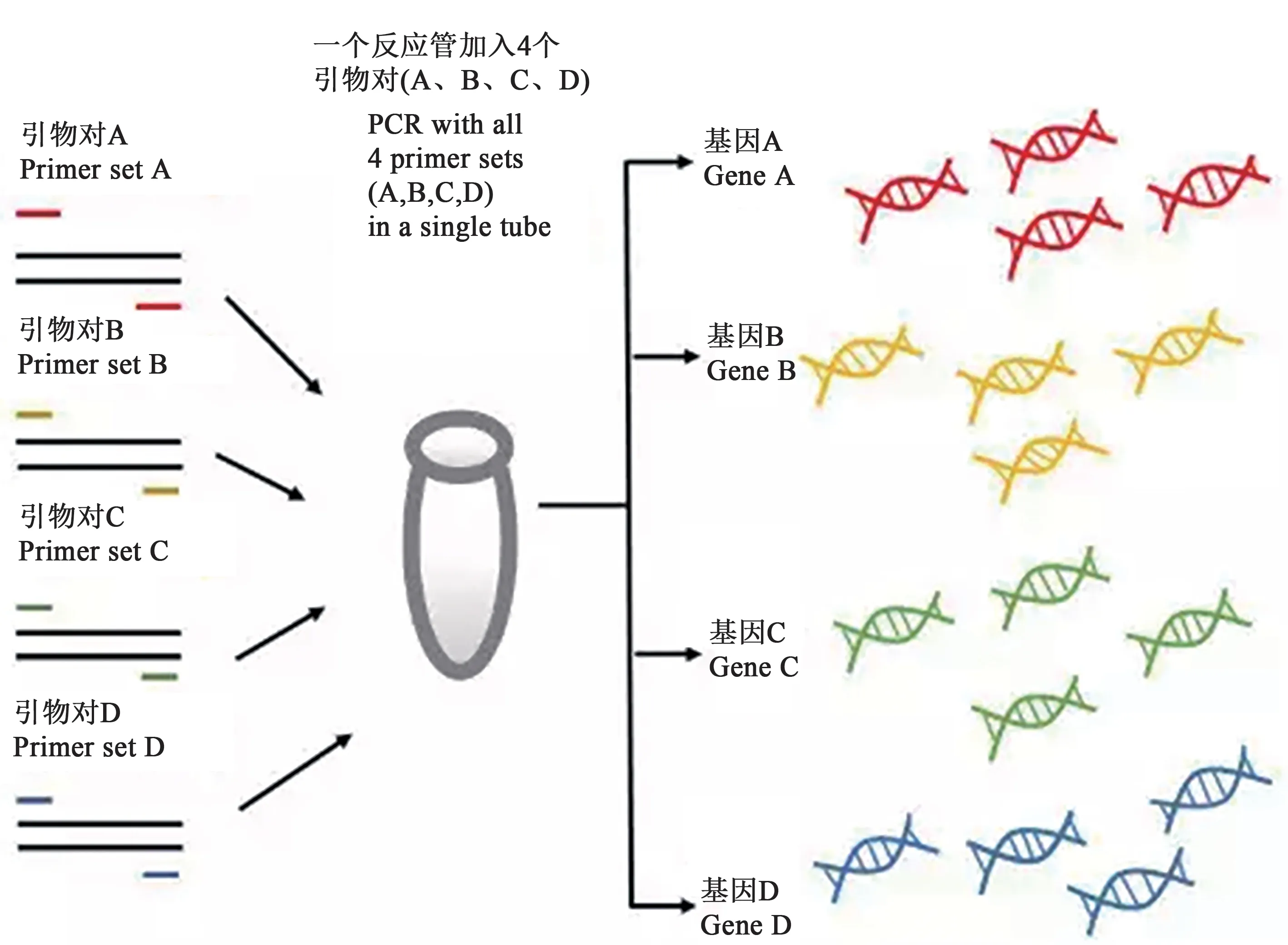
图1 多重PCR原理Fig. 1 Principle of multiplex PCR
2 多重PCR 技术在植物病原物检测中的应用
2.1 植物病原真菌检测
真菌是第一大植物病原,植物病原真菌快速检测是植物病害综合防控的重要基础[11]。植物病原真菌的传统诊断方法需要对病原培养,然后进行显微镜观察及致病性试验,该方法周期较长,且要求检验人员具备一定的专业知识;此外,不同病原真菌形态特征较相似,在同一寄主上可能导致相似的症状,因此,病原真菌的精准诊断是制定科学防控策略的前提和关键。利用高特异性的DNA 检测技术可有效提高植物病原真菌鉴定的速度和准确性[12]。目前,多重PCR 技术已经广泛应用于常见的植物病原真菌检测过程中,并为植物真菌病害的防控提供了技术支撑。
炭疽菌(Colletotrichum)是引起禾本科植物、果树、花卉、蔬菜等多种植物炭疽病的全球性植物病原真菌[13]。杨怡华等[14]通过巢式双重PCR 技术检测麦冬炭疽病病原菌山麦冬炭疽菌(C. liriopes)和黑斑病病原菌互隔交链孢菌(Alternaria alternata),灵敏度高达100 pg‧µL-1DNA。Wang等[15]应用高分辨率熔解(high-resolution melting,HRM)技术对Colletotrichum spp.、疫霉菌(Phytophthora spp.)和菜豆壳球孢(Macrophomina phaseolina)的多重PCR反应产生的特异性融化峰进行分析,提高了草莓冠腐病病原体检测和分化的准确性。
立枯丝核菌(Rhizoctonia solani)引起的植物根腐病是常见的土传病害,可为害多种蔬菜的幼苗、根、叶和茎。Wallon 等[16]建立了基于ITS(internally transcribed spacer)序列的R. solani及其融合群AG1-IB 的双重qPCR 体系,靶标的检测限达到1 µg菌核·g-1干燥土壤。
镰刀菌属(Fusarium spp.)在自然界分布极广,普遍存在于土壤及动植物有机体,能引起小麦、水稻和蔬菜等植物的根腐、茎腐、花腐和穗腐等多种病害[17]。刘芮池等[18]建立了土传病原菌大丽轮枝菌(Verticillium dahliae)、尖孢镰刀菌(F.oxysporum)和瓜果腐霉(Pythium aphanidermatum)的三重PCR(triplex PCR)检测体系,检测灵敏度分别为每克土壤105个孢子、106个孢子及10-2mg菌丝。Villarino 等[19]建立的双重PCR 体系每克土壤中可最低检测出107孢子和105孢子的腐皮镰刀菌(F. Solani)和F. oxysporum。
疫霉属(Phytophthora spp.)真菌是马铃薯和番茄晚疫病的病原,常引发毁灭性灾害[20]。Liao等[21]通过优化引物、模板浓度以及扩增程序,建立能同时检测疫霉属以及树莓疫霉根腐病菌(P.rubi)、草莓疫霉红心病菌(P. fragariae)、栗黑水疫霉(P. cambivora)的四重PCR 反应体系,与常规PCR 技术相比,四重PCR 技术对靶标病原的检测灵敏度虽有所降低,但特异性和通量均有提升。同时,多重PCR 技术也被用来检测仙人掌上的病原烟疫霉(P. nicotinae)和恶疫霉(P. cactorum)[22]。
腐霉属(Pythium spp.)属于卵孢菌纲,许多腐霉属物种对植物具有致病性,在苗圃、农田等不同生产系统中引起诸多植物病害,如湿腐、根腐、软腐和茎腐等[23-25]。Ishiguro 等[26]开发了用以鉴定瓜果腐霉菌(Py. aphanidermatum)、旋柄腐霉(Py.helicoides)和群结腐霉(Py. myriotylum)的多重PCR技术。
此外,大斑突脐蠕孢(Exserohilum turcicum)和玉蜀黍平脐蠕孢(Bipolaris maydis)引起的大斑病和小斑病是影响玉米健康生长的2 种重要病害。代玉立等[27]基于交配型基因建立的多重PCR检测体系能够很好地区分上述2 种病原及其相应的近缘种,灵敏度可达0.1 ng‧µL-1DNA。
2.2 植物病原细菌检测
细菌作为植物病害的第二大病原,可在种子、病残体、土壤、粪肥、杂草寄主或昆虫体内越冬或越夏,侵染植物后可出现腐烂、坏死、萎蔫、变色、畸形等症状。有些植物细菌病害和生理性病害症状相似,一些病原难以人工培养,采用多重PCR技术可有效提高植物病原细菌的检测效率。
黄单胞菌属(Xanthomonas spp.)细菌能导致多种植物产生非特异性的症状,形态上难以区分,因此相关学者开发了许多快速、灵敏和特异的诊断方法[28]。Strayer 等[29]研究发现,4 种黄单胞菌的hrpB7 基因存在单核苷酸序列多态性,基于此设计了4组特异性探针和2对引物,开发的多重实时荧光PCR 能够检测105~108CFU‧mL-1的细菌DNA。在柑橘溃疡病检测方面,建立了针对X.citri pv. citri、X. citri pv. aurantifolii B 型和C 型3 种柑橘溃疡病菌的多重PCR 检测方法[30-31]。Jouen等[32]基于2 套引物和探针建立的双重qPCR 方法可检测Xanthomonas spp.,其中一套引物源于红掌细菌性枯萎病病原X. phaseoli pv. dieffenbachiae 的ABC 转运蛋白基因;另一套源于红掌的查尔酮合酶基因作为内参。Webber 等[33]基于膜蛋白基因(filamentation temperature sensitive X,ftsX)和奎尼酸代谢基因(quinate metabolicgene,qumA)设计引物,建立了X. arboricolapv.corylina的双重PCR 检测方法。
棒形杆菌属(Clavibacterspp.)能侵染多种植物,引起细菌性溃烂、叶片萎蔫,形成水疱样斑点,最终导致整株坏死。Thapa 等[34]基于番茄细菌溃疡病病原菌(C. michiganensis)的染色体基因rhuM和tomA设计引物,并以植物16S rDNA 基因作为内参建立了多重PCR 的诊断平台,检测限为0.01 ng DNA。
茄科雷尔氏菌群(Ralstonia solanacearumspecies complex,RSSC)引起的植物青枯病是一种破坏性极强的细菌性病害,RSSC 包含1 个高度异质性的细菌群,且种群的寄主范围十分广泛。He等[35]利用Pmx-PCR结合基于巨胞质内切葡聚糖酶基因(egl)的系统发育树,对不同植物RSSC 菌株进行系统分型。Sharma等[36]同样通过多重PCR检测对卢旺达马铃薯青枯病RSSC 进行系统分型,并依此绘制流行病学推断分布图。研究青枯病RSSC 群体分布和系统发育变异可为制定植物青枯病的防治策略提供依据[37]。李得铭等[38]利用3 对特异性引物构建了番茄青枯病菌(R.solanacea)的三重PCR体系,可以精准的从植株与土壤中定性监测到该病原菌,单一PCR 检测灵敏度为5 ng‧µL-1DNA,而三重PCR 方法对青枯菌的模版DNA 检测浓度最低为10-3ng‧µL-1,大大提高了土壤中青枯病病原菌的监测监控能力,并能有针对性地预防和控制番茄病害,为番茄产业的可持续发展提供了强有力的技术支撑。
谷枯病、白叶枯病、细菌性褐条病是水稻生产中的3 种主要细菌性病害,病原菌分别为荚壳伯克霍尔德氏菌(Burkholderia glumae)、稻黄单胞菌水稻致病变种(Xanthomonas oryzaepv.oryzae)和燕麦嗜酸菌燕麦亚种(Acidovorax avenaesubsp.avenae)。Kang 等[39]根据16S 和23S rDNA 序列及转座酶A 基因序列构建了这3 种细菌的检测体系,检测限分别为10-2~10-4的稀释液。
2.3 植物病毒检测
病毒作为植物病害的第三大病原,种类繁多、变异快,且大多具有潜伏侵染的特点,常导致毁灭性的病害,对植物的生长发育造成了严重威胁[40],因而应用分子技术检测植物病毒十分必要[41-42]。由于植物病毒大多数为RNA 病毒,多用RT-PCR技术进行检测,并且仍可利用多重PCR 技术提高检测效率。
在粮食作物病害研究领域,大豆是全球重要的油料作物,而病毒病严重影响大豆的产量和品质。大豆花叶病毒(Soybean mosaic virus,SMV)、豆类普通花叶病毒(Bean common mosaic virus,BCMV)和黄瓜花叶病毒(Cucumber mosaic virus,CMV)是大豆生长过程中为害最严重的3种病毒,Xue 等[43]基于病毒的外壳蛋白基因构建了上述3 种病毒的三重PCR 检测体系,检测限为7×10-1ng‧µL-1RNA。花生矮化病毒(Peanut stunt virus,PSV)和番茄环斑病毒(Tomato ringspot virus,ToRSV)是我国进境植物检疫性有害生物,可通过染病大豆进行传播,袁俊杰等[44]利用双启动寡核苷酸引物(dual-priming oligonucleotide,DPO)建立了能同时检测上述2 种病毒的双重RT-PCR 检测体系,该体系具有对45~65 ℃退火温度不敏感的优点。 Maina 等[45]基于高通量测序(highthroughput sequencing,HTS)技术开发了靶向基因组测序(targeted genome sequencing,TG-Seq),并将其应用于谷类作物上常见的CMV、豌豆早褐病毒(Pea early browning virus,PEBV)、菜豆黄花叶病毒(Bean yellow mosaic virus,BYMV)和豌豆种传花叶病毒(Pea seedborne mosaic virus,PSbMV)4 种病毒的检测,TG-Seq 能检测出凝胶电泳检测不到的BYMV 和CMV 的扩增子,表明TG-Seq 具有更高灵敏度。针对玉米病毒病,李明骏等[46]建立了5 种玉米病毒的多重PCR 检测体系,可同时检测出甘蔗花叶病毒(Sugar-cane mosaic virus,SCMV)、玉米褪绿斑驳病毒(Maize chlorotic mottle virus,MCMV)、水稻黑条矮缩病毒(Rice black streaked dwarf virus,RBSDV)、玉米黄化花叶病毒(Maize yellow mosaic virus,MaYMV)和留尼旺玉米线条病毒(Maize streak reunion virus,MSRV)。Li等[47]建立了基于延伸因子1α(TEF1-α)基因检测玉米上常发生的MCMV、SCMV、MaYMV以及相关的整体病毒(Maize-associated totivirus,MATV)的多重RTPCR检测方法,灵敏度可达100 pg‧µL-1DNA。
在果树病害研究领域,黄爱军等[48]基于文献以及CP和p25基因成功建立了柑橘病害多重RTPCR 检测方法,可同时检测出柑橘衰退病毒(Citrus tristeza virus,CTV)、柑橘碎叶病毒(Citrus tatter leaf virus,CTLV)、柑橘黄化脉明病毒(Citrus yellow vein clearing virus,CYVCV)和柑橘叶斑病毒(Citrus leaf blotch virus,CLBV)4 种病毒。Peng等[49]基于CP基因设计引物以分别扩增猕猴桃褪绿环斑相关病毒(Actinidia chlorotic ringspotassociated virus,AcCRaV)、猕猴桃病毒1(Actinidia virus 1,AcV-1)、猕猴桃病毒A(Actinidia virus A,AcVA)和CLBV,并以肌动蛋白基因(ACT1)为内部对照成功构建多重RT-PCR,检测限为10-4cDNA。
此外,多重PCR 技术还广泛应用于观赏花卉和热带经济作物的病毒和类病毒研究领域,目前已报道的可侵染菊花的病毒和类病毒超过20 种,能够导致菊花减产10%~30%。Zhao 等[50]建立菊花病害的多重RT-PCR 用以同时检测番茄不孕病毒(Tomato aspermy virus,TAV)、菊花B 病毒(Chrysanthemum virus B,CVB)、CMV、烟草普通花叶病毒(Tobacco mosaic virus,TMV)、马铃薯Y 病毒(Potato virus Y,PVY)、菊花矮化类病毒(Chrysanthemum stunt viroid,CSVd)和菊花褪绿斑驳类病毒(Chrysanthemum chlorotic mottle viroid,CChMVd),为大规模调查病毒病害提供一种可行的方法。Muller 等[51]发现在大多数可可的基因组中整合了内源性可可杆状病毒(endogenous T.cacao bacilliform virus,eTcBV)的序列,对插入病毒序列的两侧设计引物组,阳性结果会扩增出2 条带,阴性结果只有1 条带,可以准确检测eTcBV 的存在,降低经济损失。
2.4 植物病原线虫
植物寄生线虫是常见的土传植物病原,包括孢囊线虫(Globoderaspp.)、根结线虫(Meloidogynespp.)、茎线虫(Ditylenchusspp.)等,它们的寄主范围十分广泛,可引起植物褪绿、发育不良,降低农作物产量和品质,部分种类可诱导寄主植物形成根结状肿瘤,在世界范围内普遍存在。此外,线虫通常能在土壤中长期存活,一旦发生很难根除,严重影响下季茬口的安全生产[52-53]。
马铃薯孢囊线虫包括马铃薯金线虫(Globodera rostochiensis)和马铃薯白线虫(G.pallida),是马铃薯生产的重要瓶颈,因其严重的破坏性被世界各国列入检疫对象。Nikitin 等[54]基于ITS1 区域建立的微阵列实时PCR 检测体系可同时检测G. rostochiensis和G. pallida,检测限分别达到1 和10 pg‧µL-1。针对阿尔及利亚的马铃薯孢囊线虫,Djebroune 等[55]应用前人研究的常规多重PCR 和荧光实时PCR 对其进行检测,以明确线虫的地理分布情况。Gamel 等[56]基于微卫星位点设计TaqMan 探针可以同时检测G. rostochiensis、G. Pallida和Heterodera schachtii。 种植对G. rostochiensis具有抗性的马铃薯品种导致近年来各地为害马铃薯的其他种类线虫检出量增加[57],因此,多重PCR的应用有助于植物线虫的综合检测。
根结线虫(Meloidogynespp.)是世界上最具破坏性的植物寄生线虫之一[58]。Hu等[59]提取根结线虫不同生活期的虫瘿DNA,基于28S rRNA 和rDNA-IGS2 区域建立了针对象耳豆根结线虫(M.enterolobii)、南方根结线虫(M. incognita)和爪哇根结线虫(M. Javanica)的多重PCR 检测体系,检出率随线虫发育而增加。Devran 等[60]利用特异性引物建立的多重PCR 方法可成功检测M. incognita、M. javanica和花生根结线虫(M. arenaria)。
茎线虫属(Ditylenchus)的鳞球茎线虫(D.dipsaci)、腐烂茎线虫(D. destructor)和D. gigas是3种寄主广泛的线虫。Jeszke等[61]通过对18S rRNA和rDNA-ITS1区域进行比对设计引物,分别成功建立了三重PCR 和qPCR 快速检测方法,qPCR 的灵敏度可达0.016 ng‧rxn-1。
伞滑刃属(Bursaphelenchus)是一类具有破坏性的嗜木线虫。Filipiak 等[62]利用2 种通用引物和3 种特异TaqMan 探针建立了多重实时荧光定量PCR方法,可对松材线虫(B. xylophilus)、拟松材线虫(B. mucronatus)、伪伞滑刃线虫(B. fraudulentus)进行有效检测,检测限为30 fg DNA‧µL-1。
拟毛刺线虫(Paratrichodorusspp. )俗称粗短根线虫(stubby root nematodes),可为害寄主植物的根系而引起病变,一些种类还可充当植物病毒的传播介体。Huang等[63]通过对18S rDNA 和ITS1区序列进行比对,设计引物可同时检测Paratrichodorus allius、较小拟毛刺线虫(P.minor)、胼胝拟毛刺线虫(P. porosus)和Trichodorus obtusus共4种线虫。
此外,多重PCR 技术在植原体等病原物的检测方面也有应用。植原体可导致寄主植物代谢紊乱,表现黄化、簇生、矮化、小叶等症状,引发枣疯病、杏褪绿等重要病害。此外,植原体可通过取食植物韧皮部的昆虫宿主在上千种植物宿主间传播,造成巨大的损害。由于植原体不能在培养基上培养,因此采用分子检测方法诊断该病害尤为重要[64]。Gholami 等[65]基于16-23S rRNA 基因间隔区建立了侵染马铃薯的3 组重要植原体16SrⅠ、16SrⅥ和16SrⅫ的多重巢式PCR。Galvao 等[66]应用多重PCR 技术快速检测植原体Phytoplasma和Spiroplasma,以助于掌握玉米丛矮病的流行病学。
3 多重PCR技术存在的问题及发展前景
植物病害的发生是病原、寄主、环境相互作用的结果,发病过程中往往还会受到多种生物或非生物因素的影响,因此依赖于症状识别、分离培养等的传统诊断方法费时费力,且准确率低,远不能满足现代农业需求。多重PCR可在同一反应体系中对不同靶标进行扩增,大大提高了样品检测通量,可应用于未表现出明显症状或侵染初期的植物病原诊断。该技术的使用可摆脱传统分离培养诊断方法的束缚,开辟了植物病原物诊断的新途径。
多重PCR 检测技术目前在敏感性、稳定性、靶标通量等方面仍存在不少问题(表1)。首先,多个引物对、模板等在同一反应中易出现非特异性扩增,引起检测结果假阳性或假阴性的问题;其次,mPCR 的产物检测主要依赖凝胶电泳检测手段,虽然快速便捷且成本较低,但存在明显局限性,如其扩增片段长度差异受琼脂糖凝胶电泳分辨率的限制,可能影响检测灵敏度;此外,使用凝胶电泳来观察扩增产物的存在或区分特定扩增产物的大小容易产生假定的光学误差,增加人工成本等[67];最后,多重PCR技术不能确定所检测到的病原体是否具有活性和侵染性,无法推断出有关的微生物细胞完整性信息,影响流行病学判断及风险评估,从而限制了应用场景[28]。因此,多重PCR检测技术在未来有待继续逐步完善。

表1 多重PCR的优缺点及可结合的技术Table 1 Advantages, disadvantages and the combinable technologies of multiplex PCR
多重PCR 技术与一些分子技术的结合在一定程度上弥补了上述不足。如多重PCR 与qPCR或dPCR 技术结合可实现定量检测。qPCR 往往利用植物DNA 作为内参评估病原的相对量,而dPCR 能直接表征检测物的绝对量[17,68];微流控芯片和液滴式数字PCR 技术与多重PCR 的结合可使靶标处于不同空间进而提高检测准确率;毛细管电泳、limunex xMAP 等检测手段能实现更有效的检测,也为多重PCR 技术结果的分析提供了更优越的手段,具有高灵敏、高通量、高分辨的优势;膜层析、液相芯片等技术可很好地解决电泳条带检测通量小的问题[9]。
现代技术的发展也在不断促进和提升多重PCR技术的应用范围和水平。新一代高通量测序技术、生物信息学、微生物基因库快速扩张以及比较基因组学等方法的发展加速了新DNA 分子标记的出现,提高了检测体系的灵敏度[69]。Li 等[70]利用大量李斯特菌(Listeriaspp.)的基因组序列进行泛基因组分析,确定了L. monocytogenes、L.ivanovii的特异性基因靶点和Listeriaspp.共有的基因靶点,据此设计引物并建立多重PCR 检测体系,检测限为103~104CFU‧mL-1。此外,在特异性引物设计方面可选择DNA 杂交、BLAST 比对识别等方法,并且随着大量测序数据的获得可针对具有种属间差异的保守序列进行设计,扩大了引物的设计选择范围,提高了筛选效率。因此,针对不同应用场景及应用要求,有选择性地将多重PCR技术与qPCR、dPCR、荧光等技术相结合,能发挥更好的检测效果,适应更多的植物病原检测应用需求,及时防止植物病害集中暴发,为科学防控植物病害奠定基础。

