镍掺杂MIL-100(Fe)的析氧性能研究
吴 方,丁梦圆,侯永琪,高慧花,焦宇鸿
(1.蚌埠学院材料与化学工程学院,安徽 蚌埠 233030;2.安徽省硅基新材料工程实验室,安徽 蚌埠 233030)
氢气是无污染的二次能源,作为能源载体具有非常显著的优势。氢气具有燃烧无污染、能量密度高、来源丰富等众多优点,被认为是21世纪最有前景的绿色能源之一。氢气的制备方法有很多种,每种方法都有各自的优缺点。在这些方法中,电解水制氢气技术由于自身独特的优点而受到广泛关注。电解水反应包括阳极析氧反应(OER)和阴极析氢反应(HER)。相比而言,析氧反应是一个复杂的四电子转移过程,动力学迟缓且存在较大的过电位,因此OER严重影响了电解水制氢气的效率,寻找、开发高活性的析氧电催化剂成为迫切需要解决的问题[1-2]。目前可用于电解水析氧反应催化剂有贵金属[3-4]、过渡金属硒化物[5]、硫化物[6]、磷化物[7]、氮化物[8]、氢氧化物[9]等。贵金属及其氧化物在OER过程中具有很好的性能和稳定性,是一种比较理想的阳极析氧催化剂。但由于贵金属及其氧化物的量非常少,价格非常贵,难以被广泛应用。
金属有机骨架化合物(Metal Organic Frameworks,MOFs)是以金属离子为连接中心,有机配体为桥联体,通过配位键等作用力,自组装而成的具有周期性的多孔配位聚合物[10-11]。MOFs具备特有的优势,如比表面积大、结构可调等。MOFs凭借独特的优势在吸附、分离、磁性、光学、催化、储氢、分子识别等诸多领域崭露头角[10-12]。在电催化反应中,高比表面积的MOFs有利于与电解液充分接触,丰富的活性位点有助于增强催化活性[12-13]。然而MOFs呈粉末状,导电性能较差,且单金属节点的MOFs活性位点少,活性差。金属掺杂是提高MOFs析氧活性的重要方法之一。本研究以MIL-100(Fe)为研究对象,均苯三甲酸为配体,采用水热方法,利用简单的金属掺杂,制备出系列MIL-100(FeNi)。通过调节镍盐和铁盐的比例,优选出具有最佳OER活性的催化剂。
1 实验部分
1.1 仪器与试剂
超声波清洗器(KQ-100B型),电子分析天平(上海越平FA1004C型),上海辰华电化学工作站(CHI760E)。均苯三甲酸,N,N-二甲基甲酰胺(DMF),无水乙醇,七水合硫酸亚铁,六水合硝酸镍。所有试剂均来自阿拉丁试剂有限公司。所有试剂均直接使用,没有经过其他处理。泡沫镍购买自深圳科晶智达科技有限公司。
1.2 Fe-BTC的制备
将0.48 mmol的硫酸亚铁和0.48 mmol的均苯三甲酸溶于12 mL DMF中,充分搅拌,随后将溶液转移至25 mL高压反应釜。将高压反应釜密封,置于150 ℃,反应12 h。反应完成后,将产物离心分离,水洗、醇洗各三次。离心完成后,60 ℃干燥,标记备用。
1.3 Ni-BTC的制备
将0.48 mmol的硝酸镍和0.48 mmol的均苯三甲酸溶于12 mL DMF中,充分搅拌,随后将溶液转移至25 mL高压反应釜。将高压反应釜密封,置于150 ℃,水热反应12 h。反应完成后,将产物进行离心,水洗、醇洗各三次。离心完成后,60 ℃ 干燥,标记备用。
1.4 不同镍铁比例的MIL-100(FeNi)的制备
保持镍盐和铁盐的总量0.48 mmol不变,分别称取三组镍盐、铁盐即0.342 8 mmol的硫酸亚铁、0.137 2 mmol的硝酸镍,0.4 mmol的硫酸亚铁、0.08 mmol的硝酸镍,0.436 3 mmol的硫酸亚铁、0.043 7 mmol的硝酸镍,将镍盐和铁盐以及0.48 mmol的均苯三甲酸溶于12 mL DMF中,充分搅拌,随后将溶液转移至25 mL高压反应釜。将高压反应釜密封,置于150 ℃,水热反应12 h。反应完成后,将产物进行离心,水洗、醇洗各三次。离心完成后,60 ℃干燥,标记备用。所得产物分别标记为Fe2.5Ni-BTC、Fe5Ni-BTC和Fe10Ni-BTC。
1.5 电极的制备
剪取泡沫镍(NF,2 cm×1 cm),先后置于3 mol·L-1HCl、丙酮和乙醇中,分别超声15 min,随后置于真空烘箱中干燥备用。
准确称取5 mg的催化剂粉末放入5 mL烧杯中,然后用移液枪将700 μL超纯水、200 μL乙醇和100 μL nalfion溶液分别加入到烧杯中,超声30 min。超声结束后,利用移液枪每次滴加100 μL悬浮液在泡沫镍(NF,1 cm×1 cm)上,将负载有催化剂的泡沫镍自然干燥过夜,备用。
1.6 催化剂的表征
利用日本理学Smart Lab型X射线粉末衍射仪表征粉末催化剂的晶体结构。利用FEI Quanta 400 FEG扫描电子显微镜(SEM)观察催化剂的微观形貌,利用SEM配套的附件X射线能谱仪获取EDS元素分析图,并对催化剂的元素组成进行分析。利用赛默飞世尔傅里叶变换红外光谱仪(Nicolet iS5)测定样品含有的官能团。
1.7 电催化析氧性能测试
用辰华CHI760E电化学工作站在三电极体系中电化学测试。其中以制备的电极为工作电极,Hg/HgO电极(内参比溶液为1 mol·L-1KOH)为参比电极,石墨棒作为对电极。根据能斯特方程E(RHE)=E(Hg/HgO)+0.921 V,将测试的电极电位转换为标准氢电极电势(RHE)。在1 mol·L-1KOH电解液中,以1 mV·s-1的扫速对催化剂进行OER电催化性能进行研究。利用双电层电容(Cdl)评估催化剂的电化学活性面积(ECSA)。在非法拉第区间,用循环伏安法(CV)以40、60、80、100、120和140 mV·s-1的扫速测试计算催化剂的双电层电容。在1.48 V(vs.RHE)的电压下测试电化学交流阻抗谱(EIS),测试频率范围0.01 Hz~100 kHz,振幅5 mV。采用计时电位法在电流密度为20 mA·cm-2测试催化剂的稳定性。
2 结果与讨论
2.1 XRD衍射图谱
利用X射线粉末衍射仪对所制备的Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC和Ni-BTC粉末进行表征。如图1所示,水热制备的Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC的XRD衍射峰与模拟的MIL-100(Fe)的衍射峰很好地匹配,并没有出现其他多余的衍射峰,表明成功制备了MIL-100(FeNi)。对于单一的Ni-BTC样品,其衍射峰较宽,说明其晶型较差。

图1 Fe-BTC、Ni-BTC、Fe2.5Ni-BTC、Fe5Ni-BTC和Fe10Ni-BTC的XRD图
2.2 SEM图
为了研究Fe10Ni-BTC的微观尺寸和形貌,对其进行SEM测试。图2是Fe10Ni-BTC的SEM图像,可以看出制备的Fe10Ni-BTC为疏松的不规则颗粒状,颗粒相互堆积,颗粒尺寸在100~200 nm之间,有些颗粒聚集成微米级。这种MOFs催化剂显著提高了与电解液的接触面积,有助于促进析氧反应的进行。

图2 Fe10Ni-BTC的SEM图
2.3 EDS能谱
利用EDS能谱图分析Fe10Ni-BTC的元素组成。如图3所示,制备得到的Fe10Ni-BTC只有C、O、Ni、Fe四种元素。C、O、Fe、Ni四种元素的重量百分比和原子百分比如表1所示。上述实验以及EDS测试结果表明,实验成功制备出了以均苯三甲酸为配体的铁镍双金属MOFs。

表1 Fe10Ni-BTC样品中各元素重量百分比和原子百分比

图3 Fe10Ni-BTC的EDS能谱图
2.4 红外图谱
为了表征Fe10Ni-BTC的官能团信息,对其进行红外光谱测试。图4为Fe10Ni-BTC样品的红外光谱图。在波数为1 578 cm-1和1 630 cm-1处的峰对应的是羧基的不对称伸缩振动吸收峰,在波数为1 375 cm-1处的吸收峰可归属于羧基的对称伸缩振动,在波数为755 cm-1处的吸收峰可归因于苯环的C—H弯曲振动[14]。FTIR测试结果佐证实验成功制备出了MIL-100(FeNi)。

图4 Fe10Ni-BTC的红外光谱图
3 电催化析氧性能
图5为系列催化剂的LSV曲线。从图5可以看出,达到10 mA·cm-2电流密度时样品Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC、Ni-BTC和NF所需的过电势分别是266 mV、250 mV、274 mV、253 mV、401 mV和515 mV;达到100 mA·cm-2的电流密度时样品Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC、Ni-BTC和NF所需的过电势分别是315 mV、293 mV、336 mV、313 mV、553 mV和740 mV,即在相同的电流密度下NF所需要的过电势最高,其次是Ni-BTC,Fe10Ni-BTC所需要的过电势最低。相比于单一的Ni-BTC以及Fe-BTC,Fe10Ni-BTC的析氧活性最佳,说明制备的镍掺杂的Fe10Ni-BTC具有最佳的析氧性能。该析氧活性要优于已报道的某些过渡金属硫化物[15]、氧化物[16]以及金属有机骨架基析氧催化剂等[17-18]。

图5 Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC、Ni-BTC和NF的LSV曲线
利用Tafel评估NF、Fe-BTC、Ni-BTC、Fe2.5Ni-BTC、Fe5Ni-BTC和Fe10Ni-BTC催化剂样品的电催化动力学特性。如图6所示,NF、Fe-BTC和Ni-BTC、Fe2.5Ni-BTC、Fe5Ni-BTC、Fe10Ni-BTC的塔菲尔曲线斜率分别是186.8 mV·dec-1、51.5 mV·dec-1、120 mV·dec-1、42.5 mV·dec-1、39.1 mV·dec-1和31.8 mV·dec-1。塔菲尔斜率越小,说明其电催化产氧的速率越快。相比于单一的Ni-BTC以及Fe-BTC,样品Fe10Ni-BTC的电催化产氧的速率最快,说明通过调节镍盐铁盐的比例,镍掺杂的MIL-100(Fe),能够显著提高催化反应动力学。

图6 Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC、Ni-BTC和NF的Tafel曲线图
系列Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC、Ni-BTC电化学阻抗分析图如图7所示。纯泡沫镍的曲线半径最大,说明其电阻最大;相比于单一的Fe-BTC和Ni-BTC,Fe10Ni-BTC的曲线半径最小,说明它的液接电阻最小,表明Fe10Ni-BTC在电极和电解质界面上具有最快的电子转移速率,这与Fe10Ni-BTC具有出色的OER活性相对应。由此可以证明镍铁双金属MOFs可以显著提高电子的传输能力。

图7 Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC、Ni-BTC和NF的电化学阻抗分析图
电化学活性面积(ECSA)是评判催化剂OER性能的重要指标。可用双电层电容Cdl来表示电化学活性面积的大小。如图8(a)(b)(c)(d)(e)是采用循环伏安法得到Ni-BTC、Fe-BTC、Fe2.5Ni-BTC、Fe5Ni-BTC和Fe10Ni-BTC的CV曲线。图8(f)为五种催化剂处理后获得的双电层电容,可以看出相同情况下Fe5Ni-BTC、Fe10Ni-BTC的双电层电容是1.51 mF·cm-2、1.61 mF·cm-2。Fe2.5Ni-BTC的电化学活性面积是1.76 mF·cm-2;Fe-BTC的电化学活性面积是1.56 mF·cm-2;Ni-BTC的电化学活性面积是1.41 mF·cm-2。虽然Fe10Ni-BTC的双电层电容不是这五种催化剂中最大的,但是相比于Ni-BTC和Fe-BTC,其双电层电容得到提高。说明这种镍铁双金属节点的MOFs可以显著提高活性位点的数目。

(a)Ni-BTC

(b)Fe-BTC

(c)Fe2.5Ni-BTC
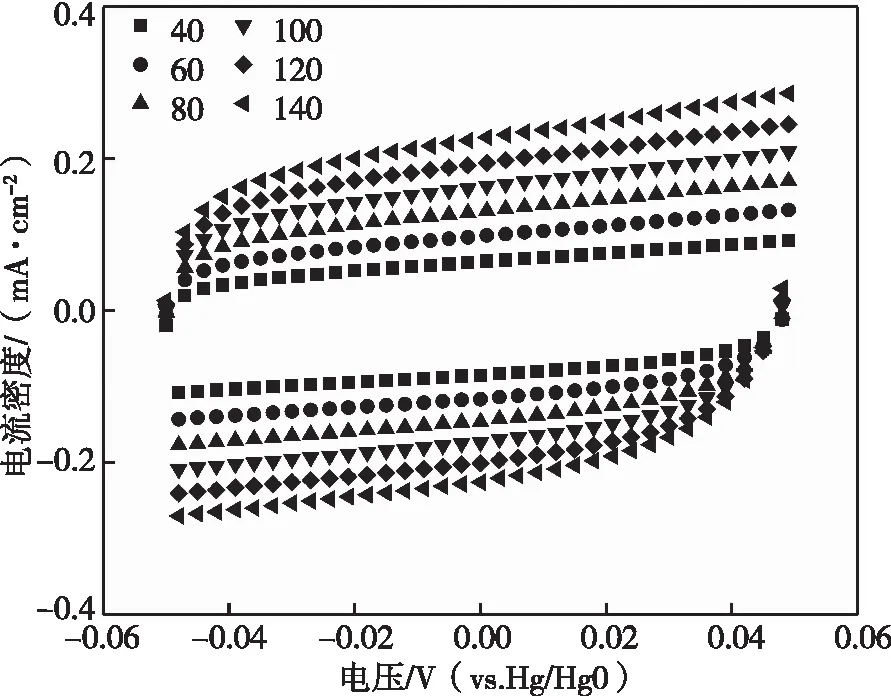
(d)Fe5Ni-BTC
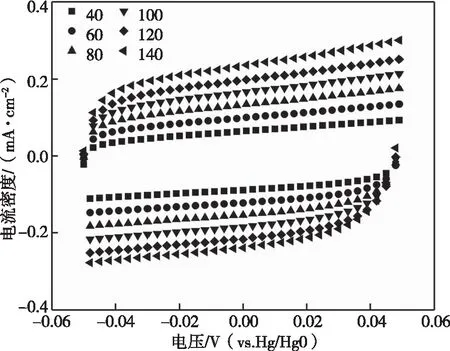
(e)Fe10Ni-BTC在不同扫速下的CV曲线

(f)系列催化剂的Cdl图8 CV曲线及双电层电容
稳定性测试对MOFs催化剂有着重要意义。1 mol·L-1KOH溶液作为电解液,电流密度设定为20 mA·cm-2,Fe10Ni-BTC经过12 h的测试后,其电位没有明显降低(图9),表明所制备的Fe10Ni-BTC具有良好的稳定性。

图9 Fe10Ni-BTC的计时电位曲线
4 结语
本研究选用水热方法,通过改变镍盐铁盐比例合成了一系列Fe5Ni-BTC、Fe10Ni-BTC、Fe2.5Ni-BTC、Fe-BTC和Ni-BTC催化剂。相比于单一金属节点的MIL-100,掺杂后制备的MIL-100(FeNi)的析氧活性得到显著提高。其中Fe10Ni-BTC具有最佳的OER活性。Fe10Ni-BTC达到10 mA·cm-2和100 mA·cm-2电流密度所需的过电势为250 mV和293 mV,Fe10Ni-BTC的塔菲尔曲线斜率是31.8 mV·dec-1,此外该催化剂具有较好的催化稳定性。该催化剂具有优异析氧活性的可能原因是:(1)利用nafion将催化剂负载到NF上,显著增强催化剂的导电性和稳定性;(2)镍铁双金属的协同效应有助于增大电化学活性面积,提供更多的活性位点,进而增强析氧活性。

