Ag-TiO2协同低温等离子体氧化降解NOx的研究
朱军山,周 进
(中国石化销售股份有限公司江苏石油分公司,江苏南京 210003)
0 前言
随着世界范围内工业和农业的发展以及汽车数量的增长,各种污染物的产生及排放不断增加,对大气环境和生命健康造成了极大的威胁。近年来,作为主要的污染物,氮氧化物(NOx)、挥发性有机化合物、臭氧(O3)等的治理一直是环保领域的研究热点[1-4]。其中,NOx包括多种化合物,如一氧化二氮(N2O)、一氧化氮(NO)、二氧化氮(NO2)、三氧化二氮(N2O3)、四氧化二氮(N2O4)和五氧化二氮(N2O5)等。除N2O及NO2以外,其他氮氧化物均不稳定,遇光、湿或热变成NO2及NO。因此作为空气污染物的NOx常指NO和NO2。本文主要针对NO和NO2这两种NOx进行分析。

1 实验部分
1.1 化学试剂
化学试剂包括:硝酸银(AgNO3,分析纯,成都科隆化学试剂有限公司);纳米二氧化钛(TiO2,分析纯,阿拉丁试剂(上海)有限公司);乙醇(C2H6O,99.7%,成都金山化学试剂有限公司);蒸馏水(H2O,实验室自制);γ-氧化铝(γ-Al2O3,2.5~3.0 mm,巩义嵩顶干燥剂有限公司);一氧化氮(NO,10%,成都氙氚气体有限公司);二氧化氮(NO2,10%,成都氙氚气体有限公司)。
1.2 样品制备
按一定比例称取纳米TiO2,均匀溶解于乙醇-水混合一定浓度的AgNO3溶液中。然后放置于多试管光催化反应仪中,在500 W汞灯照射下充分反应6 h。反应结束后,采用高速离心机将混合溶液进行离心分离,分别用适量的蒸馏水和无水乙醇将沉淀物洗涤3次,最后在真空干燥箱中干燥12 h,即可获得颜色为灰褐色的Ag-TiO2。称取一定量的TiO2、改性后的Ag-TiO2催化剂,并分别与γ-Al2O3圆形颗粒载体混合后放置于恒温振荡器内,使得催化剂均匀且牢固地负载在γ-Al2O3颗粒的表面上。最终制得均一稳定的TiO2/γ-Al2O3和Ag-TiO2/γ-Al2O3催化剂。
1.3 催化剂表征
a) 采用X射线粉末衍射(XRD)分析样品的物相组成、晶型及其结构。所用的测试仪器为帕纳科X射线衍射仪,其型号为:EMPYREAN。测试相关的参数为Cu靶,扫描速率为0.4°/s,扫描范围是15~90°,最大管压为60 kV,最大管流为60 mA。
b) 扫描电子显微镜(SEM)被用来观测样品的表观形貌、结构以及材料的颗粒大小。所用设备型号为Gemini 300,在测试之前,需要预先将催化剂附着在导电胶上进行测试。
c) 利用X射线光电子能谱技术(XPS)进一步分析催化剂样品表面的化学元素成分、化合物结构鉴定,元素价态分布及价带信息。所用测试仪器为Thermo Fisher能谱仪,型号为Thermo Scientific K-Alpha,测试相关参数为:X射线源为单色化Al Kα源(hν=1 486.6 eV),工作电压为15 kV,以C 1s(284.48 eV)为标准对获取的光谱数据进行校正。
d) 采用紫外可见漫反射光谱(UV-Vis DRS)测定催化剂样品的吸光性能,确定催化剂的光响应范围。测试所采用仪器为Shimadzu紫外-可见分光光度,其型号为UV-3600,测试相关参数:空白参比为BaSO4,测试波长范围为200~800 nm。
1.4 催化剂性能评价
在低温等离子体装置上对催化剂的脱硝性能进行考察,图1为装置示意图,催化剂内置于反应器内。利用testo 370高温红外烟气分析仪分别测量实验装置入口NO及NOx浓度,其中NO和NO2初始浓度均为500 μmol/mol,误差范围10 μmol/mol。cin,NO、cin,NOx、cout,NO及cout,NOx分别代表实验装置入口和出口的NO和NOx浓度。NO和NOx的降解率(E)计算如公式(1)、(2):

图1 低温等离子体降解NOx装置示意
ENO=(cin,NO-cout,NO)/cin,NO×100%
(1)
ENOx=(cin,NOx-cout,NOx)/cin,NOx×100%
(2)
式中:cNOx=cNO+cNO2
1.5 NOx脱除反应机理

2 结果及讨论
2.1 样品组织结构分析
TiO2和Ag-TiO2的X射线衍射图谱如图2所示。由图2可知,Ag-TiO2主要衍射峰与TiO2相一致,其中在25.31°、48.05°、53.88°和55.07°处XRD特征峰所对应的晶面分别为(101)、(200)、(105)和(211),由此可以证明Ag元素的加入并没有使TiO2晶体组织结构发生显著变化。此外,Ag-TiO2样品图谱中除了Ag和TiO2特征峰以外没有其他衍射峰的出现,表明在制备的样品中没有杂质相的干扰。

图2 TiO2和Ag-TiO2的X射线衍射(XRD)图谱
2.2 样品形貌分析
纯TiO2样品和掺杂后Ag-TiO2的SEM如图3所示。由图3(a)、(b)及(c)可知,纯TiO2的颗粒大小比较均匀,绝大多数颗粒直径在100~300 nm之间,并且有局部团聚现象。相比较于图3(d)、(e)及(f)而言,Ag掺杂后催化剂的粒径显著减小,均为100 nm以下,证明Ag的掺入使得TiO2晶粒的生长受到了抑制,而更小的颗粒直径有利于提高催化剂比表面积和表面能。此外,还可发现相较于纯TiO2的颗粒团聚现象,Ag-TiO2催化剂的堆积现象有了显著的改善,该现象同样说明Ag掺杂有利于提高催化剂性能。

图3 样品的扫描电镜(SEM)图像
图4为TiO2和Ag-TiO2的实物图,可见,催化剂从白色变成均匀的灰褐色,可以解释为贵金属Ag被成功地掺杂于TiO2样品中。借助能谱仪对Ag掺杂后的TiO2催化剂进行全面的成分分析(图5),从能谱图中可以找到Ti、O和Ag这3种元素,且从图5(c)中可见Ag分布均匀,因此证实了Ag元素存在于TiO2样品中,且掺杂均匀。

图4 TiO2和Ag-TiO2的实物

图5 TiO2和Ag-TiO2样品的元素分布
2.3 X射线光电子能谱分析
图6为纯TiO2和Ag-TiO2的XPS全谱图。TiO2和Ag-TiO2样品中主要是由Ti和O元素组成,图6(b)中所示有Ti、O和Ag元素的特征峰。比较图6(a)、(b)可知,Ag-TiO2谱图中在结合能为366.0 eV位置处出现了Ag 3d所对应的特征峰,证明了Ag与TiO2的成功结合。

图6 TiO2和Ag-TiO2的X射线光电子能谱(XPS)全谱图
2.4 紫外-可见漫反射光谱分析
通过紫外-可见漫反射光谱(UV-Vis)表征测试,分析TiO2和Ag-TiO2样品对光的吸收能力,结果如图7所示。从图7中可见TiO2和5%Ag-TiO2催化剂在紫外光区均有较强的吸收性能。与纯TiO2相比较,通过Ag改性后的5%Ag-TiO2样品在紫外光区和可见光区内的光吸收强度相对更高。5%Ag-TiO2样品在此UV-Vis光谱图中显现出一定程度的红移现象,这证明Ag元素的加入使得TiO2催化剂的光吸收范围比原来扩大了。TiO2属于间接半导体,因此以(αhν)1/2-hν曲线来计算Ag-TiO2的禁带宽度。如图7(b)所示,5%Ag-TiO2的禁带宽度是2.9 eV,明显低于纯TiO2的禁带宽度(3.2 eV)。该变化可能的原因是掺杂Ag会引起二氧化钛半导体的价带或导带位置的偏移。

图7 TiO2和Ag-TiO2的UV-Vis光谱图及间接带隙能
2.5 不同掺杂浓度的Ag-TiO2协同低温等离子体对NOx的降解效果
图8显示了电压为40 kV下,不同Ag掺杂浓度对NOx脱除效果的影响。从图8中可见,纯TiO2协同低温等离子体对NO和NOx的降解效果是最差的,分别仅为82.0%和61.8%。随着Ag掺杂浓度提高,反应体系中Ag-TiO2催化剂氧化NO和NOx的性能逐渐提高;当样品中掺入5%的Ag时,NO和NOx催化氧化效率达到最高,分别为98.4%和86.9%,分别是纯TiO2氧化效率的1.2倍和1.4倍。这可能是由于Ag的掺入,使得改性催化剂的晶粒生长得到了有效抑制。与纯TiO2相比,5%Ag-TiO2的粒径尺寸更小,进而样品整体的比表面积得到显著的增大,协同等离子体催化的活性中心也随之增多,且有可能减少了电子-空穴的复合几率,因此催化氧化效率较高。当样品中Ag含量继续增加,尽管催化剂粒径继续减小,然而晶体粒子之间的团聚现象变得更为严重,比表面积与5% Ag-TiO2相比较而言有所降低,所以对NO和NOx的催化氧化效果并没有进一步提高。
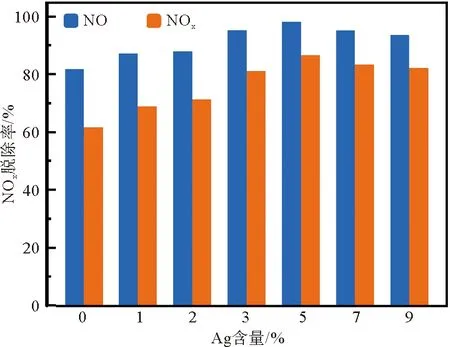
图8 不同Ag掺杂浓度对NOx脱除效果的影响


图9 等离子体协同不同催化剂降解NO和NOx的性能测试
2.6 低温等离子体协同5% Ag-TiO2/γ-Al2O3催化脱除NOx的稳定性考察


图10 低温等离子体协同5% Ag-TiO2/γ-Al2O3催化降解NOx的性能分析
3 结论
本文采用贵金属掺杂改性TiO2催化剂的方法成功制备了一系列不同掺杂比例(1%、2%、3%、5%、7%、9%)的Ag-TiO2样品。改性后催化剂的晶体粒径均小于100 nm,颗粒团聚现象得到改善,比表面积明显增大,催化反应所需的活性中心数量增多,Ag的掺入导致催化剂的禁带宽度变窄,同时也降低了协同催化过程中的电子-空穴复合率。5% Ag-TiO2/γ-Al2O3对NO和NOx氧化脱除率分别达到98.4%和86.9%,经过两次水洗再利用后对NO和NOx的催化降解效果分别为96.0%和86.3%,充分证明了Ag-TiO2具有较为理想的循环再利用价值。

