联合不同区域脑容积比降低与早期阿尔茨海默病的相关性
王贞,汪彦,2,张梦丽,2,祝寒宇,2,潘志铭,2,黄桂乾,闻彩云,熊丽,石林
1.温州医科大学附属第一医院 神经内科 浙江省阿尔茨海默病重点实验室,浙江 温州 325015;2.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035;3.温州医科大学附属第一医院放射科,浙江 温州 325015;4.香港中文大学 影像及介入放射学系,香港 999077
阿尔茨海默病(Alzheimer’s disease,AD)是老年期最常见的中枢神经系统的退行性疾病之一,是老年人致残和致死主要原因之一[1]。我国AD患者的年社会经济成本为1.914万美元/年,社会负担极大[2]。MRI是目前主要的神经成像方法,可用于辅助诊断AD[3]。有研究表明,全脑[4]、海马体[5-6]、额叶[7]、顶叶[7]、内侧颞叶[8]、内嗅皮层[6,9]、杏仁核[10]的体积缩小与AD的发生相关。在疾病的早期,已经出现海马区和内嗅区皮质体积减小。因此3D MRI图中分割关键脑组织技术对于早期诊断以及监测疾病进展具有重要意义[11]。国际上对海马体积的手动分割已做出标准化规定,但由于解剖标志物和测量方法的差异,手工测量结果误差较大。因此需要一种能自动分割并精确计算的软件来减少误差[12],减少分段测量海马平均容积的误差[13]。AccuBrain®是一种全新的自动体积分析软件,由香港中文大学影像及介入放射学系独立研发,该软件根据欧洲阿尔茨海默病联盟-阿尔茨海默病神经影像学倡议(EADC-ADNI)标准和3D MRI[14]自动进行海马区的精确分割。AccuBrain®可计算急性缺血性脑梗死病灶[15]和白质病变容积[16],在一定程度上可以帮助确定脑卒中后白质病变[17]和小血管疾病[18]对认知功能的影响。本研究拟利用该技术验证AD与不同脑区容积的相关性,以辅助诊断早期AD。
1 对象和方法
1.1 对象 纳入2018年1月至2020年12月温州医科大学附属第一医院神经内科记忆门诊早期AD患者(早期AD组)29例,同期纳入年龄、性别和教育程度匹配的体检中心的健康对照者(对照组)20例。AD的诊断标准参照NINCDS-ADRDA的标准定义。排除标准:①既往诊断为痴呆的其他原因,如血管性痴呆(vascular dementia,VD)、中枢神经系统感染(如艾滋病毒/艾滋病、梅毒等)、亨廷顿病和帕金森病引起的痴呆、路易体痴呆(dementia with Lewy bodies,DLB)或创伤性脑痴呆;②长期饮酒或滥用精神活性物质或曾有一氧化碳中毒史;③证实为颅内占位性病变;④神经系统疾病(包括帕金森病、卒中、格林-巴利综合征、多发性硬化);⑤精神疾病包括精神分裂症、精神错乱、双相情感障碍或严重抑郁症。分别对入选受检者进行简易智力状态检查(mini-mental state examination,MMSE)、临床痴呆量表(clinical dementia rating,CDR)和通过改良巴氏指数评定的日常生活能力(activity of daily living-modified Barthel index,ADL-MBI)等量表评定。对照组来自健康体检者。本研究经温州医科大学附属第一医院医学伦理委员会批准(审批号:KY2021-153),所有患者均签署知情同意书。
1.2 方法
1.2.1 一般资料采集:采集所有受检者年龄、性别、教育程度、职业、既往史、个人史、用药史等一般资料。
1.2.2 神经心理学评估:使用MMSE、ADL-MBI、CDR对所有受检者进行评估。
1.2.3 磁共振影像数据参数:采用MRI扫描颅脑,所有MRI图像均由配备3D系统(Achieva TX 3.0T,荷兰飞利浦公司)的MRI机器进行,包括八通道磁头线圈。常规轴位T1、T2加权像和轴位T2液体衰减反转恢复(fluid-attenuated inversion-recovery,FLAIR)图像,从而排除不合格的单侧或双侧海马区信号增强的患者。翻转角度=90°,切片数=60,切片厚度=2 mm,切片间隙=0 mm,NSA=1,FOV=230 mm×183 mm,ACQ矩阵尺寸=256×160。
1.2.4 图像分割分析:所有图像均使用AccuBrain®[15-19]软件(深圳BrainNow医疗技术有限公司)进行处理,这是一种基于云端的自动化脑容积测量工具,以全自动模式进行脑结构和脑组织的分割量化,不同版本AccuBrain®在海马分割准确性和AD诊断准确性均相似[20],见图1。
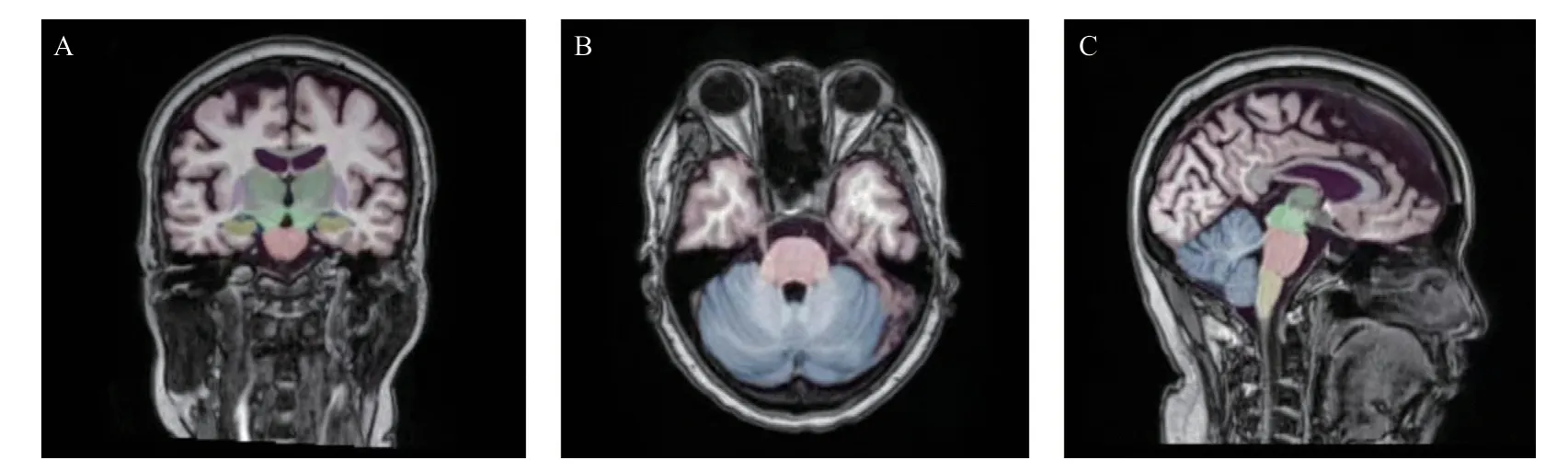
图1 应用AccuBrain®处理后的大脑MRI图像分割分析图
1.3 统计学处理方法 采用SPSS25.0软件对数据进行统计分析。正态分布计量资料用±s表示,2组间比较用独立样本t检验;非正态分布的计量资料采用M(P25,P75)表示,2组间比较采用Mann WhitneyU检验。计数资料以例(%)表示,2组间比较采用χ2检验。通过相关性分析和共线性分析筛查出有诊断意义且不存在共线性的变量,条件指标大于15的变量可怀疑在该维度存在共线问题;同时结合方差比例数值,其中大于0.9则怀疑该变量存在共线性。进行多次排列组合来筛选不同脑区,最后联合多个脑区计算AUC值,筛选最佳模型。P<0.05为差异有统计学意义。
2 结果
2.1 2组受检者临床资料比较 本研究共纳入49例受检者,其中早期AD组29例,男12例、女17例。对照组20例,男10例、女10例。2组性别、年龄、文化程度等差异均无统计学意义(P>0.05)。2组间MMSE评分差异有统计学意义(P<0.001),特别是定向力、注意力和计算力、语言回忆、阅读能力、三步命令等认知域,早期AD组得分显著低于对照组,差异有统计学意义(P<0.05)。2组受检者中CDR评分及ADL-MBI评分差异有统计学意义(P<0.001)。见表1。
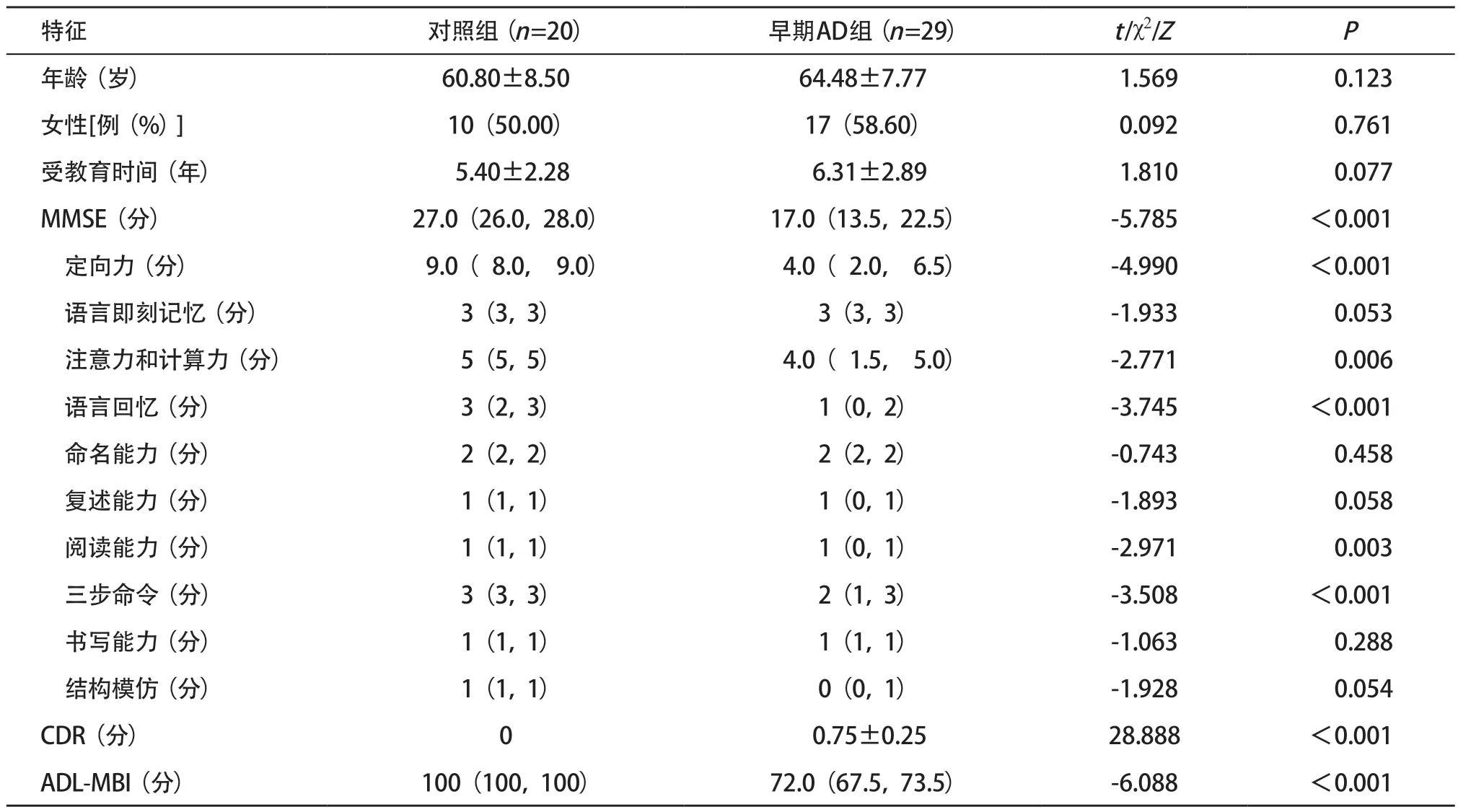
表1 2组受检者临床特征比较
2.2 2组受检者不同区域脑容积比较 2组受检者脑实质中,双侧海马区、左侧丘脑、杏仁核、核壳、颞叶、扣带回、左侧岛叶比较差异有统计学意义(P<0.05);2组受检者中部分相对萎缩的脑容积也存在差异,如右侧额叶、枕叶、右侧颞叶、右侧顶叶、双侧扣带回、左侧岛叶、灰质萎缩的脑容积差异有统计学意义(P<0.05)。在脑室系统,早期AD组的脑室容量明显大于对照组,差异有统计学意义(均P<0.05)。与对照组比,早期AD组的侧脑室、第三脑室和侧脑室下角均增大,差异有统计学意义(P<0.05)。见表2。

表2 2组不同区域脑容积比较
2.3 2组间差异脑区脑容积与认知功能障碍的相关性分析 因变量患病状态(对照组=1,早期AD组=0),自变量中性别(男性=1,女性=0),受教育程度(文盲=1,小学=2,初中=3,高中=4,大学=5),其余连续变量资料均未予赋值。将2组间有差异的脑区逐个进行单因素二元Logistic回归分析,海马体和杏仁核、侧脑室下角、壳核、以及颞叶、扣带叶、左侧脑岛、右侧额叶萎缩、枕叶萎缩、右侧颞叶萎缩、右顶叶萎缩、岛叶萎缩、右侧扣带回萎缩的脑容积的改变会影响AD的患病风险,见表3。采用多重共线性检验筛除混杂变量,右侧海马、右侧枕叶萎缩、右侧扣带回、左侧侧脑室下角、左侧岛叶萎缩的脑容积在共线性分析中VIF值均小于2。将上述不存在共线性的变量作为自变量建立Logistic回归模型,将存在共线性的2个自变量分别纳入Logistic回归模型中,通过比较P值的大小来选取合适的脑区,不断重复进行,直至筛选出均不存在共线性的脑区。通过调整混杂因素,分别得到模型1~3。通过调整年龄、性别、受教育程度后发现右侧海马体、右侧枕叶萎缩、右侧扣带回、左侧侧脑室下角、左侧岛叶萎缩脑容积,这5项指标形成的联合诊断体系可以用于早期AD的诊断,AUC=0.919(95%CI=0.758~0.963,P<0.01),其中将右侧海马体、右侧枕叶萎缩联合诊断所得AUC=0.878(95%CI=0.790~0.885,P<0.01),见表4和图2。
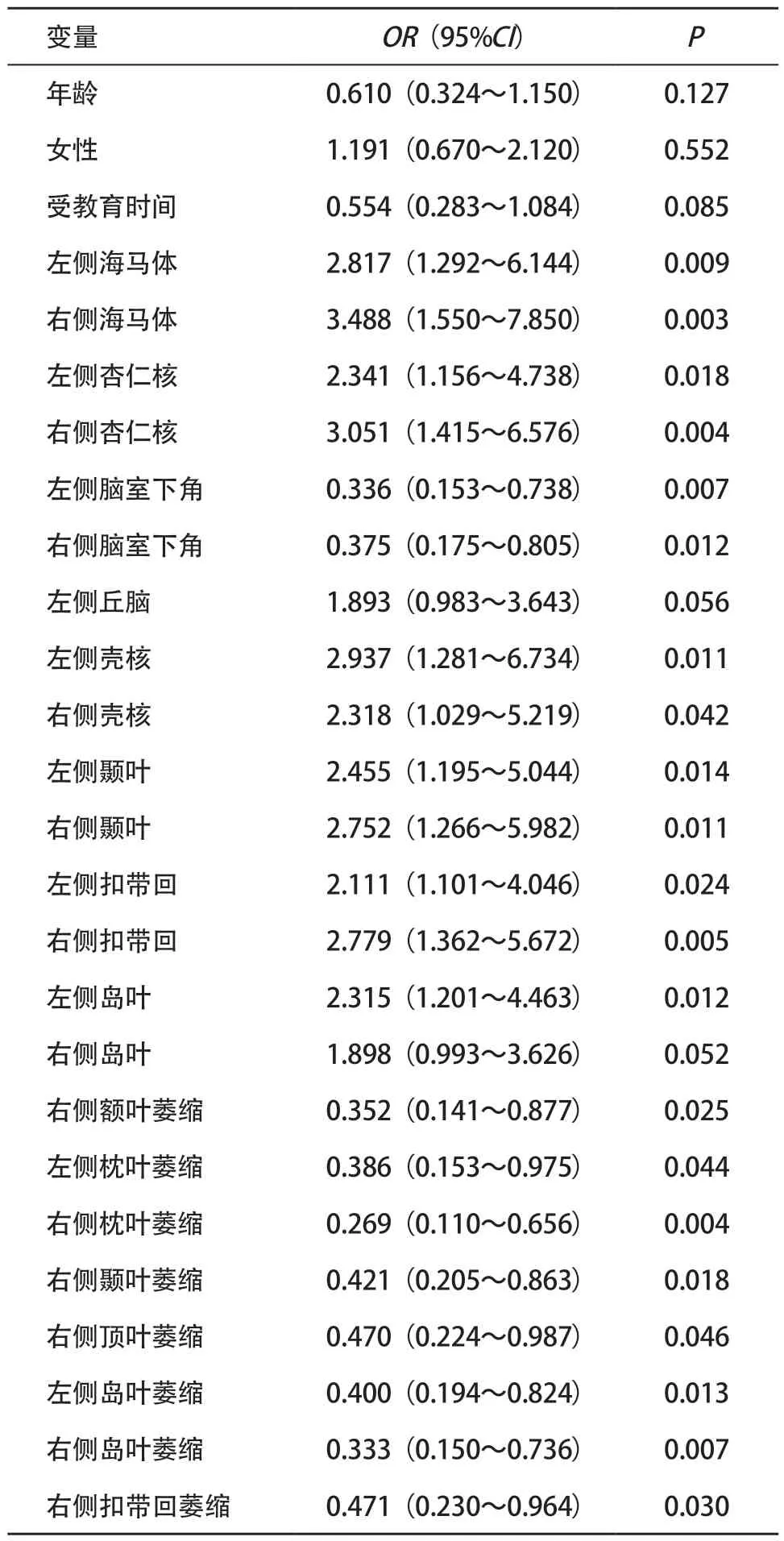
表3 单因素二元Logistic回归分析两组不同区域脑容积比

图2 二元Logistic回归分析所得联合诊断预测值的ROC曲线图
2.4 调整干扰因素后不同感性兴趣区模型的ROC曲线分析 调整年龄、性别、文化程度等干扰因素后,挑选有意义的指标分别对不同感兴趣区进行Logistic回归分析,并计算诊断模型1~5 的预测概率。对5个感兴趣区所得的5个预测值绘制ROC曲线,通过Logistic回归分析,计算联合预测因子,将所得的5个联合预测因子进行绘制ROC曲线,发现与预测概率绘制的ROC曲线所得的结果是一致的。右侧海马、右侧脑室后角形成的诊断体系可用于早期AD疾病的诊断的AUC=0.867。右侧海马、左侧脑室后角诊断AUC=0.860。右侧海马、左侧壳核的AUC=0.843。右侧海马、左侧岛叶的AUC=0.876。右前额叶萎缩脑容积、右侧顶叶萎缩脑容积的AUC=0.893,见表5和图3。

表5 二元Logistic回归分析所得联合诊断预测值
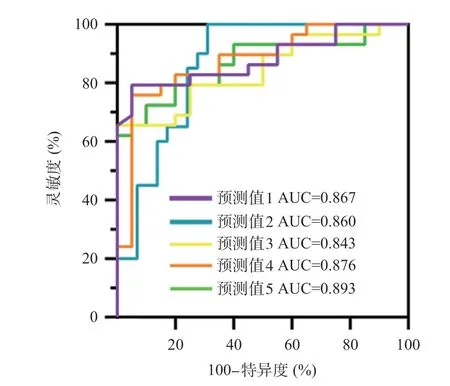
图3 感兴趣区1~5诊断早期AD的ROC曲线图
3 讨论
本研究主要探索不同脑区容积比与早期AD的关系,量化不同区域脑区容积值,用于辅助早期AD诊断。本研究发现多个脑区的容积比与早期AD之间存在很大的相关性,特别是海马区、杏仁核、壳核、脑岛等脑区。ROC曲线表明不同脑区的联合诊断表现出较好的诊断性能,尤其右侧海马在联合诊断中起到重要作用。
本研究采用AccuBrain®,获得的单个脑区相对容积比计算的ROC没有诊断价值,但进行多个脑区的联合诊断可获得较好的诊断价值,多指标联合诊断效果最好,可为早期AD患者的临床确诊提供辅助作用。特别值得注意的是,单因素二元Logistic回归分析发现双侧海马体、双侧杏仁核和左侧脑岛等脑结构均与早期AD相关,而在调整干扰因素后再次进行多因素二元Logistic回归分析,只有右侧海马体和右侧枕叶脑容积的萎缩最为显著。联合诊断也发现均与右侧海马体有关。本研究结果提示联合诊断可用于AD的临床预测和早期诊断。
本研究发现大脑结构的容积比,如右侧海马体、左侧脑岛、双侧侧脑室下角和双侧杏仁核,均与早期AD相关。在进行多个脑区容积随机组合行联合诊断中发现五个感性兴趣的预测值最有意义,均和右侧海马容积相关。因此,猜测右侧海马在早期AD进展中最先受累。目前尚未有文献报道左右侧海马与早期AD不同认知功能受损的相关性,是否与右侧海马受累的可能性更大及其受累原因的研究。同时,发现左侧额顶萎缩的联合诊断也是早期AD的良好预测指标。所以AD疾病进展过程中所累及的脑区可能是各不相同的,而且相同脑区在左右大脑的受累程度也可能是不同的。
通过AccuBrain®技术的应用,发现双侧海马、双侧岛叶、左侧丘脑、双侧杏仁核等脑结构的容积比与AD显著相关,右侧海马、左侧壳核、左侧脑室后角、左侧脑岛等脑结构的萎缩可能是诊断AD的潜在指标。其中,右侧海马在联合诊断中具有重要作用。
海马体在学习、记忆和认知中的作用已得到广泛的肯定[19],是AD早期受累的区域之一。结构MRI可反映海马容积的变化,可辅助AD的诊断[21]。JOSEPHS等[22]研究表明几乎80%的AD患者都有典型的海马区萎缩。也有研究表明,AD与海马神经元的丧失密切相关[23]。本研究也验证了AD与海马MRI容积比之间的相关性,在联合诊断分析时,右侧海马容积具有优势诊断作用。岛叶是大脑皮层的一部分,影像研究表明,AD组较正常对照存在明显的岛叶萎缩[24]。免疫组化研究发现,双侧岛叶都有早期AD的病理改变,93%的患者有淀粉样沉积改变,82%的患者有神经原纤维缠绕改变[23]。与对照组相比,AD组杏仁核脑容积显著减小[25],AD患者脑萎缩也导致其脑室容量明显大于健康人。本研究发现在AD和对照组中不同脑室容积比存在差异。AD患者通常双侧丘脑容积较小,有研究表明下丘脑容积减少是AD最原始的症状[26]。此次研究发现左侧丘脑与AD相关,但在二元Logistic回归分析中没有意义,这可能因样本偏少导致的。颞叶是大脑中与语言和记忆功能有关的另一个重要部分,本研究发现AD患者双侧颞叶容积比明显小于对照组。据报道,AD组的颞叶脑容积显著减小,在血流方面也有类似的结果[26-27]。另有综述表明,颞叶萎缩是AD的经典影像表现之一[28]。本研究发现与对照组相比,AD组侧脑室下角的容积比在本研究中也具有统计学意义。目前已有研究发现携带不同APOE基因型的AD患者临床特征和侧脑室下角大小有关[29]。本研究再次验证了侧脑室下角容积比与早期AD患病风险的关系。
目前临床医师对关键脑组织的萎缩程度主要依靠主观判断,这高度依赖评估者的专业知识,无法对不同年龄的脑萎缩正常范围给出量化评定。因此,利用脑影像定量工具辅助脑萎缩的评估已成趋势。然而国外的检测工具(如NeuroQuant等)对于人脑萎缩程度的推导均是基于西方人(高加索人)大脑结构的正常范围,而西方人与东方人脑结构容积存在差异。本研究所应用的AccuBrain®脑影像定量系针对基于中国人脑数据库而设计,对中国人群的脑结构特征有较好的适应性。AccuBrain®已被证实在同类大脑分割软件中具有最佳的准确度,与手工分割的参照数据相比,AccuBrain®的海马体分割在左海马体积、右海马体积、总海马体积上均有非常吻合的结果(如Dice相似系数分别为0.89、0.89、0.89,同类相关系数为0.94、0.96、0.95,Pearson相关系数为0.95、0.96、0.95)。相比于同类的海马体自动定量工具(如FreeSurfer),AccuBrain®也显示出了更高的准确度。一种基于机器学习的新型脑萎缩标志物,即AD相似萎缩指数(AD-similar atrophy index,AD-RAI),通过AccuBrain®技术自动处理以计算AD-RAI,使AD-RAI代表了一种潜在的生物标志物,能支持AD诊断[30]。其脑容积定量结果不仅与手工分割的参照数据非常吻合,且相比于同类的自动定量工具(如FreeSurfer)也显示出了更高的准确度,因而具有高效、准确的特点。
本研究使用了AccuBrain®自动分割软件,可以自动分析大脑各个区域的容积比,减少人工误差。通过比较所有大脑结构的容积,增加了数据的可靠性。但本研究也存在一定的局限性。最明显的局限性是样本量较小,这可能会导致统计偏差,从而使结论不可靠。由于参与研究的患者数量有限,患者的病情严重程度没有分类,这可能会使结果缺少严谨性;而且本研究未纳入轻度认知障碍和其他类型的痴呆症。因此,该结论的准确性还有待检验。本研究尚未对每个大脑结构(如海马体)进行更详细的体积分析,如分析海马体四个区域(CA1、CA2、CA3和CA4)的容积比与认知能力的关系。

