导电水凝胶及其在柔性电子器件中的应用
姜新园 王冉冉 孙静
1(国科大杭州高等研究院, 化学与材料科学学院, 杭州 310024)
2(中国科学院上海硅酸盐研究所, 高性能陶瓷和超微结构国家重点实验室, 上海 200050)
3(中国科学院大学材料科学与光电技术学院, 北京 100049)
柔性电子器件如电子皮肤、生物电极和可穿戴传感器等,因其具有轻质、共形性好以及可加工性强等特点,在人工智能、健康医疗和元宇宙等领域展现出广阔的应用前景[1-4]。柔性电子材料的研制与性能提升是促进柔性电子器件发展的关键。已报道的柔性电子材料包括金属纳米颗粒/纳米线[5]、有机材料[6]、低维半导体材料[7]和碳材料[8]等。近十余年来,这些柔性电子材料研究取得了很大的发展,但高成本、较差的生物相容性和机械性能限制了其广泛应用。近年来,水凝胶作为一种柔性导电材料受到广泛关注。水凝胶是一类由富含亲水基团的高分子链在水中交联得到的具有三维网络结构的聚合物凝胶材料,具有高亲水性、优异的机械柔性与延展性、可调的电学性能、生物相容性、自愈性、原料丰富和成本低廉等独特优势,已成为极具潜力的柔性电子材料[9]。
本文围绕电导率、机械性能、自愈合性、粘附性、抗冻和保湿性等关键性能介绍了导电水凝胶材料的前沿进展,介绍了导电水凝胶材料在柔性电子器件中的应用,包括柔性传感器、柔性储能器件和柔性生理电极等,最后,对导电水凝胶基柔性电子器件所面临的挑战和发展前景进行了总结和展望。
1 导电水凝胶的性能
导电水凝胶应用于柔性电子器件时,除了应具有优异的电导率、良好的机械性能和生物相容性外,抗冻性、保湿性、自愈性和抗菌性等相关性能也十分关键,对这些性能的优化有利于满足不同用途下的使用要求。
1.1 电导率
导电水凝胶主要是由离子在聚合物网络中迁移实现离子导电,或通过在水凝胶中添加本征导电聚合物、金属纳米颗粒/纳米线或碳基纳米材料等导电填料实现电子导电[10-11]。在水中产生带电离子的导电材料通常可以分为3 类,包括酸(如HCl、H2SO4、H3PO4)[12-14]、金属盐(如LiCl、FeCl3、AlCl3)[15-17]和离子液体(如1-乙基-3-甲基咪唑硫酸乙酯)[18]。这些导电材料产生的自由带电离子在水凝胶中定向移动,为水凝胶提供导电性[19-20]。电子导电水凝胶广泛使用的导电材料包括金属(银、铜等)纳米粒子/纳米线[21]、碳基材料(碳纳米颗粒/碳纳米线、石墨烯等)[22]、导电聚合物(聚苯胺、聚3,4-乙烯二氧噻吩:聚苯乙烯磺酸盐(PEDOT∶PSS)等)[23]和MXenes 材料[24]等。
水凝胶的离子电导率与电解质的种类、浓度以及电解质和聚合物网络的相互作用有关。Wang 等[25]使用纤维素和膨润土(BT)制备了纤维素-BT 水凝胶。相邻BT 纳米片之间的间隙可用作离子快速传输通道(图1A)。采用2 mol/L LiCl 浸泡后的纤维素-BT 水凝胶具有8.99 S/m 的稳定电导率。Fu 等[26]通过自催化纳米增强策略设计了一种防冻、自粘聚两性离子水凝胶电解质(PZHE)。由甲基丙烯酰乙基磺基甜菜碱(SBMA)和丙烯酸(AA)单体自由基聚合形成的聚合物分子链上带负电的羧基和磺酸根基团以及带正电的季铵基团形成了离子迁移通道,用于传输Zn2+和Cl-,有助于高浓度ZnCl2的解离,因此具有优异的导电性,在25 ℃时具有74.3 S/m 的电导率。

图1 基于不同导电策略的水凝胶:(A)纤维素-膨润土(BT)离子水凝胶[25];(B)电子导电的聚丙烯酰胺-海藻酸钠(PAAm)水凝胶[10]; (C)基于双重导电网络的导电水凝胶的设计和制备[28]Fig.1 Hydrogels based on different conductive strategies: (A) Cellulose-bentonite (BT) ionic hydrogel[25];(B) Electrically conductive polyacrylamide (PAAm)-alginate hydrogel[10]; (C) Design and preparation of conductive hydrogel based on double conductive network[28]
除离子外,电子也可在水凝胶中作为电荷载体。目前,有两种策略常用于水凝胶中的电子传导:引入导电填料或共轭导电聚合物。Ohm 等[10]提出了一种利用导电填料构筑导电水凝胶的方法。通过在聚丙烯酰胺-海藻酸钠(PAAm-Alg)水凝胶中加入低浓度的银片,再经过部分脱水,构筑了银片渗流网络(图1B),所得导电水凝胶的导电率可达37400 S/m。Won 等[27]利用激光诱导导电聚合物PEDOT∶PSS 的相分离,通过控制富含PEDOT 结构域和富含PSS 结构域的排列与结晶制得了PEDOT∶PSS 水凝胶。在含水量为39%时,导电率可达56000 S/m。
导电水凝胶还可通过设计离子-电子双重导电网络,实现可调的电导率。Liu 等[28]将冷冻干燥的PEDOT∶PSS 分散到通过化学蚀刻法合成的MXene 悬浮液中,制备了一种用于3D 打印的Ti3C2MXene 功能化的水性PEDOT∶PSS 油墨,通过冻融法获得了稳定致密的高度取向多孔结构。PEDOT 链结合高掺杂水平MXene 形成连续网络促进电子传输,PSS 链结合高度取向多孔结构促进离子扩散,从而实现高导电性。同时,MXene 和PEDOT∶PSS 之间的相互作用可以诱导掺杂效应,促进PEDOT∶PSS 相变,进一步改善导电性能。所获得的水凝胶在含水量高达96.6%时表现出1525.8 S/m 的高导电率(图1C)。研究表明,在离子-导电水凝胶材料中,离子-电子耦合通过掺杂-反掺杂机制、形态变化等在电荷输运过程中起到了关键作用[29]。因此,通过阐明离子-电子耦合机制可以更好地设计离子-电子双重导电水凝胶。
1.2 机械性能
导电水凝胶因具有优异的机械柔性,能够适应连续拉伸、弯曲甚至扭曲等机械变形,已成为柔性电子器件中最具前途的基质材料之一,近年来相关研究已取得了重要进展。一些常见的机械性能改进方法包括物理或化学交联、纳米复合以及双交联网络设计等[30]。双网络方法是设计具有高机械强度水凝胶的最有效策略之一。Zhang 等[31]报道了一种极易拉伸、高粘附的双网络(DN)离子导电水凝胶(图2A)。DN 水凝胶由聚丙烯酰胺(PAAm)构成脆性第一分子网络,聚乙烯吡咯烷酮(PVP)构成坚韧第二分子网络。其中,脆性网络在拉伸过程中破坏并耗散能量,同时通过氢键作用与坚韧网络缠结,从而产生高拉伸性(18000%)和良好的抗拉强度((179±28.1)kPa)。

图2 (A)双网络(DN)离子水凝胶的制备和性能示意图[31];(B)超支化二氧化硅纳米颗粒交联的聚丙烯酰胺(HBSPs-PAAm)水凝胶的示意图及循环拉伸测试[34]Fig.2 (A) Schematic diagram of preparation and properties of double network (DN) ionic hydrogel[31];(B) Schematic diagram and cyclic tensile test of hyperbranched silica nanoparticles-polyacrylamide (HBSPs-PAAm) hydrogel[34]
尽管双网络水凝胶具有优异的机械强度,但其抗疲劳性较差。在初始机械载荷后,通过共价键的不可逆断裂而耗散能量,因此,双网络水凝胶断裂能在之后的载荷下会不断降低。物理交联的导电水凝胶以可逆的非共价键取代牺牲共价键,实现可恢复的能量耗散,主要包括氢键作用、疏水作用和静电作用等。Wang 等[32]通过在离子液体中无规共聚两种具有不同溶解度的单体,原位产生相分离的弹性域和刚性域,从而获得了超坚韧和可拉伸的聚(丙烯酰胺-co-丙烯酸)离子凝胶。其中,富含聚合物的刚性相通过在聚合物链之间形成氢键增韧离子凝胶,而富含溶剂的弹性相能够保持机械完整以实现大的应变。所获得离子凝胶表现出超高的断裂强度(12.6 MPa)、断裂能(~24 kJ/m2)、杨氏模量(46.5 MPa)和可拉伸性(~600%应变)。另外,大多数水凝胶具有较差的回弹性,为了改善此问题,Zhang 等[33]在聚羧酸网络中引入熵驱动的超分子两性离子可重组网络。在卸载过程中,超分子甜菜碱链网络快速重组,制得的聚丙烯酸/甜菜碱弹性体具有优异的弹性(恢复率97.9%±1.1%,<14%滞后)。Meng 等[34]使用超支化二氧化硅纳米颗粒(HBPs)作为交联点,制备了一种高溶胀、低交联密度的PAAm 水凝胶(图2B)。在700%应变时,仅有1.3%的滞后,并具有5000 次循环稳定性。
1.3 自愈合性和粘附性
赋予基体材料自愈合特性是解决柔性电子器件寿命问题的有效途径之一,同时,这对减少电子污染也具有重要意义。近年来,自愈合水凝胶的发展越来越成熟,建立了动态化学键和动态非共价键等多种修复机制。Zhao 等[35]通过原位多层自组装,以海藻酸钠(SA)和PAAm 构建出具有规整层结构的高强度自愈合水凝胶。氢键在增强水凝胶的自愈合作用方面发挥着关键作用,水凝胶自愈合效率达99%。
基于水凝胶自愈机制,研究者设计了具有两种或两种以上不同相互作用的动态网络,以增强水凝胶的自愈性能。Cai 等[36]设计了一种具有良好自愈能力的导电水凝胶,可在3.2 s 内恢复其初始导电性的98%,并且无需外部刺激(如热、pH 值、光或催化剂等)。该水凝胶是通过四官能团硼酸盐离子与聚乙烯醇(PVA)的羟基交联形成3D 网络。四官能团之间的氢键、硼酸盐离子和羟基的弱交联作用提供自愈合功能。Yao 等[37]将纤维素纳米纤维引入苯基硼酸离子液体(PBA-IL)/PAAm 交联网络中,得到了一种新型离子导电水凝胶(图3A),交联网络的动态共价硼酸酯键和物理相互作用(氢键和静电相互作用)赋予了水凝胶良好的自修复性能(自愈效率92%±2%)。

图3 (A)具有自愈合性的导电水凝胶的设计和制备[37];(B)可即时粘附的干式双面胶带(DST)示意图和干交联机制[40]Fig.3 (A)Design and preparation of self-healing conductive hydrogel[37];(B)Schematic diagram and dry crosslinking mechanism of dry-type double-sided tape (DST) for instant adhesion[40]
导电水凝胶在应用于可穿戴传感器时,通常需要借助胶带或粘合剂与衣服或皮肤贴合,这种不稳定的接触会影响柔性传感装置对微弱生理信号的检测。自粘附性导电水凝胶可与人体组织建立稳定可靠的接触界面,提高传感器装置对微弱生理信号的检测精度。水凝胶和接触界面的粘附性主要源于水凝胶与界面之间的共价或非共价相互作用。凝胶粘附性能与其分子网络结构密切相关[38]。通过在导电水凝胶中引入儿茶酚、氨基、羟基或羧基等官能团,可与接触面形成亚胺、酰胺或其它共价键,因而产生粘附。Gan 等[39]基于仿贻贝粘附化学,制备了一系列具有导电性、氧化还原活性和亲水性的新型导电聚合物/磺化木质素复合纳米颗粒(CP/LS NPs),并利用这些纳米颗粒研制了具有自粘附性的水凝胶。由于纳米颗粒中的动态氧化还原平衡,使水凝胶中保持足够多的儿茶砜基团,因此纳米颗粒掺杂的水凝胶具有持久和可重复粘附性能。为了实现即时粘附,Yuk 等[40]报道了一种干式双面胶带(DST)组织粘合剂,此粘合剂由天然高分子类凝胶(明胶或壳聚糖)和接枝有N-氢琥珀酰亚胺酯的交联聚丙烯酸组成(图3B)。DST 从组织表面去除界面水,从而实现与表面的快速交联,随后与组织表面上的胺基发生共价交联,进一步改善了粘附稳定性和强度,5 s 内即可在各种湿动态组织和工程固体之间实现强力粘附(断裂韧性>1000 J/m2)。为了拓展导电水凝胶的应用范围,其水下粘附也值得关注。Fan 等[41]受藤壶胶蛋白中的氨基酸残基启发,制备了由阳离子单体和苯环单体构成的水凝胶,此水凝胶通过界面静电作用和疏水相互作用实现了水下牢固粘附(粘合强度达180 kPa), 并可保持数月以上。
1.4 抗冻和保湿性
由于导电水凝胶的含水量高,不可避免地会在低温下冻结,在低的相对湿度条件下失水,这会导致导电水凝胶性能下降,甚至失去原有的导电性。目前,抗冻水凝胶的设计策略主要包括:(1)将抗冻保护剂引入聚合物基质中抑制冰成核,即引入的材料组分通过氢键相互作用或者静电相互作用破坏水分子的有序排列,从而阻碍冰成核[42-43];(2)在水凝胶体系中构建亲水/疏水结构抑制冰晶生长,包括核壳结构和互穿网络结构等[44]。在低温环境中,疏水部分会倾向于吸附在微小冰晶上,亲水部分则稳定水凝胶体系,从而在纳米尺度上限制冰晶长大[45]。Sui 等[16]通过引入高度可水化的LiCl,开发了具有防冻和保水能力的聚(磺基甜菜碱-co-丙烯酸)水凝胶。该水凝胶可在超低温(-80 ℃)环境中存放30 d 而不冻结。在室温下保存7 d 后,可保留约100%的初始水分。另外,在真空干燥后,脱水的水凝胶可通过自发收集周围环境中的水分子自我再生至其初始状态,这是以前报道的导电水凝胶无法实现的。这些特性使水凝胶具有较宽的工作温度范围和更长的使用寿命,可用于开发更先进和可持续性的柔性电子产品。Zhang 等[44]合成了一种乙二醇类衍生物的功能交联剂(EGINA),并探索了一系列全新的聚合物防冻水凝胶。EGINA含有丰富的氢键受体/供体位点,这种结构特征使其可与聚合物网络和水分子产生强氢键相互作用,减少水凝胶内游离水分子的数量,从而抑制冰晶生长,使水凝胶在-20 ℃下能够保持较长时间的抗冻性。Yuk 等[46]在聚丙烯酰胺-海藻酸盐水凝胶表面修饰了超薄Ecoflex 涂层,修饰涂层可有效阻止水分从水凝胶中蒸发,从而实现了水凝胶的抗失水作用。在室温环境中,该复合水凝胶材料在48 h 内几乎不失水。
1.5 其它性能
除了高导电性、自愈合性、自粘附性和抗冻保湿性外,研究者也对具有新型功能的导电水凝胶进行了研究,如具有抗菌性能的导电水凝胶。Fan 等[47]通过席夫碱键和氢键,制备了一种具有pH 响应特性和抗菌特性的可注射导电壳聚糖(CPT)水凝胶。由于席夫碱键的引入,制备的可注射CPT 水凝胶即使在不添加抗菌剂的情况下,也具有优异的广谱抗菌性能,并且具有良好的生物相容性。Tu 等[48]通过多肽、聚多巴胺和氧化石墨烯之间的动态交联制得了导电水凝胶支架(GDFE)。GDFE 可有效激活巨噬细胞向M2 表型的极化,并通过旁分泌机制显著促进真皮成纤维细胞增殖、内皮细胞迁移和血管生成。另外,GDFE 还可通过快速抗炎和血管生成以及M2 巨噬细胞极化快速促进糖尿病伤口修复和皮肤再生。
2 在柔性电子器件中的应用
具有抗冻保湿性、粘附性和自愈性等性能的导电水凝胶,在柔性传感器、柔性储能器件和柔性生理电极等方面具有广阔的应用前景。
2.1 柔性传感器
柔性传感器是将外界各种信息转变成可识别信号进行测量和表征的一类柔性器件。根据所识别信号的种类,柔性传感器可分为压力传感器、应变传感器、温度传感器、气体传感器、湿度传感器和电生理传感器等。根据感知机理,柔性传感器可分为电阻式传感器、电容式传感器和压电式传感器等[49]。水凝胶因具有良好的导电性、可延展性、生物相容性和粘附性,已被广泛应用于柔性传感器领域。
Shen 等[50]通过冻融处理对PEDOT∶PSS 和PVA 进行物理交联,形成微相半分离网络水凝胶,设计了基于夹层结构的PEDOT∶PSS-PVA 水凝胶应变传感器。该应变传感器的电阻响应在300%的宽应变范围内可忽略滞后(1.5%),具有良好的灵敏度(GF=4.07)、高线性(R2=0.98)和超低检出限(~0.05%应变),同时对压力和扭转具有良好的抗干扰和信号解耦能力(图4A)。Tao 等[51]利用MEMS 微加工工艺开发了一种具有表面金字塔微结构的聚丙烯酰胺/卡拉胶双网络(DN)离子水凝胶,将其作为摩擦层和导电电极,设计和制备了包含单/双电极两种工作模式的压力传感器,该压力传感器具有高柔性、高透明度(~85%)、高灵敏度(45.97 mV/Pa)、高响应速度(~20 ms)、低检出限(50 Pa)、高耐久度和稳定性(36000 次循环)等多种优良特性(图4B)。Wu 等[52]将LiBr 引入聚丙烯酰胺/卡拉胶DN 水凝胶,并以PDMS 为封装层,制得了具有薄膜夹层结构(TFSS)的电容式柔性透明温度传感器,该传感器显示出高热灵敏度(24.54%/℃)、较短的响应时间(0.19 s)和恢复时间(0.08 s),以及宽检出限(-28.0~95.3 ℃)、高分辨率和高稳定性(图4C)。该研究组基于CaCl2置换的聚丙烯酰胺/卡拉胶水凝胶,设计并制备了一种可在厌氧环境和室温空气中进行NO2传感的可拉伸、自修复的透明气体传感器(图4D)[53]。该传感器对NO2显示出高灵敏度(119.9%/ppm)、快速响应(响应时间和回复时间分别为29.8 和41.0 s)以及良好的线性和低检出限(86 ppt)。Li 等[54]将PEDOT∶PSS 水凝胶自组装在纸纤维上形成导电水凝胶/纸复合材料,并将电生理电极与汗液葡萄糖生化传感器和纸基汗液微流体集成在一起,开发了一种水凝胶纸贴片,可用于运动时的电生理信号检测和生化传感(图4E)。
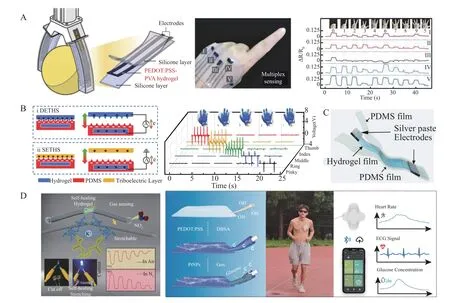
图4 (A)电阻式水凝胶应变传感器[50]; (B) 具有单/双电极两种工作模式的压力传感器[51]; (C) 电容式柔性温度传感器[52]; (D)可拉伸、自修复的NO2 气体传感器[53]; (E)用于电生理信号检测和生化传感的水凝胶贴片[54]Fig.4 (A)Resistive hydrogel strain sensor[50];(B)Pressure sensor with single/double electrode operation mode[51];(C) Capacitive flexible temperature sensor[52]; (D) Stretchable, self-healing NO2 gas sensor[53]; (E) Hydrogel patches for electrophysiological signal detection and biochemical sensing[54]
通过不同的网络结构设计和导电策略的选择,研究者已开发出具有极强变形能力和高电导率的凝胶柔性传感器。此外,部分柔性传感器还具有一些其它性能,如抗冻性、自粘附性和自修复性等,这更有利于其在人机交互界面、健康运动监测和生物医药等领域的应用。但是,相较于传统的电阻型柔性力敏传感器,凝胶基柔性传感器的灵敏度目前仍然较低。因此,在不损失凝胶基柔性传感器的柔韧性和感应范围前提下提升其灵敏度仍然是一个难题。另外,由于信号耦合等原因,目前的柔性传感器常为单一模式,不能实现多种信号的同时监测,因此实现有效的多模态传感也值得进一步研究。
2.2 柔性储能器件
现有的储能器件,包括超级电容器、锂离子电池和燃料电池等,由于其弹性模量大以及质量较大,难以满足柔性电子器件的使用要求。因此,开发兼具机械柔性和优异电化学性能的储能器件尤为重要。导电水凝胶因具有优异的机械柔性/延展性和可观的导电性,已成为构筑柔性储能器件的重要材料。
Huang 等[55]通过在聚乙烯醇-聚丙烯酰胺/丙烯酸(PVA-PAAm/AA)双网络水凝胶电解质上原位聚合聚苯胺(PANI)电极,制备了一种具有宽工作温度范围的柔性PANI-PVA-PAM/AA 水凝胶超级电容器(图5A)。基于化学交联PAM/AA 网络和物理交联PVA 网络,该超级电容器可在数千次循环载荷下表现出抗疲劳和抗断裂特性。通过PANI 电极的集成设计,全柔性超级电容器具有95.8 mF/cm2的高比电容,以及较宽的工作温度范围(-60~100 ℃)。除了优异的机械性能,自愈性对于提升柔性储能器件的可靠性和使用寿命也至关重要。Zhao 等[56]通过将水凝胶电极夹在形状记忆聚氨酯-聚己内酯(PU-PCL)基板上的2 个PEDOT∶PSS-rGO 电极之间,制备了具有可重复配置、可编辑性和优异自愈性的柔性超级电容器(图5B)。由于UPy 二聚体形成的四重氢键和水凝胶电解质的交联位点的疏水缔合,超级电容器表现出长期循环耐久性。超级电容器在5000 和10000 次充放电循环后的电容保持率分别为99.6%和95.8%。此外,双动态交联位点进一步赋予了水凝胶电解质快速自愈能力,在5 次切割/自愈循环后仍表现出95%的电容保持率。Ye 等[57]采用界面干交联策略制备了一类具有高电导率和高界面电荷转移效率的类组织柔性全凝胶电池,在全水凝胶锂离子电池和锌离子电池中分别实现了82 和370 mA h/g 的比容量。同时,全凝胶电池的杨氏模量为80 kPa, 可与生物组织(例如皮肤和心脏)的力学性能有效匹配。

图5 (A) 具有宽工作温度范围的柔性水凝胶超级电容器[55]; (B)可自修复柔性超级电容器[56]; (C) 具有组织粘附和免疫逃逸性能的导电水凝胶可植入脑电极[58]; (D) 离子凝胶电极用于水下心电监测[60]Fig.5 (A) Flexible hydrogel supercapacitor with ultrabroad working temperature range[55]; (B) Self-healing flexible supercapacitor[56]; (C) Conductive hydrogel with tissue adhesion and immune escape properties for implantable electroencephalogram(EEG)electrodes[58]; (D) Ion-gel electrodes for underwater electrocardiography (ECG) monitoring[60]
尽管取得了显著进展,但柔性储能器件中导电水凝胶的开发仍处于早期阶段,制造出适用于柔性储能器件的高性能导电水凝胶仍然存在一些挑战:(1)改善凝胶电解质与电极材料的界面接触,以使在器件变形过程中不同部件上的应变失配最小化,保持电化学性能稳定;(2)在不损失机械性能的情况下,优化凝胶电解质的离子迁移率,增强储能效率;(3)开发具有新型或集成功能的水凝胶电解质,增强器件的工作环境适应性,如自愈合性、抗冻性和形状记忆性等。
2.3 柔性生理电极
在生物电检测领域,需要兼具高导电性和生物相容性的柔性电极,确保采集信号的准确性和佩戴的舒适性。水凝胶具有良好的柔韧性、延展性和生物相容性,是柔性生物电电极的理想候选材料。
水凝胶的诸多理化特性,如杨氏模量、含水量等都与生物组织高度相似,但水凝胶的离子电导率(10-3~10 S/m)却比传统电极材料(如金属)低6~9 个数量级。为了解决导电率与生物相容性难以兼得的问题,Wang 等[58]设计了一种聚乙烯醇-人工脑脊液(PVA-ACSF)水凝胶,并开发了以PVA-ACSF 水凝胶为离子导体、PDMS 为绝缘层的具有多模态功能的脑膜下皮层电极(HENI,图5C)。该水凝胶电极的力学性能和化学性能与脑组织高度相容,兼具高透光性和核磁兼容特性,可记录到具有高时空分辨率的高质量皮层神经电信号。为了将植入装置与生理组织之间的不良反应最小化,Wang 等[59]开发了一种基于双键化多巴胺限域聚合的PEDOT 纳米颗粒,并将其引入卡拉胶(CA)-聚多巴胺(PDA)-聚丙烯酰胺(PAAm)互穿水凝胶网络中,形成了具有组织粘附性的导电水凝胶。以该多功能水凝胶为柔性导电界面,实现了刚性微电路和柔软脑组织的无缝联接。同时,该导电水凝胶还具有主动免疫逃逸能力,能够抑制神经炎症,提高了脑机界面(BMI)的生理稳定性,有助于实现BMI 长期的脑电信号记录。Yu 等[60]通过在离子液体中聚合离子液体单体,设计了一种能够用于水下复杂环境中的离子凝胶电极,实现了强大的水下粘附,并可收集稳定、可靠的心电信号(图5D)。
导电水凝胶在生理电极方面具有广阔的应用前景,然而,组织-电极界面处的物理和机械不匹配常会引起炎症或影响性能,因此实现组织-电极界面的有效贴合仍然是一个亟需解决的问题。另外,对于需要在体内组织/细胞界面操作的植入式生理电极,为了避免发生免疫反应,其生物安全相容性仍有待提升。此外,为了降低组织损害,水凝胶材料的生物降解性也需要关注。
3 总结与展望
导电水凝胶因具有优异的生物相容性、柔性和可调机械性能,被视为构建下一代柔性电子器件的理想材料。近年来,研究者已研制出导电性和机械性能均大幅提升的导电水凝胶。此外,通过选择不同的合成方法和材料,也可定制具有特殊性能的导电水凝胶,如自愈合性、自粘附性、抗冻保湿性和抗菌性等。基于此优势,导电水凝胶在柔性传感器、柔性储能器件和柔性生理电极等领域已经取得极大进展,为医疗健康监测和软体机器人等领域提供了新的发展机遇。然而,导电水凝胶基柔性电子器件的实际应用仍存在一些挑战。首先,导电水凝胶的长期环境稳定性和抗疲劳特性是保证柔性电子器件性能稳定和使用寿命的关键,目前这些性能仍亟待进一步优化。其次,为了满足不同工作环境的要求,如高低温环境、水下和极端干燥环境等,需提升水凝胶材料的环境耐受性,因此需开发出具有新功能的导电水凝胶,如抗冻保湿性和水下粘附性等。最后,导电水凝胶基柔性电子器件的生物安全性、生物可降解性和可回收性也值得关注,可利用生物质聚合物制备导电水凝胶,确保其对人体和环境友好。

