欧文氏菌DE2对三种豆科牧草幼苗生长的影响
何林鑫, 黄 荣, 田望军, 靳振海, 赵 亮, 陈海雁, 张振粉
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070)
梨火疫病(Fire blight)是蔷薇科植物的毁灭性病害之一,该病在北美一直是梨(Pyrusspp.)、苹果(MaluspumilaMill.)、樱桃(Prunusspp.)等果树的毁灭性细菌病害,也是最古老、研究最深入的植物病害之一[1]。由于受侵染的花、枝条和病叶会变成黑褐色并呈现出枯萎的症状,但是仍挂在树上不脱落形似火烧一样,故称此病害为“火疫病”[2-3]。2016年5月梨火疫病在新疆伊犁州首次报道发生[4]。目前,梨火疫病已在我国新疆、甘肃2个省(自治区)65个县、市(区)[5]发生并对果农造成严重损失,其病菌几乎能够侵染寄主植物的所有组织[6];寄主植物的花被病菌感染后呈现整个花序呈黑色,干枯萎蔫下垂;叶片被感染后会出现叶脉褪绿黄化,最终失水变为褐色[7];果实被感染后果面开始变黑、腐烂并出现乳白色的菌脓[8];枝干感病后呈现皮层收缩、下陷,形成较大的梭形红褐色或黑褐色干腐状病斑[9]。除此之外,还有许多研究证实,梨火疫病菌会引起植物自身体内存在的防御机制酶的变化,王宏等(2019)在对4种早熟梨叶片进行抗病性鉴定时,发现病原菌会诱导了过氧化物酶(Peroxidase,POD)、超氧化物歧化酶(Superoxide dismutase,SOD)活性的上升[10]。何临梓(2022)在对4种梨砧木对梨火疫病进行抗病相关酶活性变化分析时,发现梨火疫病病原菌诱导了4种梨砧木过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)、多酚氧化酶(Polyphenol oxidase,PPO)等五种酶活性的升高和丙二醛(Malondialdehyde,MDA)含量的增加[11]。因此,梨火疫病病菌对植物生长的影响需要被高度关注。
甘肃是草地资源大省,同时也是我国草地畜牧业占重要地位的省份之一,全省草地总面积1 790万hm2,位居全国第6位[12],其中,紫花苜蓿(Medicagosativa)作为优质牧草是甘肃省的主要种植牧草,其在甘肃省的种植面积占全国种植面积的1/3,位居全国之首[13];草木犀(Melilotusofficinalis)对环境具有很强的适应能力,作为重要的盐碱地改良作物在甘肃大面积种植[14];沙打旺(Astragalusadsurgens)是我国重要的栽培豆科牧草,具有出色的抗风沙能力,也是甘肃主要的种植牧草之一[15]。不可否认,病害也是牧草生产的主要限制因素之一,可直接影响牧草的生长,降低牧草产量、影响牧草品质,严重时导致植物死亡,从而引致草地早衰和退化,甚至导致家畜中毒,降低家畜生产性能[16]。更为重要的是,目前梨火疫病已经传入甘肃省武威市(凉州区,民勤县),张掖市(甘州区,肃南县,民乐县,临泽县,高台县,山丹县)[17]。由于受到地理、环境和气候等因素影响,甘肃部分地区不适宜种植粮食作物,农民为了提高收益选择种植果树并在林间种植牧草作为饲料来以饲养家畜[18],已经形成了林草交错的生态群。然而,果树感染梨火疫病,其感病组织脱落后掉入林间草地中,梨火疫病病菌直接与牧草接触,是否会感染林下常见豆科牧草,进而限制草地生产率,还缺少相关科学研究。一旦新发病原微生物进入当地生态系统,将严重威胁生态健康和限制农牧业的可持续发展。
综上所示,本试验以紫花苜蓿、草木犀、沙打旺为供试豆科牧草,以本实验室已分离鉴定的梨火疫病优势致病菌株欧文氏菌DE2(Erwiniasp.DE2)为供试病原细菌菌株,通过生长瓶[19]萌发试验测定DE2接种后对3种牧草种子的苗期生长及体内相关酶活性的影响,分析接种DE2后的3种牧草苗期生长和生理指标,来确定梨火疫病的优势致病菌对我国主要栽培草地的豆科牧草的潜在危害,以期为评估和综合防控林草系统中新发病原微细菌提供科学基础。
1 材料与方法
1.1 试验材料
供试种子:草木犀、紫花苜蓿、沙打旺,由甘肃省农科院提供,并保存在4℃冰箱。
供试菌株:梨火疫病的优势致病菌——欧文氏菌DE2,由本实验室分离鉴定并保存,该菌GenBank注册号为:OQ608623。
供试培养基:大豆酪蛋白琼脂培养基(Tryptose soya agar,TSA/TSB)[20],主要用于菌株纯化。
1.2 菌株培养
参照刘华威[21]的细菌培养方法稍作改动。首先将供试菌株接种于TSA培养皿上,放入28℃培养箱中培养24 h后进行活化,再挑取单菌落利用平板划线法接种于TSA培养皿上放入28℃培养箱中培养24 h,然后挑选单菌落接种于TSB培养液中,放入恒温培养箱中,设置温度为28.5℃,转速为160 r·min-1培养24 h,将菌液离心后弃置上清液,加入无菌水震荡摇匀,将其悬浮为浓度108cfu·mL-1的菌悬液[22]。
1.3 确定菌悬液浓度建立DE2的标准曲线方法
参照朱艳静[23]的方法,有改动。取6支无菌试管,取培养好的菌悬液,按照不同的设定稀释倍数(5,10,20,50,100,200倍),加入无菌水依次进行稀释,用分光光度计在600 nm标准波长下测得一组不同浓度菌悬液的吸光度,测试前用无菌水进行调零,在无菌工作台上吸取上述稀释得到的不同浓度梯度的菌悬液,分别用无菌水按10倍比例稀释成不同浓度的菌悬液。取稀释倍数在10-4~10-8每个浓度的菌悬液吸取1 mL注入TSA培养皿上进行平板涂布,放置28℃的培养箱中培养24 h后用肉眼观察,点出菌落数后记录,挑选菌落数在30~300个的平板作为菌落总数测定的标准,并乘以其对应的稀释倍数,最终计算出不同浓度菌悬液的菌液浓度。以吸光度ABS值为横坐标,菌悬液浓度为纵坐标绘制标准曲线。
1.4 发芽试验和接种方法
采用生长瓶(高度12.0 cm,直径8.0 cm)用高压灭菌锅进行灭菌(121℃,26 min)后进行接种。参照《牧草种子检验规程GB/T2930.4-2001》[24]挑选干净的种子,在无菌工作台中用75%酒精振荡消毒2 min,无菌水冲洗2次;1% 次氯酸钠(NaClO)浸泡5 min,无菌水冲洗3~4次,用无菌滤纸沥干种子表面水分。在无菌工作台中以200 mL的OD600为1.0左右的DE2菌液为培养基质加入生长瓶中,每种牧草取25粒种子,保持一定距离、整齐的摆放于生长瓶发芽床,设置4个重复,对照用无菌水代替菌液。在温度23℃、湿度45%、光照+黑暗(18 h+6 h)的组培室进行培养,观察14 d后取样。
1.5取样方法
接种后的14 d,每个生长瓶取10株幼苗测定其生长指标;采集每个处理组和对照组的幼苗整株各1.0 g左右,测定其生理指标,设置3次重复。
1.6 指标的测定及方法
1.6.1测定发芽指标 根据《草种子检验规程发芽试验GB/T2930.4-2017》[25],草木犀种子在种植后第4 d进行初次计数(发芽势),在第7 d进行末次计数(发芽率);紫花苜蓿种子在种植后第4 d天进行初次计数,在第10 d进行末次计数;沙打旺种子在种植后第4 d进行初次计数,在第14 d进行末次计数。
1.6.2测定生长指标 根长(Root length,RL)和苗长(Seedling length,SL):随机从各处理取出10株幼苗,测量幼苗由植株最高部到根基部为苗长,根基部到根尖为根长。
鲜重(Fresh weight,FW)和干重(Dry weight,DW):随机从各处理取出10株幼苗,用吸水纸吸干幼苗表面水分测定其鲜重,用锡纸包裹幼苗放入烘箱,75℃烘48 h至恒重后称重即为干重。
1.7 数据分析
运用Excel与Origin pro 2021进行数据整理并绘图,利用统计软件SPSS 13.0对试验结果进行分析。
2 结果与分析
2.1 建立DE2标准曲线及确定菌悬液浓度
如图1所示,以吸光度ABS值为横坐标,菌悬液浓度为纵坐标绘制的标准曲线,其建立的回归方程为y=1E+08x-6E+06(R2=0.999 7),标准曲线的回归系数可达0.99以上,准确度很高。根据曲线可确定后续接种试验中所采用的DE2菌悬液浓度为108cfu·mL-1时其OD600为1.0。
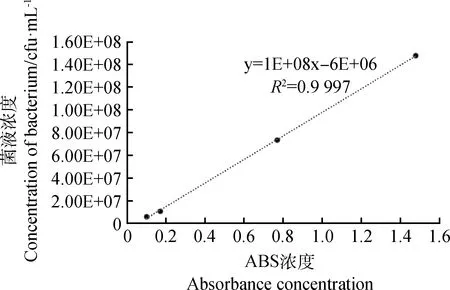
图1 欧文氏菌DE2菌株的标准曲线
2.2 DE2对3种牧草种子的发芽的影响
由表1所示,沙打旺、草木犀与紫花苜蓿在接种DE2后发芽势、发芽率和发芽指数相比对照都有降低。其中草木犀分别降低了28.48%,18.99%,28.57%,差异显著(P<0.05);紫花苜蓿分别降低了22.73%,20.01%,22.51%,差异显著(P<0.05);沙打旺的发芽势和发芽率下降不明显,但发芽指数相比对照显著降低(P<0.05)。表明DE2抑制了3种牧草种子的发芽。
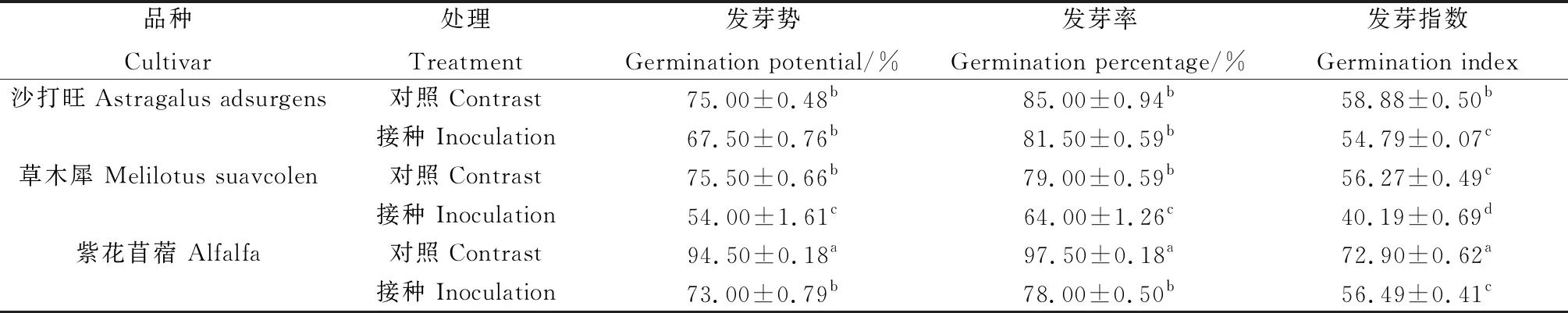
表1 DE2对3种牧草种子萌发的影响
2.3 DE2对3种牧草幼苗生长指标的影响
2.3.1DE2对3种牧草幼苗鲜重、干重、根长和苗长的影响 由图2所示,接种后的3种牧草相比于对照的鲜重和苗长都无显著变化,干重相比于对照3种牧草都有减少但是不显著,根长都明显降低,分别降低了89.50%,92.69%,93.46%,差异显著(P<0.05)。表明DE2对3种牧草幼苗的根系生长有明显抑制作用。
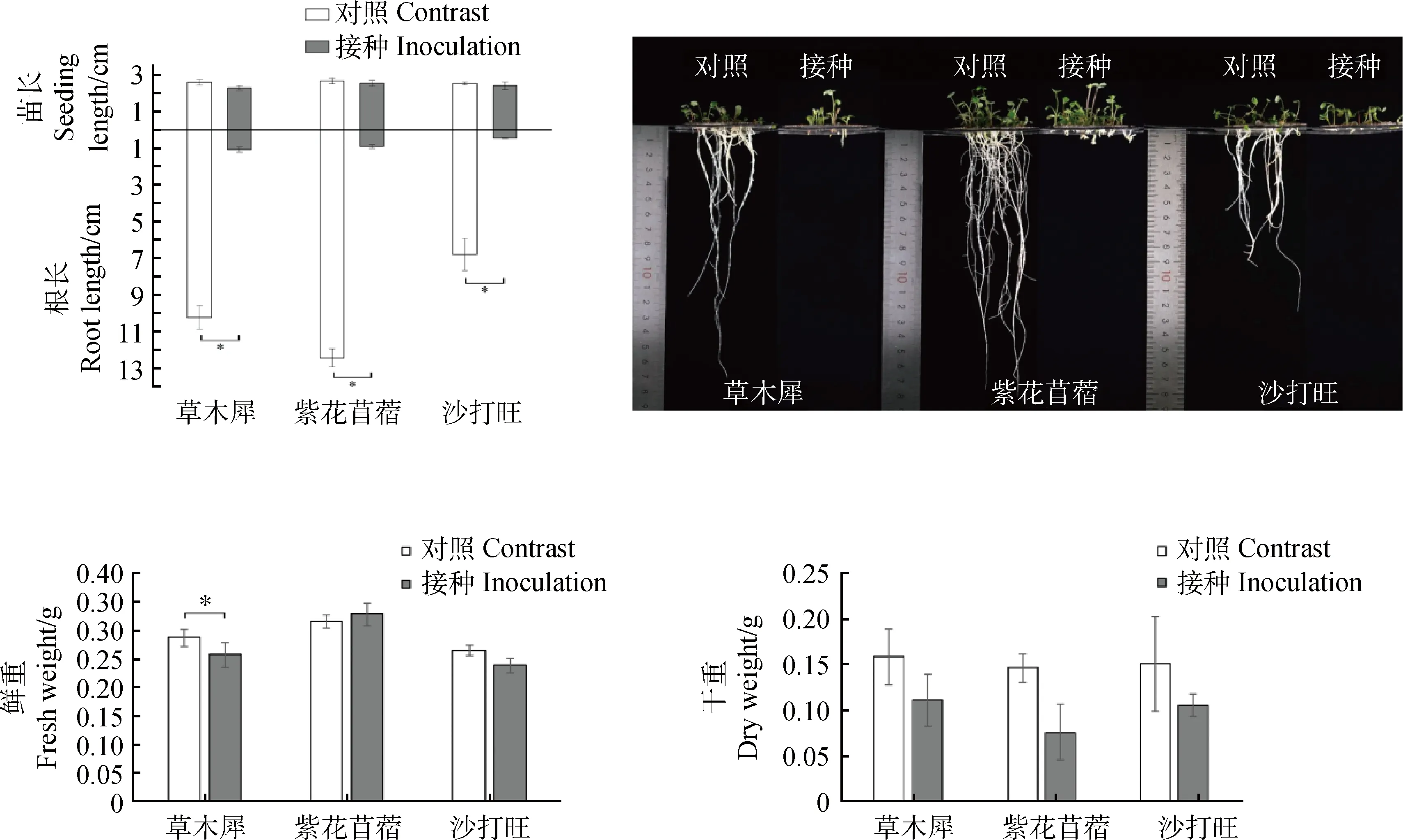
图2 接种DE2后3种牧草的鲜重、干重、根长和苗长
2.4 DE2对3种牧草幼苗生理指标的影响

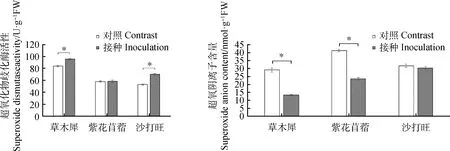
图3 3种牧草接种DE2后SOD活性与含量的变化
2.4.2DE2对3种牧草CAT与GSH-Px活性与H2O2含量的影响 由图4所示,草木犀、紫花苜蓿、沙打旺的CAT活性与对照相比明显增加,分别增长了138.14%,32.36%,73.67%,差异显著(P<0.05);草木犀、紫花苜蓿的GPX活性相较于对照降低,分别降低了12.55%,26.33%(P<0.05),而沙打旺的GPX活性增加了38.11%(P<0.05);草木犀与沙打旺的H2O2含量相较与对照有所增加,分别增加了43.29%,35.56%,差异显著(P<0.05),紫花苜蓿的H2O2含量无明显变化。

图4 3种牧草接种DE2后CAT与GSH-Px活性与H2O2含量的变化
2.4.3DE2对3种牧草MDA与可溶性蛋白含量的变化 由图5所示,接种后草木犀、紫花苜蓿的MDA含量相较于对照均有增加,分别增加了8.65%,6.35%,差异显著(P<0.05),而沙打旺的MDA含量降低了37.17%(P<0.05);接种后草木犀、紫花苜蓿、沙打旺的可溶性蛋白含量相较与对照组均有所降低,分别降低了12.01%,31.90%,17.12%,差异显著(P<0.05)。
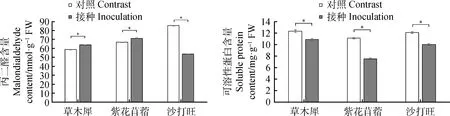
图5 3种牧草接种DE2后MDA与可溶性蛋白含量的变化
2.5 接种DE2后3种牧草各生理指标的增长率与降低率

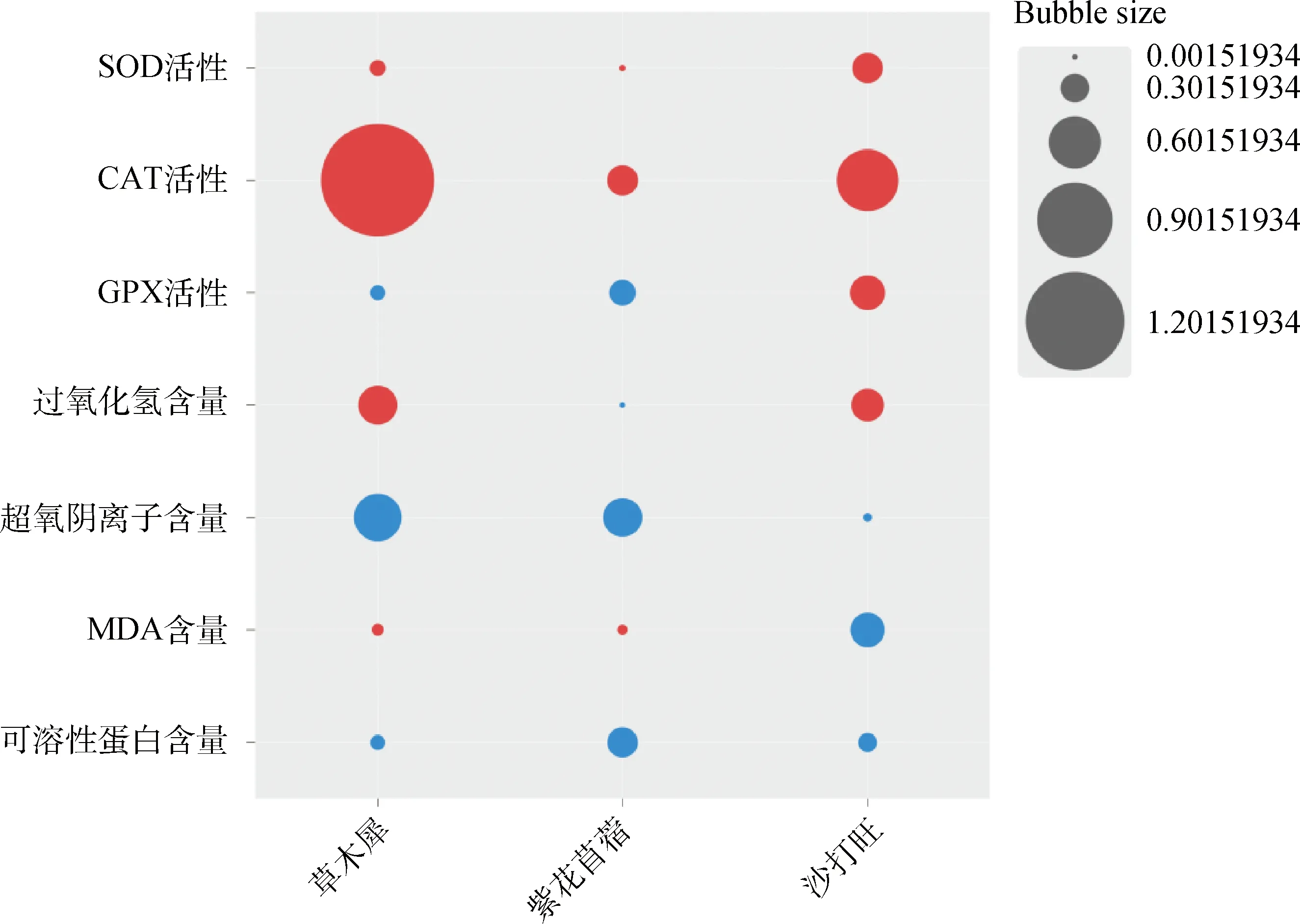
图6 接种DE2后3种牧草各生理指标的增长率与降低率
2.6 接种DE2后3种牧草幼苗各自指标间的相关性分析

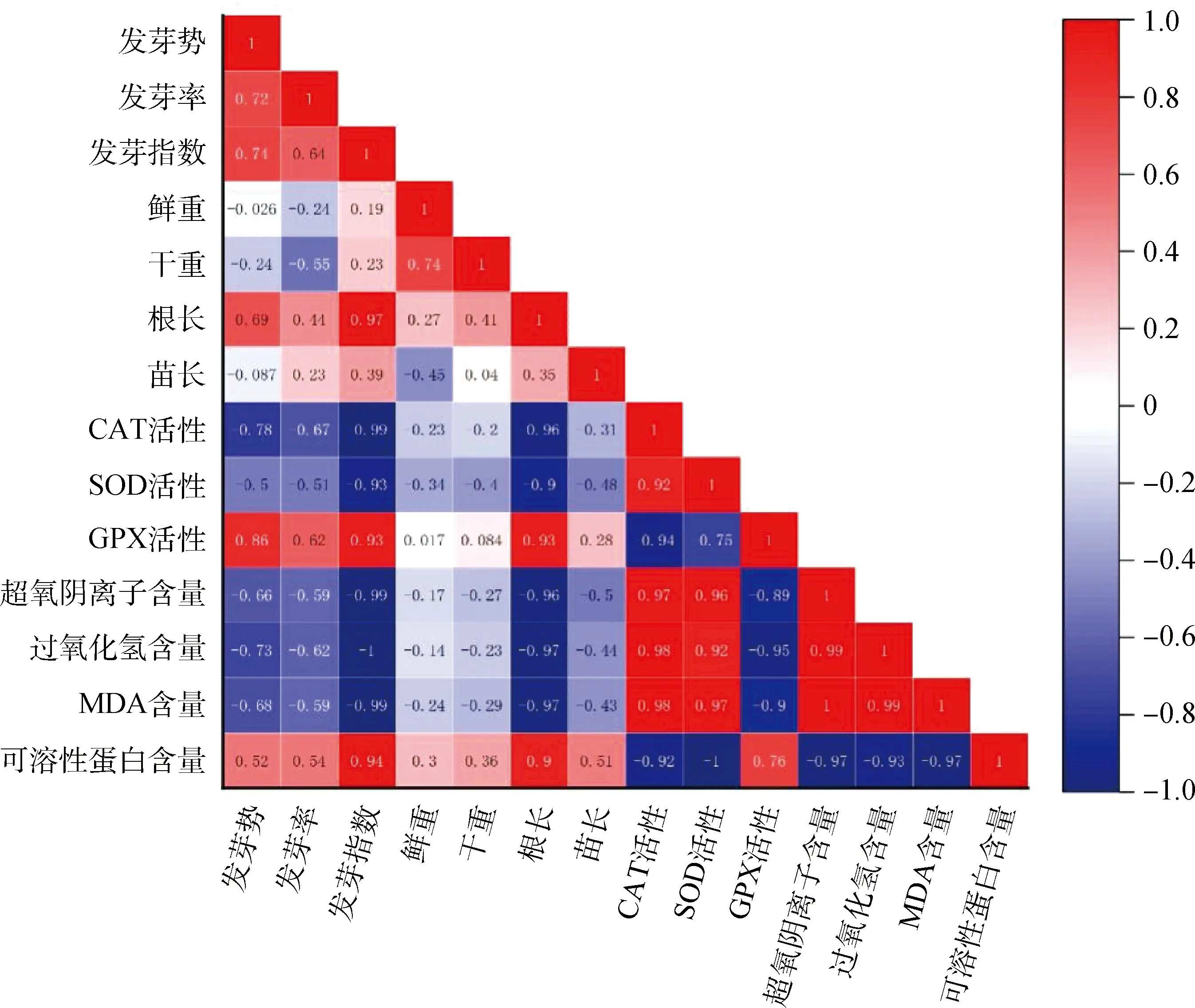
图7 接种DE2后草木犀各指标间的相关性分析

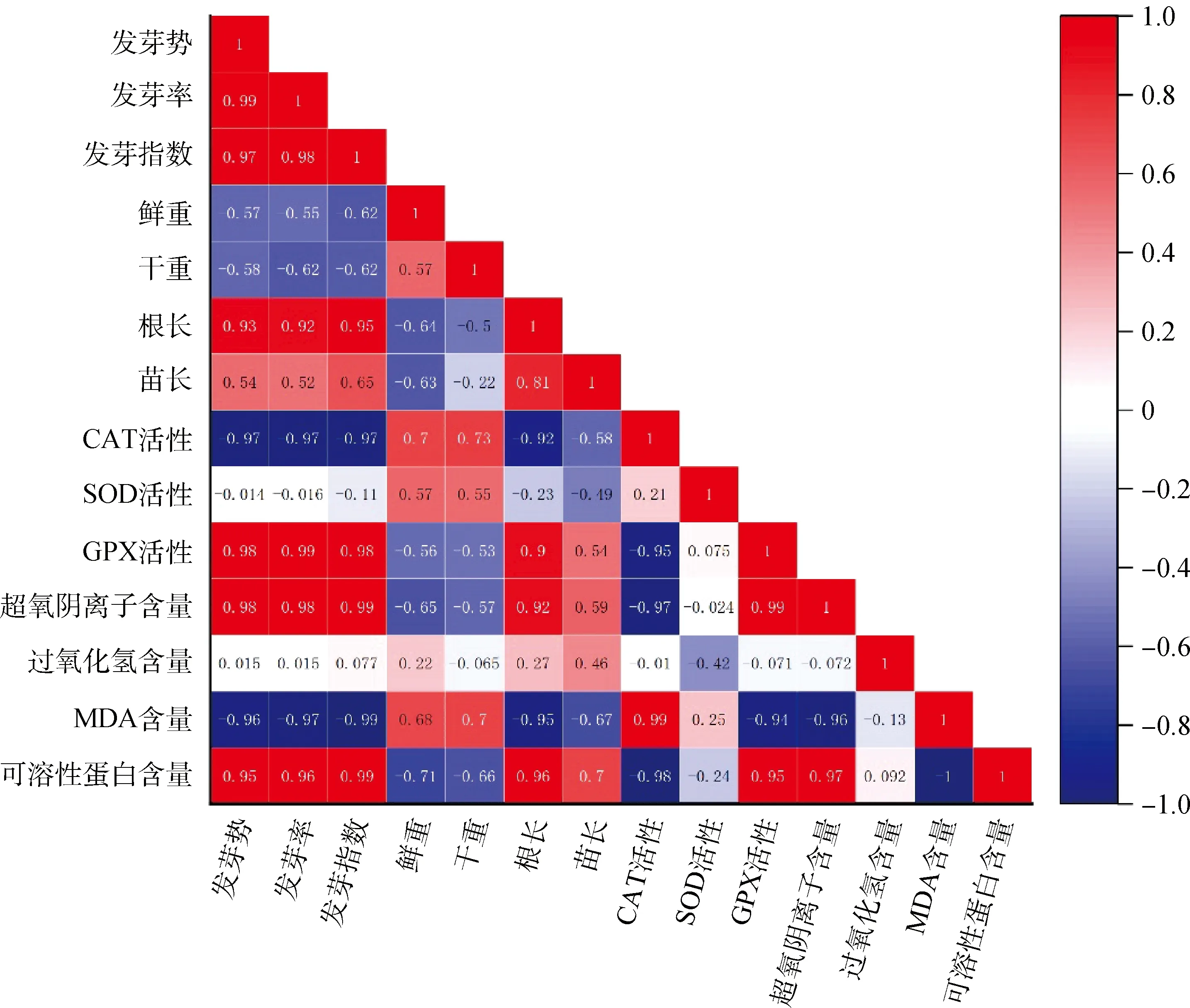
图8 接种DE2后紫花苜蓿各指标间的相关性分析
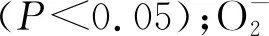
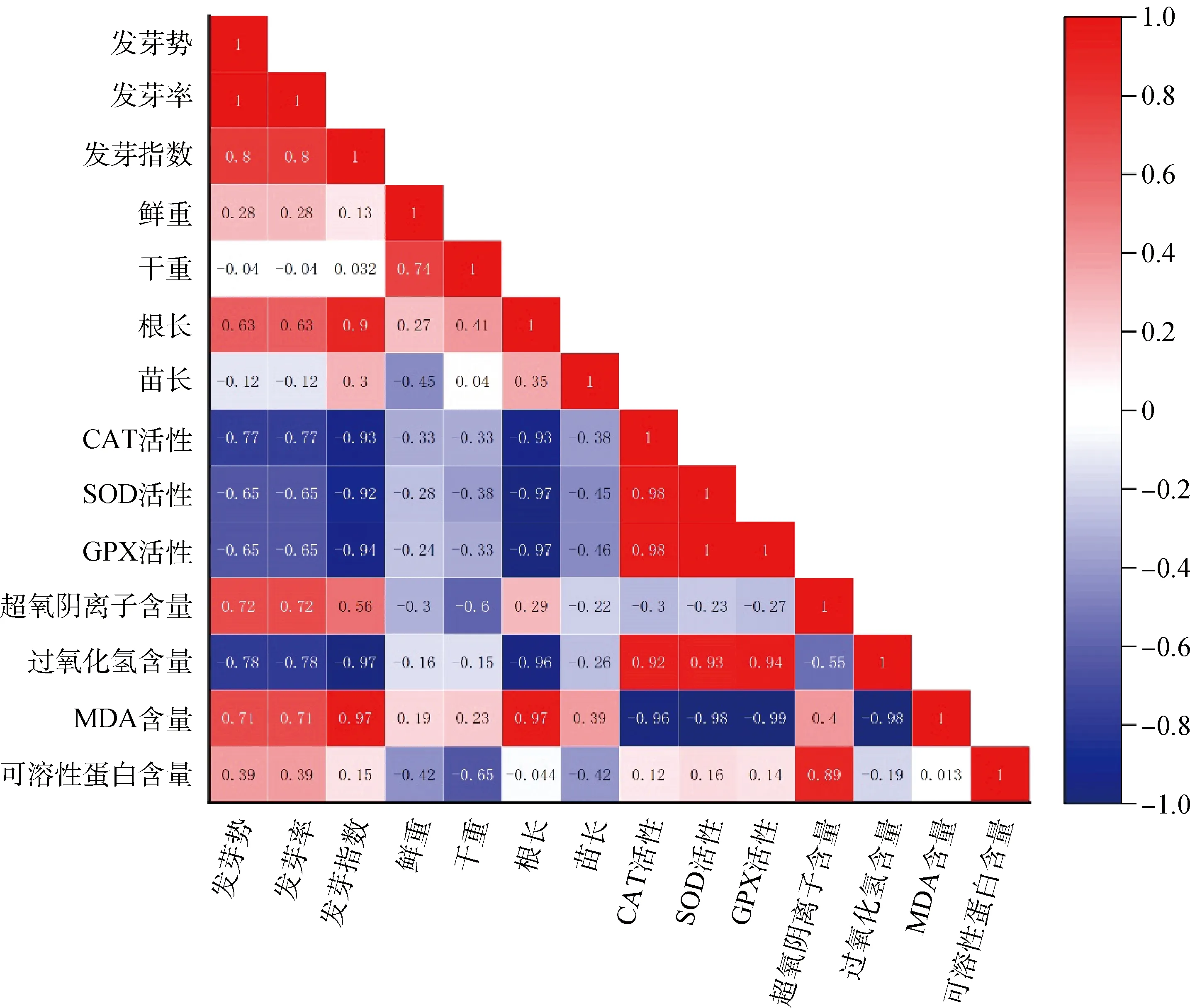
图9 接种DE2后沙打旺各指标间的相关性分析
3 讨论
3.1 DE2对3种豆科牧草幼苗生长的影响
植物病害可影响植株生长的各个阶段,研究表明,植物病害可以通过侵染植株叶片影响植株光合和呼吸作用植物病害,还可以通过侵染植物根部和茎部,使植株根、茎腐烂,水分和养分运输受阻,从而使植株产量下降,品质降低[26-27]。在种子外部的病原菌则会直接侵染种子使其坏死或者产生一些有毒的代谢物质,影响种子的萌发,进而影响植物生长[28]。本试验表明,接种DE2后3种牧草种子的发芽势、发芽率、发芽指数均有降低,其中紫花苜蓿与草木犀的各发芽指标显著降低,与安调过[29]、邢小萍[30]对于黑胚病致病菌会抑制小麦(Triticumaestivum)种子的发芽结果一致。此外本研究还发现接种DE2后各牧草幼苗的鲜重、干重和苗长与对照无显著差异,但各牧草的根长均显著低于对照,表明该菌具有从豆科牧草根部侵入的能力,而侵入位点可能位于根毛生长的部位或者根尖区域[31]。还有研究表明,植物病原菌突破根表皮后,首先会对寄主根的皮层区域的细胞造成损伤,且病原菌感染蒺藜苜蓿的根部后造成的主要症状便是根生长的停滞[32]。根据汪建军[33]的报道,接种燕麦(Avenasativa)细菌性叶枯病致病菌后,燕麦根冠比显著低于对照,这与本试验结果相一致。说明DE2具有很强的致病性与破坏性,明显抑制了草木犀、紫花苜蓿与沙打旺种子的萌发和幼苗根系的生长。
3.2 DE2对3种牧草幼苗生理指标的影响

CAT也是生物防御系统的关键酶之一,生物学功能是催化细胞内H2O2的分解防止过氧化[40],如陶明福[41]报道槟榔受到黄化病病原菌的侵染后,染病植株体内CAT活性总体增大,增加了对H2O2的降解,从而有利于槟榔植株体内H2O2含量的降低,本研究表明3种豆科牧草接种DE2后CAT活性均显著增加,而接种后的草木犀与沙打旺的H2O2含量也显著增加,紫花苜蓿的H2O2含量相比于对照组无明显变化,说明草木犀与沙打旺幼苗产生的CAT不足以分解来自DE2造成的氧化损失而产生的H2O2,草木犀与沙打旺CAT活性显著升高可能与其限制病菌扩展能力有关[42]。GPX是一种含巯基的过氧化物酶,可以清除机体内的H2O2、有机氢过氧化物及脂质过氧化物,阻断ROS自由基对机体的进一步损伤[43]。本试验中接种后的草木犀与紫花苜蓿的GPX活性相比对照都降低,沙打旺的GPX活性显著增加而接种后的沙打旺的H2O2浓度也显著增加,说明沙打旺对DE2的抗性弱,当植物收到胁迫时,多数GPX的表达及活性会增强,但也有表达活性降低的情况[44],例如,在渗透或甲基紫精诱导胁迫条件下,大麦(Hordeumvulgare)的2个GPX同工酶活性增强,而第3个同工酶(HvGPX3)的活性下调[45],虽然在逆境胁迫下,GPX的表达增强,但也有表达下调,因此植物同一物种中的相同亚细胞器来源的不同GPX,或不同亚细胞来源的同一种GPX,其具体的作用机制都需要进一步比较研究[46]。
MDA是膜脂过氧化最重要的产物之一,它的产生还能加剧膜的损伤,因此在植物衰老生理和抗性生理研究中,MDA含量是一个常用指标,可通过MDA了解膜脂过氧化的程度,从而间接测定膜系统受损程度以及植物的抗逆性[47]。可溶性蛋白是重要的渗透调节物质和营养物质,他们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,因此经常用作筛选抗性的指标之一[48]。本试验中,接种DE2后草木犀与紫花苜蓿的MDA含量相比于对照显著增加,说明草木犀与紫花苜蓿在受到DE2侵染时脂膜过氧化而丙二醛不断地积累,使得蛋白质变性,细胞膜的通透性不断增大,从而导致电解质大量的外渗,使植物细胞破坏。这与蒋学飞[49]的报道中植株在受到病菌侵害MDA大量增加相一致。本试验中,接种后的草木犀、紫花苜蓿与沙打旺的可溶性蛋白含量相比对照都有所下降,可能是随着DE2侵染胁迫的加重,植株体内积累的ROS可以攻击某些蛋白质的氨基酸残基,尤其是半胱氨酸(Cys)、酪氨酸(Tyr)、色氨酸(Tpr)、甲硫氨酸(Met)和苯丙氨酸(Phe),使之形成羰基衍生物;ROS还能够引起分子内和分子间交联,如形成二硫键等,导致体内可溶性蛋白含量有所下降[50]。
4 结论
本试验确定梨火疫病优势致病菌欧文氏菌DE2在人工接种条件下,均能危害3种供试豆科牧草的幼苗阶段,具体表现为:欧文氏菌DE2抑制草木犀与紫花苜蓿的发芽势、发芽率、发芽指数,以及沙打旺的发芽指数;接种DE2后3种牧草的根部生长受到的抑制尤其明显,且不同程度的影响其幼苗生理抗氧化指标。本试验确定梨火疫病的优势致病菌对我国主要栽培草地的豆科牧草具有潜在危害,为评估和综合防控林草系统中新发病原微细菌提供科学基础。
——黔南扁穗雀麦

