核糖体结合蛋白1与上皮性卵巢癌患者预后关系研究
梁秀冰,莫劲思,黄小杏,曾庆苏,魏 莉(广东省阳江市人民医院:病理科,妇科,广东 阳江 59500;空军军医大学西京医院妇产科,陕西 西安 700)
卵巢癌是女性生殖系统常见的恶性肿瘤,其病死率位居妇科恶性肿瘤之首[1],上皮性卵巢癌(epithelial ovarian cancer,EOC),是最常见的卵巢癌类型(约占卵巢癌的90%)[2]。然而,大多数患有卵巢癌的女性就诊时均已晚期,肿瘤已经扩散到整个腹部[3]。卵巢癌通常起源于输卵管末端,单个肿瘤细胞也可从输卵管末端脱落入腹腔,在腹膜液循环,从而种植到其他组织器官表面。随着肿瘤细胞生长,便出现腹胀、肠道紊乱等非特异性的症状,这些非特异性症状易归因于常见的良性疾病[4]。虽然大多数患者最初对手术治疗和放化疗反应良好,但是通过长期统计数据来看,EOC患者的5年生存率仅为20%~40%[5],晚期EOC 2~3年的复发率高达70%~80%[6]。在疾病早期发现并治疗的患者,其生存率明显高于在晚期发现的患者,最终生存率可超过90%。因此,进一步研究确定有助于检测肿瘤发生和转移的新型标志物,对于研究EOC的发展和治疗非常重要。
核糖体结合蛋白1(ribosome-binding protein 1,RRBP1)是一种重要的内质网(endoplasmic reticulum,ER)膜蛋白,由1 410个氨基酸组成,包括一个跨膜结构域、一个酸性盘绕的COOH端结构域和一个核糖体结合结构域[7]。RRBP1对于新生蛋白质的运输和分泌至关重要。此外,RRBP1在核糖体结合、分泌细胞以及组织的末端分化中起着关键作用。有研究报道,RRBP1在食道癌[7]、肺癌[6]和结直肠癌[8]中高表达,因此是食道癌、乳腺癌和结直肠癌的一个潜在的预后生物标志物。目前的数据表明,RRBP1是一个致癌基因,可能参与了肿瘤的形成和发展,在肿瘤细胞的生存、恶性肿瘤的维持和ER应激的适应方面发挥着重要作用[9]。目前国内外鲜有关于RRBP1与EOC之间相关性的研究,MA等[10]研究发现RRBP1在EOC中表达率较高,并且RRBP1的表达水平会影响患者生存期。因此,为进一步探究RRBP1对EOC诊断和预后的价值,验证RRBP1作为独立肿瘤生物标志物的潜力具有科研意义,本研究通过分析EOC患者的RRBP1水平与患者临床特征和预后的关系来进行验证。
1 对象与方法
1.1 对象
本研究纳入2015年1月至2019年12月在广东省阳江市人民医院妇科诊治的106例EOC患者的肿瘤标本,随后进行RRBP1表达检测。在患者知情同意下,所有样本在手术中完成标准化收集。所有患者在手术前均未接受相关的癌症治疗。患者第一次手术旨在实现肿瘤的最大切除,术后给予卡铂加紫杉醇的标准化疗方案。患者年龄33~74(平均52)岁。随访截止日期设定为2021年12月,随访时间为24~84(平均47)个月。本研究中的正常组织样本选自阳江市人民医院妇科接受子宫肌瘤切除术的25名妇女,按照标准化术中采集,患者均填写书面知情同意。本研究通过广东省阳江市人民医院伦理委员会审批(阳人医伦理[2014117]号)。
1.2 方法
1.2.1 通过RT-PCR检测EOC组织样本RRBP1 mRNA的表达水平 采用标准检测方法测定EOC肿瘤组织样本中RRBP1 mRNA的表达量[11]:参考使用说明,使用TRIzol试剂(15596-026,上海赛默飞世尔科技)分离总RNA,使用紫外分光光度计(NANO 2000,上海赛默飞世尔科技)测定每个样品中RNA的浓度,使用反转录试剂盒(K1622,上海赛默飞世尔科技)将上述获得的RNA样品进行反转录,以获得相应的cDNA,之后进行标准PCR扩增实验。RRBP1引物:正向,5′-AACCTAATGGGAAGATACCTGA-3′;反向,5′-CATGGCTGGAACTGTGGC-3′。作为内参的β-肌动蛋白的引物序列为:正向,5′-GGGAAATCGTGCGTGAC-3′;反向,5′-GTCAGGCAGCTCGTAGCTT-3′。在本实验中,使用荧光仪(BIONEER,韩国)进行荧光定量分析。用2-ΔΔCt方法确定RRBP1的相对丰度。
1.2.2 免疫组化检测EOC组织样本中RRBP1表达量 参考标准免疫组化方法[12],将EOC组织切成4 μm厚的连续切片,在福尔马林中固定并嵌入石蜡中。将石蜡切片在65 ℃下烘烤30 min去除石蜡,再将切片放在30 mL/L H2O2中重新水化。之后将切片浸泡在0.01 mol/L EDTA中,在121 ℃高压条件下处置4 min。随后自然冷却至室温,用蒸馏水浸泡3次,每次2 min;再用PBS清洗3次,每次5 min。加入抗RRBP1(ab95983,上海艾博抗),4 ℃下孵育过夜。次日用PBS清洗3次,每次5 min,放入保湿箱,滴入二抗,加入ABC工作液和底物后在室温保湿箱中孵育1 h。石蜡切片用苏木精进行反染色,脱水,密封,并在60 ℃的烤箱中放置48 h。采用半定量方法对EOC组织的RRBP1免疫组化表达水平进行评分:根据阳性肿瘤细胞的数量,对染色情况进行评分:0级(<10%),1级(10%~33%),2级(>33%~66%),3级(>66%~100%)。染色强度按照阴性、弱性、中度和强度染色进行评分,分为0~3分。最终得分是这两个指标的总和。最终,认定0~1分为低表达,2~3分为中度表达,而>3分为高表达。
1.3 统计学分析

2 结果
2.1 EOC患者肿瘤组织中RRBP1基因表达水平与临床病理特征存在相关性
入组患者临床信息见表1。统计分析结果表明,EOC患者肿瘤组织中RRBP1表达水平与患者肿瘤的FIGO分级、组织学分级、组织学类型和淋巴结转移存在显著相关性(P<0.05)。

表1 EOC患者肿瘤组织中RRBP1表达水平与临床病理特征关联分析
2.2 EOC与非肿瘤卵巢组织间RRBP1表达水平比较
通过免疫组织化学分析EOC组织中RRBP1的表达(图1)。统计分析显示108个EOC标本中,77%的病例表达高,13%的病例有中度表达,10%的病例表达能力低。使用qPCR对患者上皮肿瘤组织和对照的非肿瘤组织中RRBP1表达水平进行评估。检测结果显示,EOC组织中RRBP1 mRNA相对表达水平为11.38±2.56,远高于正常上皮卵巢组织中的RRBP1 mRNA相对表达水平(1.02±0.47,P<0.001)。
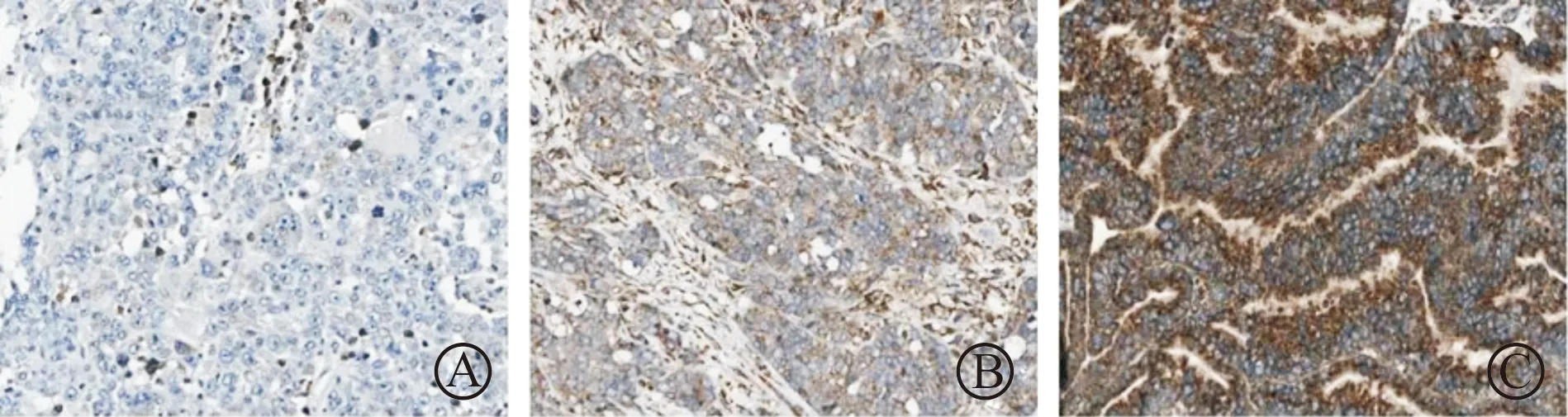
图1 RRBP1在EOC患者细胞质中低表达(A)、中表达(B)和高表达(C)的免疫组织化学染色示例图(×40)
2.3 RRBP1表达对EOC患者生存的影响
Kaplan-Meier分析显示,RRBP1的表达水平显著影响患者的总生存期(overall survival,OS)(P=0.014,图2A)和无病生存期(disease-free survival,DFS)(P=0.032,图2B)。单因素生存分析发现,患者年龄、肿瘤FIGO分级也与患者预后相关(P<0.05,表2)。

A:EOC根据其RRBP1表达状态的OS曲线(P=0.014);B:EOC患者根据其RRBP1表达状态的DFS曲线(P=0.032)。OS:总生存期;DFS:无病生存期。图2 EOC患者不同RRBP1表达水平相关的OS和DFS的Kaplan-Meier曲线分析图

表2 106例EOC患者OS和DFS的单因素生存分析
2.4 RRBP1的表达与其他临床病理因素的相关性分析
多变量Cox回归分析显示,RRBP1表达水平是EOC患者OS(95%CI:1.327~4.225,P=0.009)和DFS(95%CI:1.467~3.219,P=0.007)的一个预后的独立危险因素(表3)。

表3 106例EOC患者OS和DFS的多因素生存分析
3 讨论
目前EOC的发生发展机制仍然不详[13]。以往多数学者认为,EOC起源于卵巢表面上皮及其内陷形成的包涵体[14-17]。腹膜的上皮、卵巢的表面上皮和副中肾管皆来自体腔上皮,卵巢表面上皮有向副中肾管分化的潜能,其向输卵管上皮分化则为浆液性肿瘤,向子宫内膜分化则为内膜样肿瘤,向子宫颈黏液上皮分化则为黏液性肿瘤,向移行上皮分化则为Brenner瘤[18-19]。
RRBP1是一种ER膜蛋白,对于核糖体结合和新生蛋白跨过粗面ER膜的易位是必不可少的。研究表明RRBP1在分泌组织的原胶原蛋白生物合成和分泌组织的终端分化中发挥重要作用,其表达水平对肿瘤发生发展具有显著的影响[20]。本研究通过qPCR和免疫组化检测证实了同相邻的正常组织相比,RRBP1在EOC肿瘤组织中高度表达,且RRBP1的表达水平与患者FIGO分级、组织学分级、组织学类型和淋巴结转移情况显著相关。通过进行单因素和多因素Cox回归分析,我们发现RRBP1高表达的EOC患者的OS和DFS明显下调,证实了RRBP1是EOC的一个独立预后因素。上述发现表明,RRBP1在EOC的进展中起着重要作用,并对EOC患者的预后有深远影响。
ER异常通常在肿瘤生长和肿瘤微环境中起致癌作用。ER蛋白及其下游信号通路的异常激活已成为肿瘤生长和转移的关键治疗靶点[21]。ER应激在肿瘤的发生发展过程中发挥作用,其可通过延长未折叠蛋白反应(unfolded protein response,UPR)过程的激活时间来促进细胞内自噬的保护功能,从而导致触发细胞凋亡的机制[22-23]。为了维持ER的稳态,UPR过程会减慢正在进行的蛋白质合成,并增加ER的折叠能力。已有研究表明ER应激过程中RRBP1对UPR具有促进作用。其通过葡萄糖调节蛋白78对UPR进行调控,从而破坏由衣霉素及2-脱氧-D-葡萄糖诱导的ER应激[24]。本次研究中EOC患者出现RRBP1过度表达也与不良预后显著相关,本研究与上述研究均表明,RRBP1在癌症的发生和肿瘤的发展中起着重要的生物学作用,进一步证实了RRBP1具有运用于EOC患者的个体化治疗和预后评估的潜力。
综上所述,RRBP1在大多数EOC患者中过度表达,EOC组织中RRBP1的过度表达导致EOC患者的预后更差。本研究证实了卵巢癌组织中RRBP1可以作为EOC的关键标志物,同时也有潜力成为一个潜在免疫治疗靶标。要有效地将RRBP1在肿瘤中的作用应用于肿瘤的治疗,需要做更精确的实验来进一步进行验证。

