干扰TAK1通过下调TAB2/3来抑制肺成纤维细胞的增殖、侵袭、迁移和纤维化
章艳菊 周小娣 夏云飞
肺纤维化(plumory fibrosis,PF)不仅是一种疾病,而且是其他多种慢性肺部疾病的终末期病理改变[1]。PF是多种慢性肺部疾病致残和死亡的主要原因[2]。PF是一种不可逆的间质性疾病,特别是特发性纤维化,患者的平均生存时间只有2.8年[3]。因此,PF的发生发展机制及治疗方案正在被不断深入研究中。
TGF-β激活激酶1(TGF-β activated kinase 1,TAK1)是丝裂原活化蛋白激酶(mitogen-activated protein 3 kinase,MAP3K)家族的一个成员MAP3K7。它在免疫反应、炎症反应和纤维化等疾病中起着重要的作用[4-5]。TAK1作为NF-κB信号通路的关键上游因子,可被转化生长因子-β(transforming growth factor-β,TGF-β)、Toll样受体等因子激活[6]。在成年小鼠肾组织中TAK1可激活的JNK、p38和NF-κB,促进肾间质肌成纤维细胞的积累和胶原沉积[7]。TAK1在尘肺患者和硅暴露大鼠的肺组织以及大鼠的肺泡巨噬细胞中过表达,可加重肺部炎症和纤维化[8]。然而,据我们所知,TAK1在PF中的作用尚未被研究。
通过检索蛋白质相互作用分析数据库STRING和通用生物学互作资源数据库BioGRID,发现TAK1与TAK1结合蛋白(TAK1-binding protein,TAB)2/3共表达,并可以与TAB2/3结合;PF患者中TAB2/3的表达增加[9-10]。因此,我们推测TAK1可以调控TAB2/3,促进PF的进展。因此,本研究中,主要讨论TAK1在TGF-β1诱导的肺成纤维细胞增殖、侵袭、迁移和纤维化中的作用,并探讨了其机制,以期为PF治疗提供新的靶点。
资料与方法
一、实验材料与方法
1 细胞培养、分组及转染:人胚肺成纤维细胞(human fetal lung fibroblast 1,HFL-1;武汉普诺赛生命科技有限公司),在DMEM(Biological Industries)中添加10%胎牛血清(Biological Industries)进行培养,培养条件:37 ℃,5% CO2,湿度饱和。分组:Control组(未进行任何处理HFL-1)、TGF-β1组(10ng/mL TGF-β1诱导HFL-1)、TGF-β1+si-NC组(转染si-NC+TGF-β1诱导)、TGF-β1+si-TAK1组(转染si-TAK1+TGF-β1诱导)、TGF-β1+si-TAK1+pcDNA3.1组(转染si-TAK1+pcDNA3.1+TGF-β1诱导)、TGF-β1+si-TAK1+pcDNA3.1-TAB2组(转染si-TAK1+pcDNA3.1-TAB2+TGF-β1诱导)、TGF-β1+si-TAK1+pcDNA3.1-TAB3组(转染si-TAK1+pcDNA3.1-TAB3+TGF-β1诱导)。TGF-β1组用10 ng/mL TGF-β1 (MedChemExpress)处理细胞48 h。使用Lipofectamine 2000试剂将si-NC、si-TAK1、pcDNA3.1、pcDNA3.1-TAB2、pcDNA3.1-TAB3转染至HFL-1后,用10 ng/mL TGF-β1处理细胞后进行后续实验。
2 羟脯氨酸含量(hydroxyproline,HYP)测定:根据检测试剂盒(Biovision,Mountview,CA)说明,通过测定羟脯氨酸来评估培养细胞中的胶原蛋白含量。
3 数据库:STRING数据库(www.string-db.org)[11]和BioGRID数据库(thebiogrid.org)[12]检测TAK1和TAB2/TAB3之间的关系。
4 Western-Blot:使用BCA试剂盒(赛默飞世尔科技公司)检测蛋白质浓度。根据所测蛋白浓度,每孔吸取30 μg蛋白装载到10%的SDS-PAGE凝胶上。凝胶电泳后,将蛋白转移到PVDF膜上,然后用5%牛血清白蛋白在室温下封闭30 min。然后用一抗在4 ℃下孵育过夜。使用的一抗如下:α-平滑肌肌动蛋白 (α-smooth muscle actin,α-SMA;Abcam),TAK1 (Abcam),基质金属蛋白酶2 (matrix metalloproteinase 2,MMP2;Abcam),基质金属蛋白酶9 (MMP9;Abcam),纤维连接蛋白1 (fibronectin 1,FN1;Abcam),Ⅰ型胶原蛋白 (collagen,ColⅠ;Abcam),Ⅲ型胶原蛋白 (ColⅢ;Abcam),TAB2(Abcam),TAB3(Abcam)和GAPDH(Abcam)。在与二抗(Abcam)孵育1.5 h。ECL发光,扫描图像,Image J 分析条带灰度值。
5 逆转录-定量PCR(reverse transcription-quantitative PCR,RT-qPCR):根据说明书使用TRIzol®试剂盒(赛默飞世尔科技公司)从HFL-1细胞中获得总RNA。cDNA合成使用M-MLV第一链合成试剂盒(赛默飞世尔科技公司)。根据一步法RT-qPCR试剂盒(SYBR Green)(赛默飞世尔科技公司)进行PCR扩增。所使用的热循环条件为:95 ℃,2 min,后95 ℃,20 s;60 ℃,15 s;72 ℃,30 s循环40次。相对基因表达量采用2-ΔΔCt方法[13]。以GAPDH作为内参基因。用于序列检测的特异性引物如下:TAK1正向:5′-ACTCACTTGATGCGGT-3′,反向:5′-CGGCGATCCTAGCTTC-3′;TAB2 正向:5′-AGTACAAGATATCTTTATGG-3′,反向:5′-TGCTGTCTGTGGCTCCTGCT-3′;TAB3正向:5′-GCAAGGATGGAGAGGTTAGCA-3′,反向:5′-GTCATTTCCTCAGGCGTAGGG-3′;GAPDH 正向:5′-GAGCCCGCAGCCTCCCGCTT-3′,反向:5′-CCCGCGGCCATCACGCCACAG-3′。
6 CCK-8(cell counting kit-8):使用CCK-8试剂盒(Dojindo Molecular Technologies)测定细胞增殖活性。将细胞以5×103个/孔的密度接种到96孔板中在37 ℃条件下过夜生长。然后转染(如上所述),用TGF-β1处理,然后加入10 μL的CCK-8溶液。然后将细胞孵育3小时,使用酶标仪在450 nm波长处测定吸光度(Bio-Rad Laboratories,Inc.)。
7 细胞划痕实验:HFL-1细胞在6孔板中培养,直到它们在含有10%胎牛血清DMEM中融合达到100%。使用移液枪头尖端在单层细胞进行划痕。用PBS洗涤细胞3次,并在含无血清培养基的培养箱中培养。0和24 h时,使用光学显微镜获得连续图像。通过测量细胞的迁移距反映细胞的迁移能力。
8 Transwell实验:HFL-1细胞用无血清培养基处理12 h,重悬细胞。计数后调整细胞密度至5×105/mL。Transwell小室放置24孔板(Corning,Inc)中,将细胞悬液(200 μL)加 入上室,下室加入500 μL含有 10%胎牛血清的DMEM培养。取出 Transwell 小室,弃去培养液,用棉签去除上层未通过膜的细胞后加入4%多聚甲醛在室温下固定细胞15 min。将膜底部的细胞用结晶紫染料在室温下染色。在显微镜下计数侵袭的细胞。
9 免疫共沉淀(Co-immunoprecipitation,Co-IP):Co-IP使用Pierce免疫共沉淀试剂盒(Thermo Fisher Scientific,Inc.)。细胞裂解液中加入抗体,经过洗脱,收集免疫复合物,然后进行SDS-PAGE及Western Blot分析。以抗IgG抗体作为阴性对照。TAK1,TAB2 和 TAB3 抗体作为一抗,山羊抗兔IgG,(北京康为世纪生物科技有限公司)作为二抗进行免疫印迹分析。
二、统计分析
结 果
一、抑制TAK1表达对HFL-1细胞增殖的影响
TGF-β1诱导HFL-1后细胞增殖,逐渐转化为扁平状纤维结构的肌成纤维细胞。与Control组比较,TGF-β1组ColⅠ和α-SMA蛋白表达水平均明显增加(P<0.001)(图1A),并通过HYP检测到胶原蛋白含量增加(图1B),细胞模型诱导成功。与Control组比,TGF-β1组的TAK1表达增加(图2)。在未经处理的HFL-1中转染si-TAK1,与si-NC组相比,在si-TAK1-1和si-TAK1-2组中TAK1的表达显著下降,si-TAK1-2组更明显。与TGF-β1+si-NC组比,TGF-β1+si-TAK1组中TAK1的表达降低,且si-TAK1-2组的表达降低更明显(P<0.001)(图3A,B),后续的实验采用si-TAK1-2。CCK-8结果显示,与Control组比较,TGF-β1组明显增殖;与TGF-β1+si-NC组比,TGF-β1+si-TAK1-2组增殖下降(P<0.05)(图3C)。

图1 ColⅠ、α-SMA和HYP表达水平

图2 TAK1的表达 A:TAK1mRNA表达;B,C:TAK1蛋白表达。与Control组比:***P<0.001

图3 si-TAK1对HFL-1细胞增殖的影响
二、抑制TAK1表达对HFL-1细胞的侵袭、迁移和纤维化的影响
Transwell和细胞划痕实验显示,与Control组比,TGF-β1组细胞的侵袭和迁移明显增加;与TGF-β1+si-NC组相比,TGF-β1+si-TAK1-2组的细胞侵袭和迁移显著减弱(图4A~D)。与Control组比,TGF-β1组迁移相关蛋白(MMP2,MMP9)和纤维化相关蛋白(FN1,ColⅠ,Col Ⅲ)的表达增加;与TGF-β1+si-NC组相比,TGF-β1+si-TAK1-2组迁移和纤维化相关蛋白的表达下降(MMP2,MMP9,P均<0.001;FN1,P=0.007,ColⅠ,P<0.001,Col Ⅲ,P=0.006)(图4E~F)。结果表明si-TAK1抑制TGF-β1诱导HFL-1细胞的侵袭、迁移和纤维化。

图4 si-TAK1对HFL-1细胞侵袭、迁移和纤维化影响 A:迁移能力检测(×100);B:细胞迁移率;C:侵袭能力检测(结晶紫染色,×100);D:细胞侵袭率;E:迁移相关蛋白表达;F:纤维化相关蛋白表达。与Control组比较,***P<0.001;与TGF-β1+ si-NC组比较,###P<0.001
三、干扰TAK1对TAB2/3表达的影响
利用STRING和BioGRID数据库发现TAK1与TAB2/3共表达(图5A)。与Control组相比,TGF-β1组中TAB2/3的表达明显增加(P<0.001)(图5B~C)。Co-IP结果显示,TAK1可以在HFL-1细胞中与TAB2/3结合。与Control组比,si-TAK1-2组TAB2/3表达明显降低(P<0.001)(图5D)。结果表明,si-TAK1可以抑制TAB2/3的表达。

图5 si-TAK1对TAB2/3表达影响 A:TAK1和TAB2/3关联图;B-C:TAB2/3的mRNA和蛋白表达;D:si-TAK1后TAB2/3蛋白表达。与Control组比较,***P<0.001
四、过表达TAB2/3对si-TAK1-HFL-1细胞增殖、侵袭、迁移和纤维化的影响
在未经处理的HFL-1中转染pcDNA3.1-TAB2/3,即过表达TAB2/3后,TAB2/3的表达显著增加。与TGF-β1+pcDNA3.1组比,TGF-β1+pcDNA3.1-TAB2/3组TAB2/3表达显著增加(P<0.001)(图6A)。与TGF-β1+si-TAK1-2+pcDNA3.1组比,TGF-β1+si-TAK1-2+pcDNA3.1-TAB2/3组增殖、侵袭、迁移、迁移相关蛋白(MMP2、MMP9)和纤维相关蛋白(FN1、ColⅠ和Ⅲ)明显增加(P均<0.05)(图6B,7)。结果表明,过表达TAB2/3可以逆转si-TAK1对HFL-1细胞增殖、侵袭、迁移和纤维化的影响。
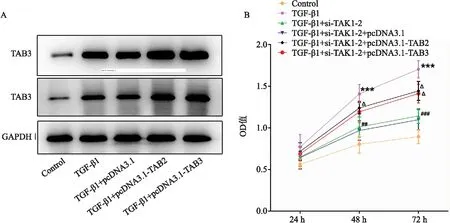
图6 过表达TAB2/3对HFL-1细胞增殖影响 A:各组TAB2/3表达;B:细胞增殖检测。与Control组比较,***P<0.001;与TGF-β1组比较,##P<0.01,###P<0.001;与TGF-β1+si-TAK1-2+pcDNA3.1比较,ΔP<0.05

图7 过表达TAB2/3对HFL-1细胞侵袭、迁移和纤维化影响 A:细胞迁移检测(×100);B:细胞侵袭检测(结晶紫染色,×100);C:细胞迁移率;D:细胞侵袭率;E:迁移相关蛋白表达;F:纤维化相关蛋白表达。与Control组比较,***P<0.001;与TGF-β1组:###P<0.001;与TGF-β1+si-TAK1-2+pcDNA3.1比较,ΔΔΔP<0.001
讨 论
PF的主要病理特征之一是过度增殖和肺成纤维细胞转化[14]。TGF-β1是诱导PF形成的关键细胞因子之一。它可以启动肺成纤维细胞的激活,并调节它们的增殖、迁移和分化[15-16]。多项研究表明,肺纤维化过程中TGF-β1水平升高,TGF-β1可促进肺成纤维细胞的增殖、侵袭和迁移,合成胶原,促进胶原在肺组织中的沉积[17-19]。因此,本研究采用TGF-β1诱导HFL-1细胞,显著增加了其增殖、侵袭和迁移,显著增加了Col I和α-SMA的表达水平,并通过HYP检测到胶原蛋白含量增加。结果表明细胞模型构建成功。
TAK1与体内的炎症和应激有关,其在不同的人体组织中的表达也不同[20]。TAK1与人体正常的胚胎发育和神经系统修复有关[21-22]。抑制TAK1可以减少实验性尘肺的炎症和纤维化[8]。小鼠纤维化上皮细胞中TAK1和Zeste基因增强子同源物2的缺失或者阻断核内肌动蛋白可减弱纤维化级联反应并恢复呼吸稳态[23]。这些结果表明,抑制PF中TAK1的表达与PF的发生有关。此外,有研究表明,TAK1可以被TGF-β1等细胞因子激活。我们的实验表明在用TGF-β1诱导HFL-1细胞后,细胞中TAK1的表达明显增加。干扰细胞中TAK1的表达后,细胞的增殖、侵袭、迁移和纤维化均明显降低。
TAB2/3已被证实在TAK1和上游TNF受体相关因子之间起重要作用[24]。此外,TAB2/3还被证实在引导TAK1依赖的MAP激酶激活中发挥作用[25]。利用STRING和BioGRID数据库,还发现TAK1与TAB2/3共表达,TAK1可以调控TAB2/3的表达。此外,还验证了TAK1与TAB2/3的结合。在PF患者中,TAB2/3的表达已被证明增加并参与了PF的过程[9-10]。本研究证实了在TGF-β1诱导的PF细胞中,TAB2/3的表达显著增加。在PF模型中,TGF-β的表达增加,导致TAB2表达的激活[26]。本研究发现,过表达TAB2/3显著减弱了TAK1干扰在TGF-β1诱导的HFL-1细胞中的保护作用,提示TAK1可能通过调控TAB2/3在IPF中发挥其作用。此外,我们还发现,转染TAB2后,TAB3也增加了。可能的原因是TAB2和TAB3是两个同源的k63-多聚泛素结合的TAK1衔接蛋白,可能在脊椎动物进化的早期共享一个共同的祖先基因。这两个同源的衔接蛋白对于TAK1的激活至关重要[27]。然而,具体的机制将在未来的实验中进一步探索。
综上所述,本研究结果显示,干扰TAK1可能通过下调TAB2/3在TGF-β1诱导的成纤维细胞中发挥其保护作用。过表达TAB2/3可以逆转TAK1干扰对HFL-1细胞增殖、侵袭、迁移和纤维化的影响。这些发现为靶向治疗PF提供了坚实的理论基础。但是目前通过何种信号通路且缺乏体内研究,这些都是我们需要继续研究的方向。

