紫花地丁辐照前、后镇痛、抗炎及抗菌活性对比研究
颜宏 柴琇瑛 赵道强 郭琰 李婷 钟承志 吴德松


摘要:目的 对紫花地丁辐照前、后样品的镇痛、抗炎、抗菌活性和安全性进行对比研究。方法 采用最大给药量法测定辐照前、后样品小鼠灌胃给药的急性毒性;采用醋酸致小鼠疼痛模型、二甲苯致小鼠耳肿模型和最小抑菌浓度(MIC)值测定实验,对比紫花地丁辐照前、后样品的药效学活性。结果 小鼠急性毒性实验结果显示:紫花地丁辐照前、后样品小鼠灌胃给药最大给药量为24 g/kg,小鼠灌胃后的毒性反应主要为腹泻症状,于给药后第2日恢复正常,二者在安全性方面无明显差异。药效学研究结果显示:紫花地丁辐照前、后样品均可显著降低醋酸致小鼠扭体反应次数、抑制二甲苯致小鼠耳肿,并在体外对金黄色葡萄球菌、大肠埃希菌、白色念珠菌和肺炎链球菌均具有一定的抑制作用,且辐照前、后样品抑制作用一致,最小抑菌浓度MIC值分别为2.5、2.5、1.25、1.25 mg/mL。从药效活性来看,二者无明显差异。结论 紫花地丁辐照前、后样品在安全性和药效学活性方面均无明显差异,初步表明辐照灭菌法可用于该药材的灭菌。
关键词:紫花地丁;辐照灭菌;急性毒性试验;安全性;抗炎;镇痛;抗菌
中图分类号:R285.5 文献标志码:A 文章编号:1007-2349(2023)09-0001-03
辐照灭菌技术利用电离辐射(主要指60Co-γ射线、加速器产生高能电子束或转换成的X射线)与物质相互作用产生的物理、化学和生物效应,抑制微生物遗传物质合成,从而达到灭菌效果[1]。它是一种新型、高效的灭菌方法,尤其是对挥发性、热敏性中药,表现出了优越性,已成为传统中药灭菌的重要补充方法[2]。它的特点是穿透力强,可有效避免药品或药材在使用之前的二次污染;可在常温下进行,不会明显升高被辐照物的温度,是热敏药物的最佳灭菌方法[3];同时,辐照灭菌操作简便、速度快,辐照后可立即使用,无需静置或冷却,可实现大规模商业化生产。[KG)]
紫花地丁(Viola yedoensis)是堇菜科多年生草本植物,性寒味苦,在民间有着悠久的用药历史,在中国传统医用上,紫花地丁主要以全草入药,主要用于抗菌消炎、清热解毒和涼血消肿,同时外用治疗湿疹、瘙痒和粉刺等皮肤病。现代医用上发现其具有较好的抗病毒、抗炎、抑菌和抗肿瘤活性,临床上多用于治疗疔疮肿毒、尿路感染、蜂窝组织炎、乳腺炎和咽炎等,外用治疗痈肿、跌打损伤和毒蛇咬伤等。由此可见,紫花地丁有着很高的开发价值[1]。为了满足规模化生产的需要,我们将紫花地丁的灭菌方式改为辐照灭菌,但是对于不同的药材,其最佳的辐照剂量不同,辐照剂量过大会引起个别中药化学成分、生物活性的变化。参照《中药辐照灭菌技术指导原则》的相关规定和紫花地丁的临床应用[4,5],我们对紫花地丁辐照前后样品的安全性、镇痛、抗炎和抗菌活性进行了初步评价,为其工艺改进提供实验基础。
1 实验材料
1.1 受试样品 紫花地丁干燥全草,由云南白药集团中药资源事业部提供,批号:2018120503-1。样品制备方法:取紫花地丁干燥全草,粉碎后过150目筛,过筛率67.13%,灰绿色粉末,批号:YC2421301,为紫花地丁(辐照前)样品。取紫花地丁干燥全草,经60Co辐照灭菌(辐照剂量为20 kGy),粉碎后过150目筛,过筛滤66.77%,灰绿色粉末,批号:YC2421301,为紫花地丁(辐照后)样品。两样品均由云南省药物研究所天然药物化学研究室提供,常温、密封、干燥保存。
1.2 菌株 金黄色葡萄球菌Staphylococcus aureus ATCC29213,批号:010123;大肠埃希菌Escherichia coli ATCC25922,批号:010888;白色念珠菌Candida albicans ATCC10231,批号:016783;肺炎链球菌Streprococcus neumonia ATCC49619,批号:010123,均购自美国特种生物贮藏中心。
1.3 培养基 Luria-Bertani(LB)液体培养基配制:精确称取酵母提取物5.0 g,胰蛋白胨10.0 g,氯化钠5.0 g,氢氧化钠40.0 mg,溶于纯水并用容量瓶定容至1 L,121 ℃高压灭菌30 min,冷却后备用。MUELLER-HINTON BROTH(MH)液体培养基配制:精确称取21.0 gMH粉末溶于纯水并用容量瓶定容至1 L,121 ℃高压灭菌30 min,冷却后备用。
1.4 实验动物 SPF级KM小鼠,体质量18~22 g,共156只,由北京华阜康生物科技股份有限公司提供;实验动物生产许可证号:SCXK(京)2014-0004。本单位实验动物使用许可证:SYXK(滇)K2017-0004,发证单位:昆明市科技局。实验动物经云南省药物研究所实验动物管理与使用委员会(IACUC)审查同意,动物伦理编号:动(伦)IACUC-2018-023-01。
1.5 主要仪器 JJ2000型电子天平,常熟市双杰测试仪器厂生产;SQP型电子分析天平,赛多利斯(北京)科学仪器有限公司生产;Multiskan GO型全波长酶标仪,美国Thermo公司生产;THZ-D型台式恒温振荡器,江苏太仓实验设备厂。
1.6 主要试剂 冰醋酸,西陇化工股份有限公司生产,批号:1211011;二甲苯,重庆川东化工(集团)有限公司生产,批号:20140701;阿司匹林肠溶片,拜耳医药公司生产,BJ24851;注射用美罗培南,住友制药(苏州)有限公司,批号:2160c。
2 实验方法
2.1 小鼠灌胃给药急性毒性试验 在开展小鼠急性毒性正式试验前,首先摸索紫花地丁辐照前、后样品可配制出的,且利于动物灌胃给药的最大浓度(浓度过高可能堵塞灌胃针)。用电子天平精确称取紫花地丁辐照前、后样品各10.00 g于研钵中,加入少量纯水充分研磨均匀,并将研磨后的混悬液移入量筒中;再用纯水多次洗净研钵,并将混悬液移入量筒中,最终体积约为50 mL,此时两样品的浓度为0.2 g/mL;在正式试验时,小鼠以40 mL/kg给药体积灌胃给药,则给药剂量为8 g/kg。
正式试验时,参照文献方法[6],取SPF级KM小鼠60只,随机分为空白组、紫花地丁(辐照前)24 g/kg(单次最大给药剂量为8 g/kg,给药3次)、紫花地丁(辐照后)24 g/kg剂量组(单次最大给药剂量为8 g/kg,给药3次),每组20只,雌雄各半。禁食不禁水6 h后,各组以40 mL/kg给药体积灌胃给予相应受试样品,间隔4 h给药1次,共给药3次。给药当天观察并记录动物4 h内出现的毒性反应和死亡情况;以后每天观察1次,连续14 d。主要观察动物饮食、一般状态、行为活动、排泄物等是否异常和死亡情况。在给药前、给药后第3、7和14 d对动物称重并对体质量进行统计学分析。观察14 d后结束颈椎脱臼处死动物,解剖后肉眼观察动物脏器、组织的体积、颜色、质地等有无异常。
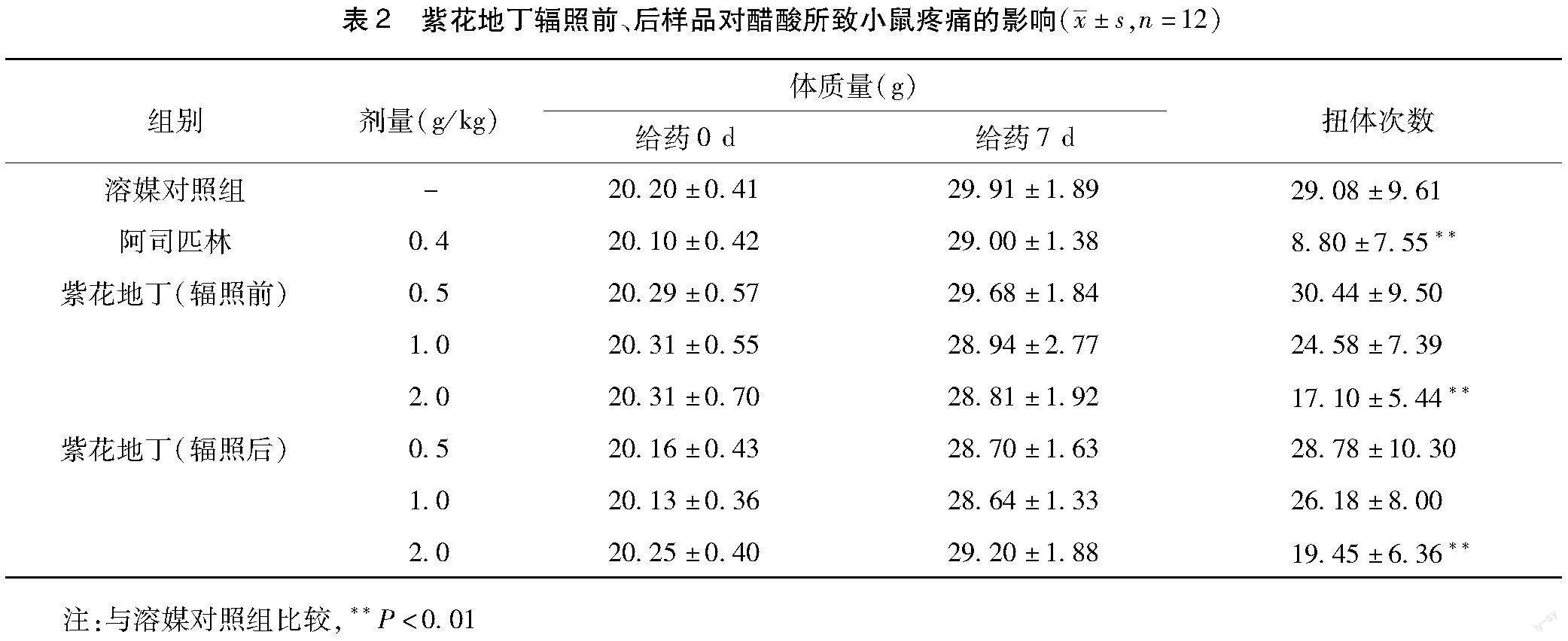
2.2 醋酸致小鼠疼痛 参照文献方法[7],取SPF级KM小鼠96只,全雄性,随机分为溶媒对照组、阿司匹林0.4 g/kg组、紫花地丁(辐照前)0.5、1.0、2.0 g/kg剂量组,紫花地丁(辐照后)0.5、1.0、2.0 g/kg剂量组,每组12只。各组小鼠均以20 mL/kg的给药体积灌胃给予相应受试物,溶媒对照组给予等体积纯水,每天一次,连续7 d,末次给药后1 h,以10 mL/kg给药体积腹腔注射0.62%冰醋酸,10 min后观察小鼠在15 min内的扭体反应次数(以小鼠出现腹部内凹、躯干与后肢伸张,臀部抬起反应为准),并对结果进行统计学分析。
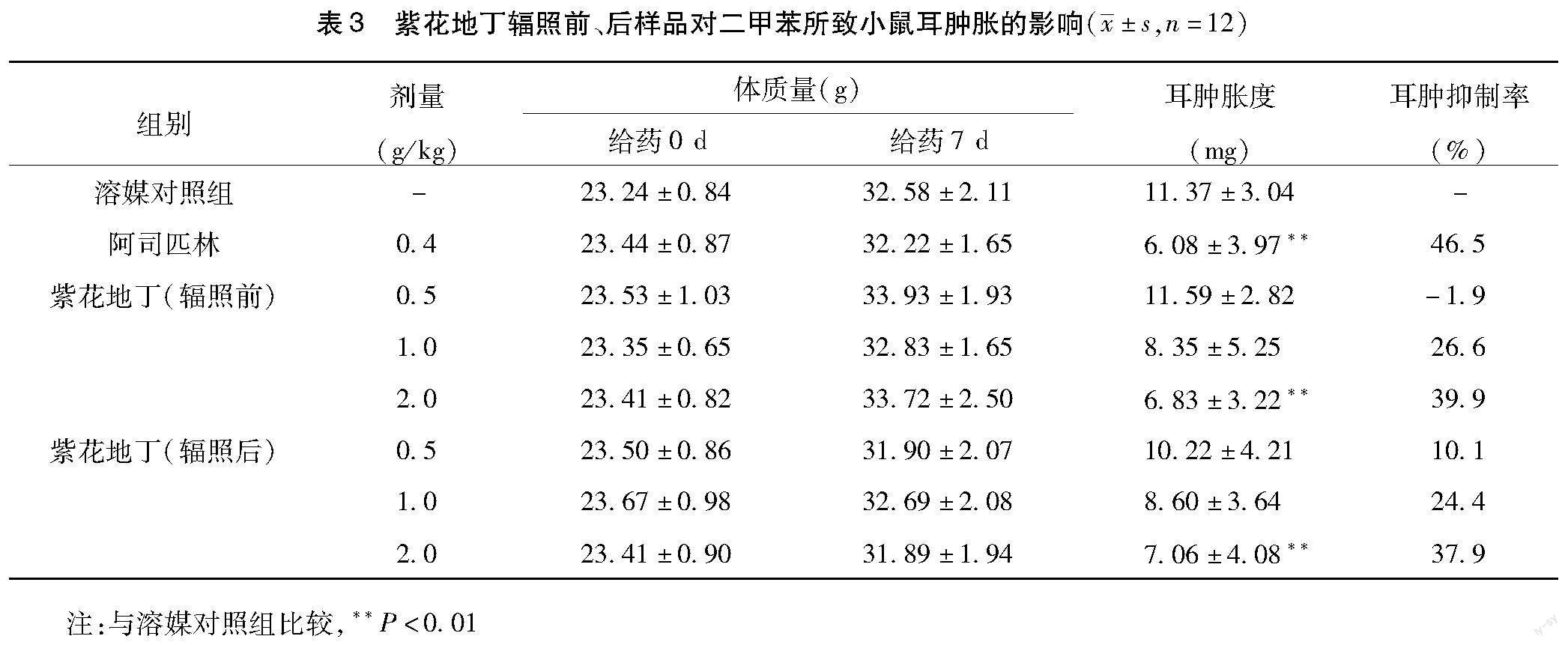
2.3 二甲苯致小鼠耳廓肿胀 参照文献方法[8-9],动物分组、剂量设定和给药频次均同2.2所述。末次给药后1 h,各组小鼠在右耳两面均匀涂抹二甲苯0.04 mL,左耳不涂抹作为对照。致炎后1 h脱颈椎处死小鼠,用眼科剪剪下小鼠双耳,直径6 mm的打孔器将双耳同部位等面积切下,称取耳片重量,以两耳片重量之差作为肿胀度,并进行统计学分析。
2.4 体外对常见病原致病菌MIC值测定 参照文献方法[10-11],分别从菌落平板上挑取金黄色葡萄球菌ATCC29213单克隆接种于MH液体培养基中,挑取大肠埃希菌ATCC25922、白色念珠菌ATCC10231、肺炎鏈球菌ATCC49619单克隆接种于LB液体培养基中,37 ℃、100 r/min振荡培养12 h;而后再分别接种于MH、LB液体培养基中,37 ℃、100 r/min振荡培养12 h。各菌活化后,将细菌浓度调整为1×105 CFU/mL,接种入96孔培养板中。第1孔内加入190 μL菌液,第2~12孔内均加入100 μL菌液。分别将受试样品或美罗培南10 μL加入第1孔中,混匀后吸取100 μL菌液加入第2孔中,依次对倍稀释,重复3次。同时,设立阳性对照、阴性对照、溶剂对照。其中,阳性对照仅加入相应浓度菌液,阴性对照直接加入培养基,溶剂对照加入相应浓度菌液和生理盐水。培养板分别置于37 ℃养箱中培养培养12 h,溶液清亮表示阴性(-),溶液混浊表示阳性(+);读出抑制细菌生长的最低样品浓度(Minimal Inhibition Concentration,MIC)即为最小抑菌浓度。
2.5 统计学方法 通过SPSS20.0统计学软件进行处理。计量资料用均数±标准差(x±s)表示,多组间比较采用方差分析,多组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
3 实验结果
3.1 小鼠急性毒性试验 溶媒对照组所有动物给予纯水后一般状况良好,均未见明显异常反应和死亡情况。小鼠灌胃给予紫花地丁辐照前、后样品后,在4 h内出现毒性反应,其中紫花地丁(辐照前)24 g/kg剂量组4只雌性小鼠和2只雄性小鼠出现腹泻症状,紫花地丁(辐照后)24 g/kg剂量组3只雌性小鼠和3只雄性小鼠出现腹泻症状,剩余动物均没有发现明显的异常反应。毒性反应在给药后第2日恢复正常。观察期14 d内,各组动物均未见明显毒性反应和死亡情况。观察期结束后处死动物大体解剖观察,各组动物组织和器官均未见明显异常。结果显示,各组小鼠在给药后均未出现死亡,结果以最大给药量表示。紫花地丁辐照前、后样品小鼠24 h急性毒性试验的最大给药量均为24 g/kg(8 g/kg/次,共灌胃3次,间隔4 h),相当于成人每日口服紫花地丁辐照前、后样品184.62 g(按体表面积折算,成人体重以60 kg计算)。观察期内动物体质量变化情况见表1。
3.2 对醋酸所致小鼠疼痛的影响 试验结果显示:与溶媒对照组比较,紫花地丁辐照前、后样品2.0 g/kg剂量组小鼠扭体反应次数明显减少(P<0.01)。与紫花地丁(辐照前)样品组比较,紫花地丁(辐照后)样品组小鼠扭体反应次数均无明显变化(P>0.05),结果见表2。
3.3 二甲苯致小鼠耳廓肿胀 试验结果显示:与溶媒对照组比较,紫花地丁辐照前、辐照后样品2.0 g/kg剂量组小鼠耳肿胀度明显减轻(P<0.01)。与紫花地丁(辐照前)样品组比较,紫花地丁(辐照后)样品组小鼠耳肿胀度均无明显变化(P>0.05),结果见表3。
3.4 对常见病原致病菌MIC值的测定 试验结果显示:紫花地丁辐照前、后样品对金黄色葡萄球菌、大肠埃希菌、白色念珠菌、肺炎链球菌均具有一定抗菌作用,且重复三次结果一致,其MIC值见表4。
4 小结
辐照灭菌技术已发展了近40年,在食品和医疗器械生产过程中广泛应用[12],但辐照灭菌对中药材化学成分、有效性和安全性所产生的影响尚不明确。由于缺乏相应的行业标准及指导原则,辐照灭菌过程中存在超剂量辐照、重复辐照等问题,严重影响了药品的质量。已经出现擅自改变产品灭菌工艺,而被CFDA收回药品GMP证书的事件[13]。为解决这一问题,CFDA于2015年发布《中药辐照灭菌技术指导原则》,其中明确提出,辐照灭菌应遵循“必要、科学、合理”的原则。任何单位或药企采用辐照技术对中药进行灭菌,必须通过研究来证明辐照灭菌对产品质量、稳定性和生物学性质没有影响,必要时采用与适应证相关的药效指标,详细阐述其必要性、科学性和合理性;对于含有不稳定或有毒成分的中药,更需进行针对性研究,关注其灭菌前后的变化情况,以保证药品安全有效[14]。
基于上述规定,本研究结合紫花地丁的现代药理学活性,对比了辐照前后紫花地丁样品在初步安全性和镇痛、抗炎、抗菌方面的活性。其中,急性毒性试验结果表明,20 kGy辐照剂量照射紫花地丁后,样品对小鼠的急性毒性未发生重大改变。有效性研究结果显示:辐照前后紫花地丁均可明显抑制醋酸所致小鼠扭体反应和二甲苯所致小鼠耳肿,均表现出明显的镇痛抗炎活性;且辐照前后紫花地丁对4株常见菌株具有一定的抑制作用,辐照后紫花地丁的药效学活性无显著改变。综上所述,在此辐照剂量对紫花地丁的安全性和有效性均无明显改变,初步表明辐照灭菌法可用于该药材的灭菌。
辐照灭菌对中药材化学成分、有效性和安全性所產生的影响尚不明确,本实验结果表明,紫花地丁辐照灭菌后,在有效性和安全性方面与辐照前没有发生改变,因此在紫花地丁生产过程中,可用辐照灭菌法进行灭菌处理,而辐照灭菌对其化学成分有无影响,还需要进一步研究。
参考文献:
[1]宋妍.紫花地丁药理作用的研究现状[J].CJCM中医临床研究,2017,9(12):136-137.
[2]林彤,毕福钧,吕渭升,等.中药的辐照灭菌现状与监管[J].中国药学杂志,2019,54(17):1443-1447.
[3]张世才,李奉勤,史冬霞,等.辐照灭菌在中药方面的应用研究进展[J].中国药业,2009,18(9):76-77.
[4]国家药典委员会.中华人民共和国药典.一部[M].北京:中国医药科技出版社,2015:337-338.
[5]陈蔚文,高学敏.中药学[M].北京:人民卫生出版社,2012:93.
[6]陶荣品,姚文慧,丁选胜.淫羊藿苷不同给药途径对小鼠的急性毒性试验研究[J].现代中药研究与实践,2022,1(36):22-25.
[7]费逸明,龚纯贵.白英提取物镇痛抗炎作用研究[J].药学实践杂志,2009,27(2):111-114.
[8]李艳丽,胡彦武.紫花地丁水提物急性毒性试验及其抗炎镇痛作用研究[J].湖北农业科学,2013,52(2):390-392.
[9]陈胡兰,汤沛然,陈兴,等.紫花地丁抗炎及体外抑菌作用活性部位筛选研究[J].成都中医药大学学报,2008,31(2):52-54.
[10]Li B,Yao Q,Pan XC,et al.Artesunate enhances the an-tibacterial effect of beta-lactam antibiotics against es-cherichia coli by increasing antibiotic accumulation via inhibition of the multidrug efflux pump system[J].AcrAB-tolc.J Antimicrob Chemother,2011,66(4):769-777.
[11]孙艺方,杜利利,周乐,等.紫花地丁抗菌活性成分研究[J].中国中药杂志,2011,36(19):2666-2671.
[12]耿建暖.食品辐照技术及其在食品中的应用[J].江苏调味副食品,2013,133(2):29-32.
[13]段国华,梅星红,徐卫国.GMP飞行检查案例分析与思考[J].机电信息,2016,482(20):1-8.
[14]白洁,迟玉明,金红宇,等.《中药辐照灭菌技术指导原则》解读[J].中成药,2017,39(7):1537-1538.

