2022 年新疆地区五种疫情防控医疗器械质量风险的监测抽检情况
赵微,热孜宛古丽·伊敏,古丽巴哈尔·托乎提,孙鹏(通信作者)
新疆维吾尔自治区药品检验研究院 (新疆 乌鲁木齐 830000)
近年来,医疗器械质量安全的重要性日益凸显,特别是疫情防控期间,医疗器械极大地降低了使用者的感染风险。因此,确保此类医疗器械的质量安全十分重要[1]。新疆地区药品监管部门高度重视疫情防控医疗器械的质量安全,为及时排查产品质量安全风险,客观评价全区疫情防控医疗器械质量状况,全力服务疫情防控大局,结合辖区实际,于2022 年开展了疫情防控医疗器械风险监测抽检工作,现对此次抽检情况分析如下。
1 抽样情况
1.1 各地(州、市)局抽样情况
此次共抽检疫情防控医疗器械82 批次,包括一次性使用医用口罩3 批次、医用外科口罩18 批次、医用防护口罩20 批次、医用一次性防护服16 批次、一次性病毒采样管25批次,抽样覆盖新疆全地区14个地州市。
1.2 抽样品种情况
此次抽检的样品主要为无源、二类医疗器械,具体品种概述[2]见表1。

表1 2022 年新疆地区风险监测抽检疫情防控医疗器械品种概述
2 检测分析
2.1 检测方案及判定原则
此次抽检的一次性使用医用口罩按照YY/T 0969-2013《一次性使用医用口罩》[3]对其外观、结构与尺寸、鼻夹、口罩带、细菌过滤效率、通气阻力、微生物指标及环氧乙烷残留量进行检测。医用外科口罩按照YY 0469-2011《医用外科口罩》[4]对其外观、鼻夹、口罩带、细菌过滤效率、颗粒过滤效率、压力差Δp、微生物指标、环氧乙烷残留量进行检测。医用防护口罩按照GB 19083-2010《医用防护口罩技术要求》[5]对其口罩基本要求、口罩带、过滤效率、气流阻力、微生物指标、环氧乙烷残留量进行检测。医用一次性防护服按照GB 19082-2009《医用一次性防护服技术要求》[6]对其外观、结构、抗渗水性、抗合成血液穿透性、断裂强力、过滤效率、微生物指标、环氧乙烷残留量进行检测[7-13]。一次性病毒采样管按照注册产品标准或产品技术要求对其外观、尺寸、保存液装量、泄漏(密封性)及保存液pH 值进行检测[14]。
以上检测项目中若任意项不合格则抽检综合结果为不合格,适用的检测项目以注册产品标准或产品技术要求中的规定为判定依据。
2.2 检测结果
此次抽检合格78 批次,合格率为95.12%,检出不合格4 批次,不合格率为4.88%。此外,检测过程中发现2 批存在潜在风险的产品,1 批为医用一次性防护服,另1 批为医用防护口罩。检测结果见表2。
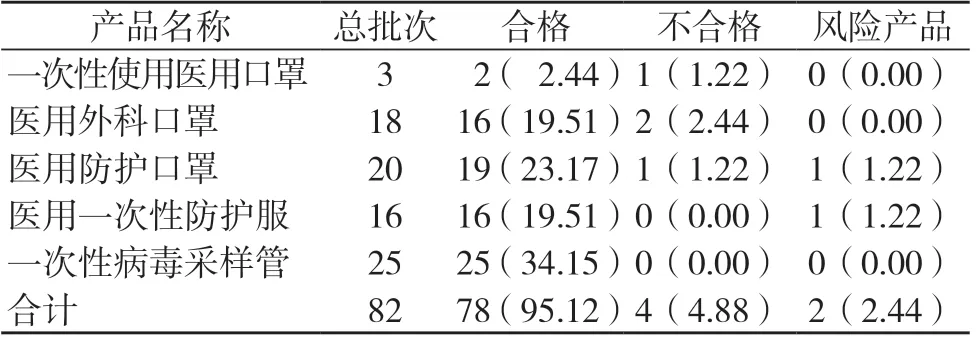
表2 2022 年新疆地区风险监测抽检疫情防控医疗器械检测结果[批次(%)]
2.3 不合格产品检测结果
此次抽检检出的不合格品种分别为一次性使用医用口罩、医用外科口罩及医用防护口罩,其中1 批为口罩带和压力差Δp均不合格,2 批为口罩带不合格,1 批为颗粒过滤效率不合格。不合格产品的检测结果见表3。
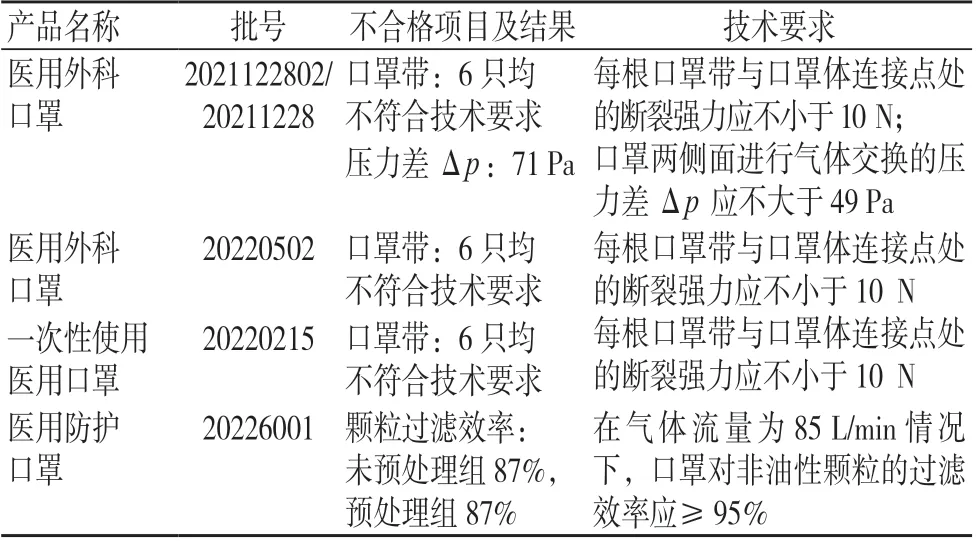
表3 2022 年新疆地区风险监测抽检疫情防控医疗器械不合格产品检测结果
3 结果分析
3.1 不合格项目分析
3.1.1 口罩带
口罩带不合格的原因可能与生产企业口罩带选择不当或口罩带焊接工艺存在问题有关。生产企业未严格控制生产环节质量要求和人员操作水平,存在口罩带漏点焊、脱落,或点焊长度不足、力度不均匀、位置靠近边缘等问题[15]。
口罩带不合格可能造成的危害:口罩带是保证口罩能够正常佩戴的基本部件,如果口罩带与口罩体连接牢固度不合格,会发生佩戴过程中口罩带断裂或脱离口罩体的情况,口罩带断裂与鼻夹不合格均会导致整个产品无法使用,即使口罩本体性能合格,也无法发挥任何防护作用,甚至可能导致佩戴者因暴露于致病性病原微生物环境中而发生感染。
3.1.2 压力差Δp
压力差Δp不合格的原因可能与生产企业未能严格把关熔喷布质量、中间层滤料(熔喷布)选择不当有关。
压力差Δp可能造成的危害:压力差Δp不合格会增大佩戴者的呼吸阻力,降低佩戴舒适性,不利于长期佩戴,甚至可能导致佩戴者出现缺氧,影响人体健康。
3.1.3 颗粒过滤效率
口罩由外至内一般由无纺布、熔喷布、无纺布组成。熔喷布俗称口罩的“心脏”。其作为口罩中间的关键过滤层,直接决定口罩的颗粒过滤效率性能,具备良好的过滤性、屏蔽性、绝热性和吸油性。
医用防护口罩要求使用高效低阻的驻极熔喷布,一般采用N95 级别熔喷布,对直径0.3 μm 颗粒的过滤效率达到95%以上,克重约50 g[16-17]。颗粒过滤效率不合格的原因可能与生产企业选择口罩滤材(熔喷布)不当,质量不佳,进而影响医用防护口罩的防护效果。
颗粒过滤效率不合格可能造成的危害如下:颗粒过滤效率主要考核医用防护口罩滤除颗粒物的能力,此项不合格可能导致口罩无法有效过滤空气中的悬浮颗粒物(如细菌、病毒、粉尘等),极大地增加了使用者患病或感染的风险。
3.2 风险提示
3.2.1 医用防护口罩
此次抽检发现1 批医用防护口罩与我实验室2022 年6 月出具“新疆地区医疗器械监督抽检”检测任务时的同企业医用防护口罩的包装“商标”不一致。
我实验室根据检测方案对该2 批次医用防护口罩的口罩基本要求、口罩带、过滤效率、气流阻力、环氧乙烷残留量及无菌项目进行检测,结果均符合GB 19083-2010《医用防护口罩技术要求》[5]的要求。但标示为同一生产企业的两种包装“商标”不一致,提示该批次产品存在较大的法律安全风险。
3.2.2 医用一次性防护服
此次抽检发现1 批样品注册证编号编排方式与《医疗器械注册管理办法》中第七十六条的规定不一致,通过国家药品监督管理局数据查询平台及其他搜索工具查询后发现如下问题:该批医用一次性防护服包装标示产品注册证编号与国家药品监督管理局数据查询平台显示编号的注册证注册人不一致,且产品名称为“一次性使用手术衣”,并非“医用一次性防护服”,提示该批次产品资质存在问题;此外,在国家药品监督管理局数据查询平台输入该防护服生产厂家,未显示有与该公司相关的医疗器械注册证和生产许可证,提示该批次防护服生产企业的生产资质存在问题。
3.2.3 一次性使用病毒采样管
此次抽检发现不同企业制定的一次性使用病毒采样管产品的技术要求存在较大差异,部分企业产品技术要求中的检测项目较少,有的企业对产品外观、尺寸、连接牢固度、断点强力、吸水性、旋转摩擦度、微生物指标等性能制定了标准,有的企业仅对其中1、2 项性能制定了标准。同类产品在不同企业间会因产品技术要求不同,导致检测结果不能准确判定产品质量,存在较大的质量安全风险,应引起关注。
此次抽检共检测25 批次一次性使用病毒采样管,其中14 批次的产品技术要求未制定pH 值标准,而pH 值有关样本保存的有效性需引起厂家的重视。目前,一次性使用病毒采样管尚无国家或行业标准,检测依据均为厂家的产品技术要求,若技术要求存在缺陷则会影响监管部门对生产企业的监督管理,从而导致存在技术缺陷的产品流入市场,存在较大的质量安全风险。
此次抽检对上述14 批次一次性使用病毒采样管进行pH 值检测,并汇总其余11 批次产品的pH 值进行分析,发现多数产品的pH 值为6.5~8.5,仅有1 批产品pH 值为4.7。一次性使用病毒采样管的样品信息及pH 值见表4。
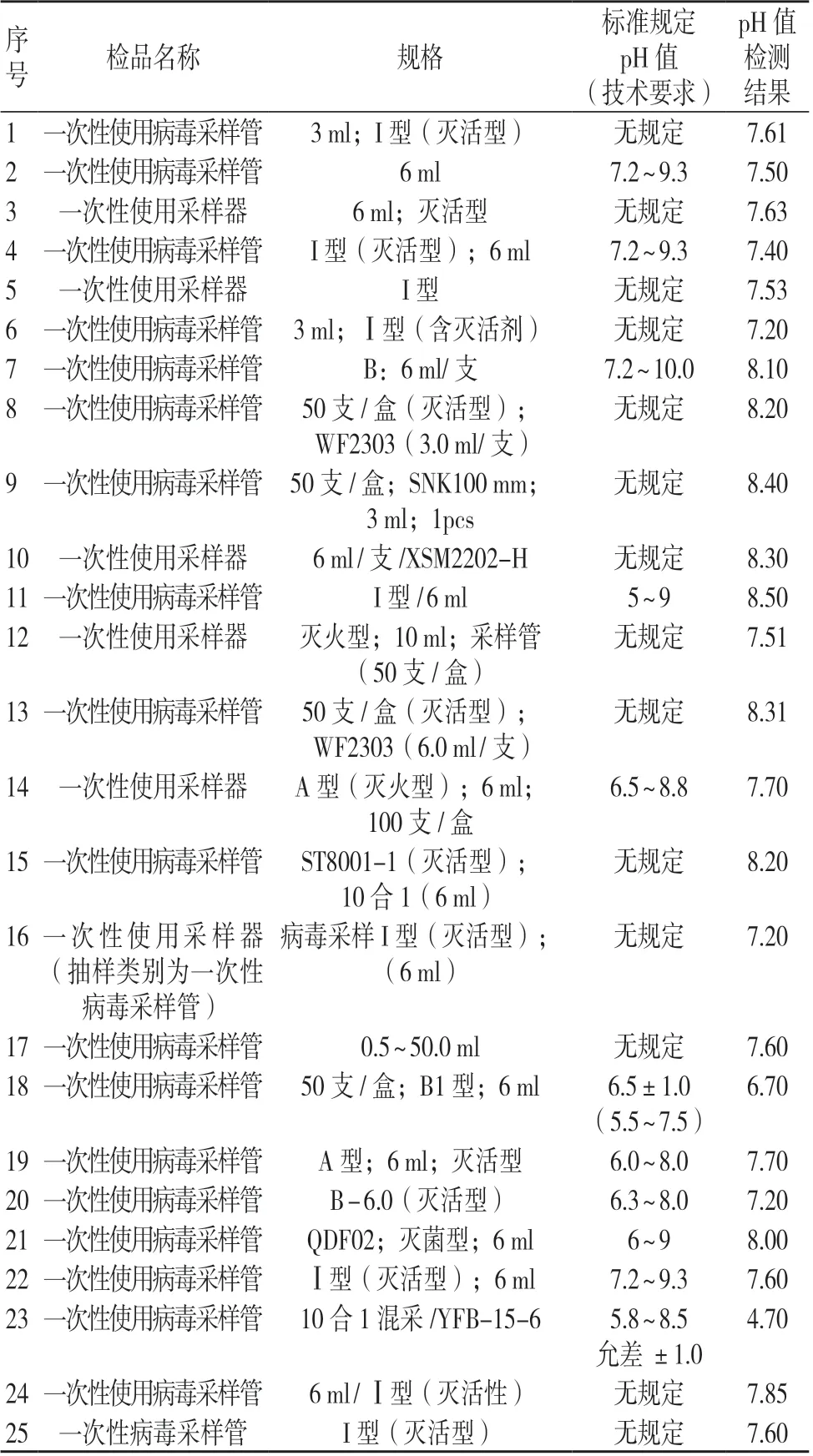
表4 2022 年新疆地区风险监测抽检一次性使用病毒采样管样品信息及pH 值检测结果
4 建议
基于抽检不合格产品情况及发现的问题,提出以下建议。
建议监管部门加大对疫情防控医疗器械生产环节的监督力度。对医疗器械生产企业的监督是整个医疗器械质量安全监督过程的重中之重,当前监管部门对生产企业资质的审评查验程序已非常严格且成熟,但由于生产企业数量众多,分布广泛,较难实现对出厂产品质量把控做到100%监督,因此建议监管部门对生产企业定期进行突击现场检查,重点关注是否存在违法违规生产,核验产品注册证效期,检查企业生产管理体系,以及文件体系是否存在疏漏。
建议监管部门加大对疫情防控用医疗器械流通环节和使用环节的监督力度。经营企业是药店的主要供货商,而药店又是多数人民群众购买医疗器械的途径。建议监管部门应找准源头,精准监督,根据区内经营企业数量和经营范围,数字化科学制定详细抽检计划,尽可能实现在短期内全覆盖。另外,随着网络购物的普遍性,应加强对网络销售环节的监督,核验网络销售资质,监督网络销售产品质量。除流通环节外,使用环节也尤其重要,应重视对医院、社区卫生服务中心的监督,不仅掌握医疗器械使用情况,也应向使用单位提出警示,重视采购环节产品资质的查验。
建议生产企业严格落实主体责任。生产企业应严格按照生产工艺和技术要求组织生产,保证质量管理体系有效运行;严把原材料质量关,加强生产全过程质量管控,加强产品出厂检测,确保疫情防控医疗器械安全有效。
建议经营企业和使用单位严格执行进货查验制度。认真查验供货企业资质、产品出厂报告、产品注册证、产品注册报告等,认真核对产品标示标识、生产日期及有效期,确保从具有资质的医疗器械生产、经营企业合法合规采购合格医疗器械产品。
建议一次性使用病毒采样管生产企业根据实际情况修订技术要求,完善技术要求条款,将pH 值纳入产品技术要求,提高产品质量。
最后,医疗器械产品质量安全越来越受到全社会的重视,但市场上产品种类繁多,监管部门精力和资源有限,可通过提供平台供消费者学习医疗器械产品质量安全知识,提高人民群众的风险意识、辨识能力。

