基于肠道菌群分析探讨黄芪多糖调节高脂饮食小鼠血糖的可能机制
苑红, 张俊锋, 扈瑞平, 李丽, 霍达, 刘昊泽, 薛慧婷, 任贵强
(1.内蒙古医科大学基础医学院, 呼和浩特 010110; 2.内蒙古医科大学护理学院, 呼和浩特 010059)
随着人们生活水平的改善,饮食结构和生活方式发生了变化,户外活动越来越少,且逐渐以高脂饮食为主。高脂饮食的结果会出现肥胖,且常为2型糖尿病、脂肪肝、高血压及心血管等疾病的发病诱因[1-2]。高脂饮食常伴随高血脂、高血糖等代谢紊乱。其中高脂饮食后常伴随血糖升高,进而诱发2型糖尿病,研究认为空腹血糖(fasting blood glucose,FBG)浓度可作为糖尿病的一个重要的预测指标,有研究表明血糖浓度每增加1 mg/dL,糖尿病的发生风险比原来高1.154倍[3]。所以关于高脂饮食诱发机体血糖水平升高的现象已备受关注。但其机制尚未清楚,其预防和治疗手段也不很理想。
人类的肠道中存在大量的微生物,包括细菌、病毒和古生菌[4]。目前认为,人类的消化道中有1 000余种共生的肠道微生物[5],它们的主要功能包括调节人体代谢、免疫反应等[6-7]。同时,这些微生物也影响包括炎症介质在内的基因表达[8],如细胞因子、脂多糖和神经活性代谢物。因此,肠道菌群又被认为是肝脏以外的又一重要的“微生物器官”或与宿主形成“共生体”[9-10]。此外,肠道细菌可以降解多种外源性物质,包括卤代芳香化合物,这可能对人体健康有益[11]。研究表明,不同饮食或药物作用后常伴随明显的肠道菌群变化,因此,调节肠道菌群已经被认为是防治高血压、糖尿病等代谢紊乱性疾病的重要干预靶标[12]。
黄芪为豆科植物蒙古黄芪的干燥根,黄芪多糖(astragalus polysaccharides, APS)是黄芪的主要生物活性成分之一,具有抗炎、抗氧化、免疫调节、降血糖、神经保护等多种生物活性[13]。研究发现,APS可以使高脂饮食或糖尿病模型小鼠的糖代谢紊乱及胰岛素的敏感性得到改善[14-15],并降低高脂饮食小鼠的体重[16],调节肠道菌群结构[17]以及影响放射性皮炎小鼠炎性因子表达[18]。但是,到目前为止,APS是否可能通过调节肠道微生物而改善高血糖或影响高血糖小鼠炎性因子水平仍不清楚。现从肠道菌群调节的角度,探讨 APS 对高血糖小鼠血糖调节及炎性因子水平的影响。
1 材料与方法
1.1 一般材料
黄芪多糖(纯度70%)购于罗恩公司。小鼠肿瘤细胞坏死因子-α(TNF-α)ELISA试剂盒、小鼠白细胞介素6(IL-6)ELISA试剂盒、胰岛素ELISA试剂盒,均为酶联免疫品牌试剂盒;30 只8周龄C57BL/6J雄性小鼠,购自北京斯贝福生物技术有限公司。酶标仪采用Thermo 公司(Multiskan FC)产品。
1.2 实验动物及分组
8周龄C57雄性小鼠30只,适应性喂养后随机分为3组,分别为对照组(C)、模型组(M)、黄芪多糖组(D),每组10只小鼠。C组喂以正常普通饲料及饮用水,M组喂以高脂饲料和饮用水,D组喂以高脂饲料和20 g/L黄芪多糖溶液。连续喂养11周后收集样本。
1.3 样本收集和处理
将小鼠禁食水12~14 h后,收集粪便于灭菌的离心管中用于高通量测序。采用断头法将血液收集于灭菌的离心管中,静置30 min,4 ℃、3 000 r/min离心15 min,分离得血清,-80 ℃保存备用,用于血糖浓度和炎性因子水平测定,其中血糖浓度采用比色法测定,空腹胰岛素浓度及炎性因子水平采用ELISA法测定。
1.4 肠道菌群分析
取约100 mg盲肠内容物,采用CTAB/SDS方法提取细菌总基因组DNA。并对提取的DNA样本质检,合格的样本用于后续的分析,选取特定的引物:16S V4:515F-806R,18S V4: 528F-706R,18S V9:1380F-1510R扩增16S rRNA/18S rRNA/ITS的16S V4/16S V3/16S V3-V4/16S V4-V5,18S V4/18S V9,ITS1/ITS2,Arc V4不同区域。
1.5 统计学方法
通过 SPSS 19 统计软件进行数据分析,实验结果以 “均值±标准差”表示,用Bonferroni法进行方差分析,分析组间差异,认为P<0.05为差异有统计学意义。高通量测序结果采用 OTUs 聚类分析法,进行物种注释及丰度分析。
2 结果分析
2.1 APS改善高脂饮食小鼠的空腹血糖和空腹胰岛素水平
C57雄性小鼠经过11周高脂饮食,检测各组小鼠空腹血糖、空腹胰岛素水平,观察APS对高脂饮食小鼠糖代谢的影响。结果显示:M组小鼠空腹血糖水平显著高于C组(P<0.001),而D组小鼠在高脂饮食同时喂以20 g/mL APS溶液后空腹血糖水平较M组显著下降(P<0.05)(图1)。空腹胰岛素水平的变化趋势与空腹血糖一致,M组小鼠在高脂饮食后空腹血糖水平显著升高(P<0.05),而在服用APS的高脂饮食小鼠却又显著下降(P<0.05)(图2)。该结果说明,高脂饮食能够显著地升高小鼠空腹血糖和空腹胰岛素水平,而APS又可以明显改善高脂饮食引起的空腹血糖和空腹胰岛素水平显著升高的趋势。
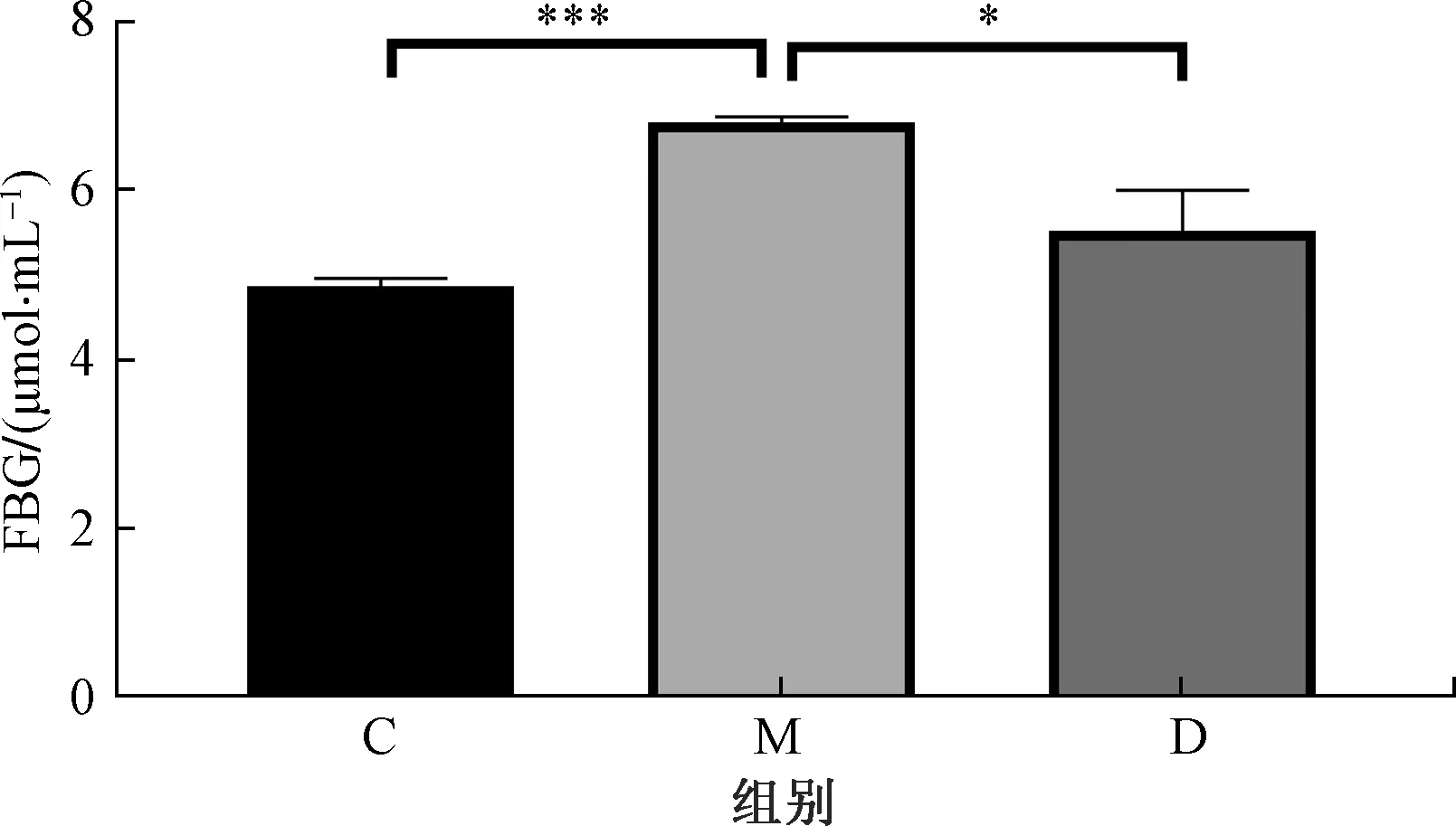
C为对照组,正常饮食+饮用水;M为模型组,高脂饮食+饮用水;D为高脂饮食+20 g/mL APS;***为P<0.001;*为P<0.05图1 APS对高脂饮食小鼠的空腹血糖的影响Fig.1 Effect of APS on fasting blood glucose in high-fat diet mice
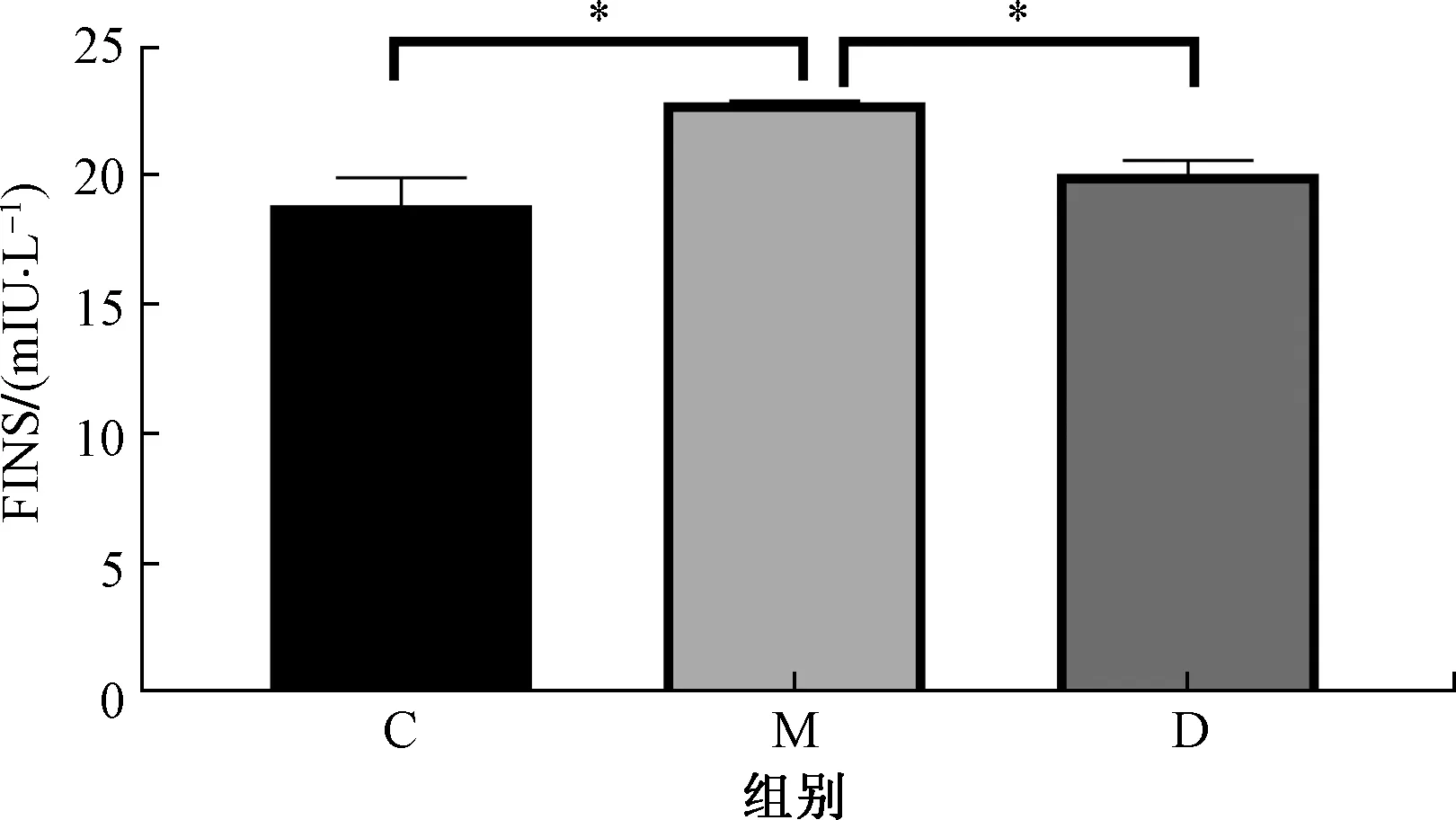
C为对照组,正常饮食+饮用水;M为模型组,高脂饮食+饮用水;D为高脂饮食+20 g/mL APS;*为P<0.05图2 APS对高脂饮食小鼠的空腹胰岛素水平的影响Fig.2 Effects of APS on fasting insulin levels in high-fat diet mice
2.2 APS可改善高脂饮食小鼠的血清炎性因子TNF-α、IL-6水平
为了进一步探讨APS是否可以影响高脂饮食小鼠血清炎性因子水平,检测了各组小鼠血清中TNF-α和IL-6水平,结果如图3所示。结果显示,小鼠血清炎性因子TNF-α和IL-6水平经11周高脂饮食后,M组均明显高于C组(IL-6:P<0.01,TNF-α:没有显著性),而D组小鼠在高脂饮食同时喂以20 g/mL APS溶液时,TNF-α和IL-6水平较M组有明显下降趋势,但没有统计学意义。该结果表明,高脂饮食可以明显升高血清中炎性因子TNF-α和IL-6水平,而APS又可以改善高脂饮食引起的这些因子的高表达。
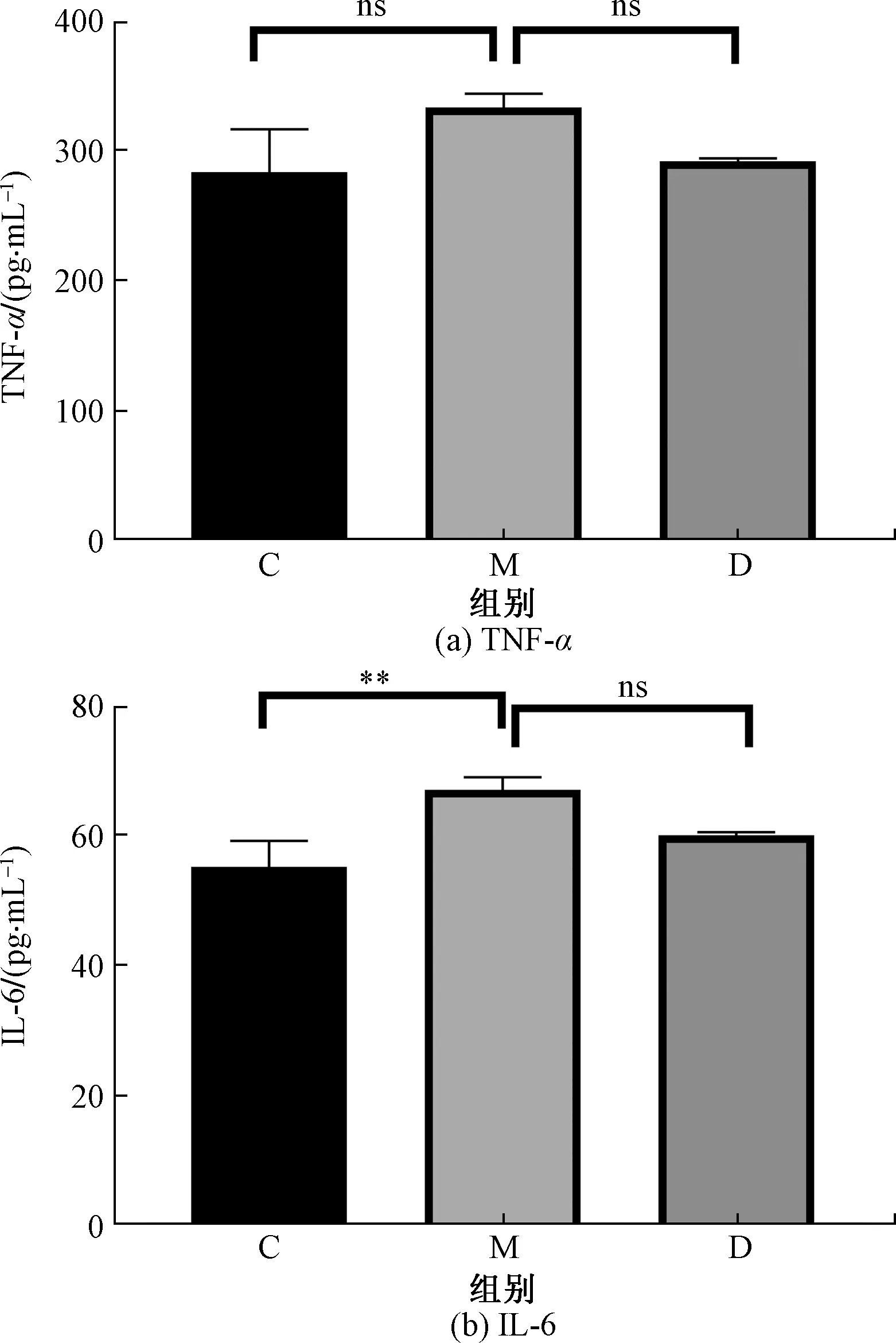
C为对照组,正常饮食+饮用水;M为模型组,高脂饮食+饮用水;D为高脂饮食+20 g/mL APS;**为p<0.01;ns为没有统计学意义图3 APS对高脂饮食小鼠血清中TNF-α和IL-6水平的影响Fig.3 Effect of APS on serum neutralization of TNF-α and IL-6 in mice with high fat diet
2.3 APS可以改善高脂饮食小鼠肠道菌群的结构
为了明确APS改善血糖及炎性因子水平与改变肠道菌群的关系,利用基于16S rDNA序列测定的元基因组学方法,分析了C组、M组和D组肠道菌群差异。在纲水平上,比较了各组肠道菌群的组成(图4),在C组中,拟杆菌纲(Bacteroidetes,拟杆菌门)约占所有细菌丰度的41.7%,芽孢杆菌纲(Bacilli,厚壁菌门)约占所有细菌丰度的15%和梭菌纲(Colstridia,厚壁菌门)约占所有细菌丰度的25%。与C组比较,M组中拟杆菌纲显著下降(P<0.05),约占所有细菌丰度的13.3%;芽孢杆菌纲也出现一定程度下降(无统计学意义),约占所有细菌丰度的18.3%;梭菌纲显著升高(P<0.05),约占所有细菌丰度的25%。与M组相比,D组拟杆菌纲略有升高(无统计学意义)约占15%,芽孢杆菌纲也出现明显升高(无统计学意义)约占38.3%,而梭菌纲也明显下降,但不具有统计学意义。由此可见,小鼠肠道菌群结构在高脂饮食后变化明显,而APS则使高脂饮食所致的肠道菌的变化得到明显改善。在属和纲水平上还利用热图分析了相对丰度较大的35个细菌OUTs(图5),结果发现高脂饮食确实能够显著地改变部分OUTs的相对丰度,而APS则又能够全部或部分地恢复了高脂饮食引起一些菌群的变化。因此,APS确实可以改善高脂饮食所致的肠道菌群的变化。同时,在高脂饮食时小鼠的血糖水平也出现明显升高的现象,而在服用APS时,又可以明显降低小鼠血糖水平。因此,推测APS在逆转高脂饮食小鼠高血糖的现象可能是由APS改善小鼠肠道菌群结构而发挥作用的。
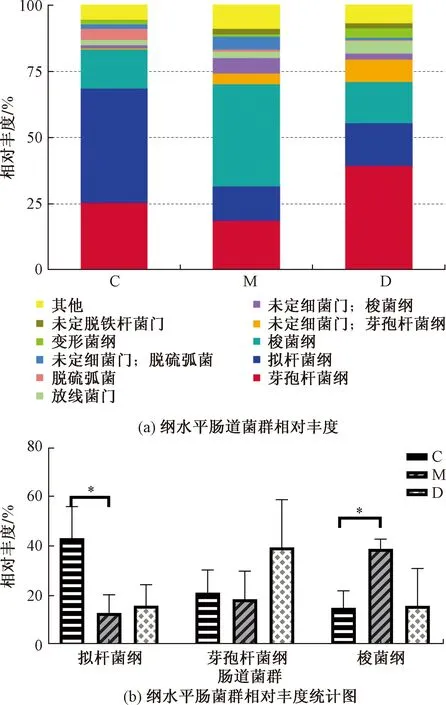
图4 纲水平肠菌群相对丰度对比Fig.4 Comparison of relative abundance of intestinal flora at class level
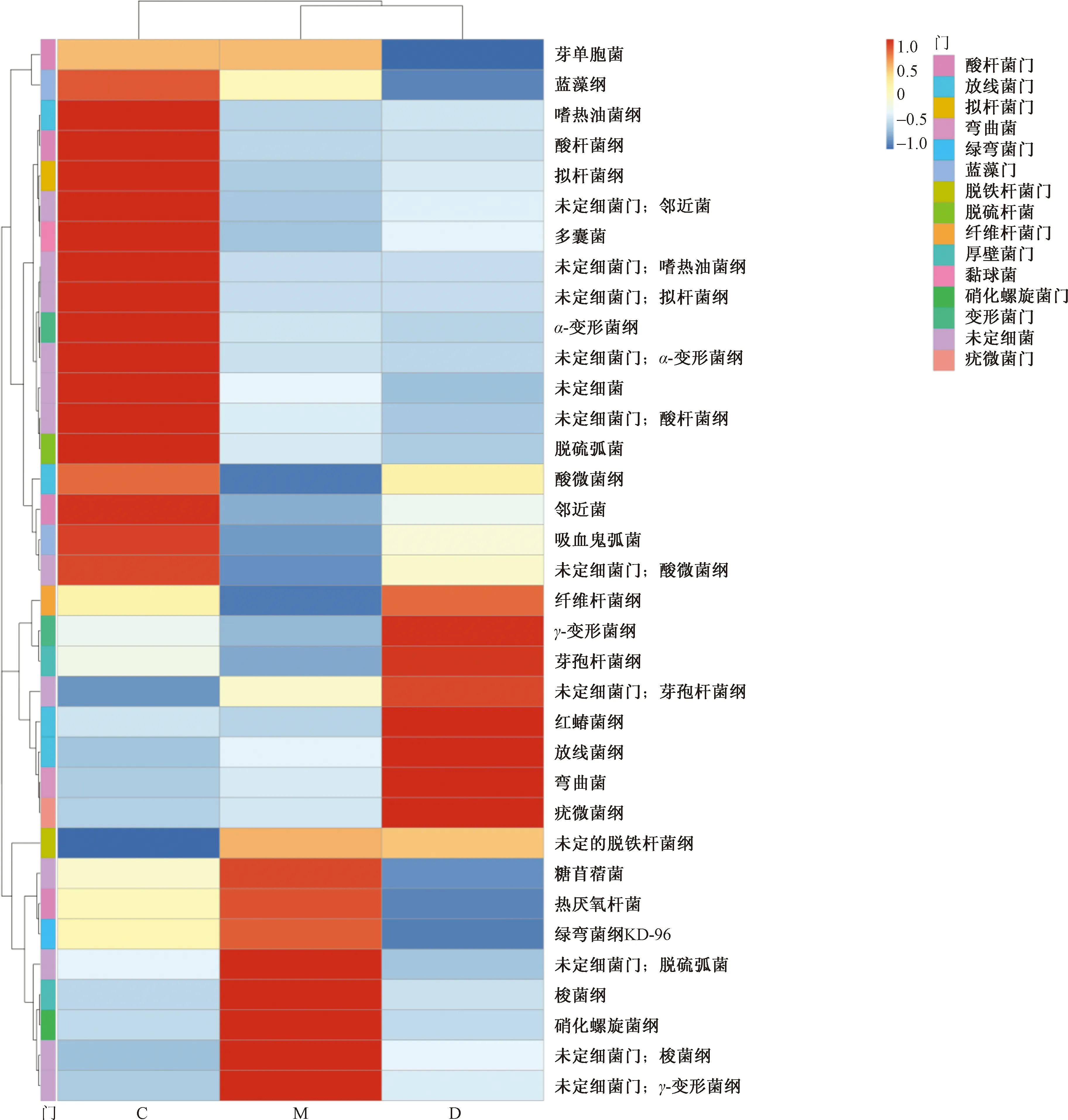
图5 纲水平上前35个OUT相对丰度的热图Fig.5 Heat map of the relative abundance of the top 35 OUTs at the horizontal level
2.4 APS引起肠道菌群的变化主要调节糖代谢通路
在对APS所致肠道菌群变化进行功能预测各代谢途径的KEGG分析(图6)中发现,APS引起差异表达的菌群在糖代谢通路富集最显著。这也与检测结果一致,APS参与改善高脂饮食引起的小鼠血糖浓度的调节。
3 讨论
APS是黄芪的主要生物活性成分之一,具有抗炎、抗氧化、免疫调节、降血糖、神经保护等多种生物活性。本研究表明,高脂饮食能够使小鼠的空腹血糖和空腹胰岛素水平显著升高,而APS可以显著降低高脂饮食所引起的空腹高血糖和空腹高胰岛素水平,也能够改善炎性因子IL-6和TNF-α的表达水平;同时,研究不仅发现APS能改善高脂饮食小鼠的肠道菌群结构,而且在高通量检测分析中对APS引起肠道菌群结构变化的功能预测时也发现APS引起差异表达的菌群在糖代谢通路上富集最显著。这些结果说明APS的降糖作用可能是通过改变小鼠的肠道菌群而实现的。
关于对糖代谢的研究中发现APS具有双向调节血糖的作用[19]。具体表现为APS对血糖正常的小鼠没有明显影响,但可以显著降低小鼠葡萄糖负荷后的血糖水平,也能有效对抗肾上腺素引起小鼠血糖升高的反应和苯乙双胍致小鼠实验性低血糖,而对胰岛素性低血糖没有明显影响[20]。廖苇萍等[21]也研究发现在高脂饲料中添加1 g/kg黄芪多糖可以显著降低小鼠血糖。对3T3-L1脂细胞的研究时发现1 g/mL的APS可以使葡萄糖转运率增加2.62倍[22]。研究中高脂饮食的小鼠服用20 g/L的APS具有显著的降低血糖和降低胰岛素的作用。
越来越多证据表明,肠道菌群的变化与宿主的肥胖、糖尿病、高血压等慢性疾病高度相关。研究表明,肥胖的形成常伴随明显的肠道菌群失衡,尤其是在肠道中占有主要比例的厚壁门与拟杆菌门细菌的比例失调[23]。当厚壁菌门和拟杆菌门等正常菌群降低时,可以降低肠道菌群对碳水、脂质等营养物质的代谢利用率。如C57小鼠连续7~14 d服用复合益生元将肠道菌群恢复为正常状态,结果发现肥胖者血糖显著下降,同时空腹胰岛素水平也显著下降。为进一步研究肠道菌群对小鼠糖代谢的影响,使C57小鼠连续4周每天口服1 mL的复合抗生素溶液导致其肠道微生态紊乱,结果发现肠道菌群中厚壁菌门和拟杆菌门等正常菌群的相对丰度降低,同时发现小鼠口服葡萄糖耐量曲线变化趋势有所偏离[24]。在将遗传性肥胖小鼠和同代的瘦小鼠的肠道菌群分别接种到无菌小鼠肠道内的研究中发现,在相同的进食量下,接种肥胖小鼠菌群的小鼠体脂显著高于接种瘦小鼠菌群的小鼠,这说明肥胖与肠道菌群具有相关性[24]。在研究葛根山药胶囊(含有黄芪)作为辅助降糖药时发现空腹血糖水平与乳酸杆菌属相对丰度呈现负相关性,空腹血糖水平越高,乳酸杆菌相对丰度则越低;空腹血糖水平与支原体菌属、链球菌属、大肠志贺菌属的相对丰度呈现正相关性[25]。因此推测高脂饮食可能首先引起小鼠肠道菌群的变化,进而影响小鼠糖代谢,使小鼠血糖水平明显升高。研究中也得到了相似的结果,高脂饮食组小鼠通过高脂饮食后肠道菌群结构发生明显改变,同时也发现小鼠的血糖、胰岛素水平明显升高。另外,在高脂饮食同时饮用APS发现,APS可以改善小鼠高脂饮食引起的肠道菌群变化,同时也逆转了由高脂饮食引起血糖、胰岛素水平升高的现象。
刘艳秋等[26]在研究血清炎性因子与空腹血糖水平是否有相关性时发现,糖尿病前期组和2型糖尿病组IL-6水平较正常组明显升高,且IL-6与空腹血糖水平呈正相关。在研究老年痴呆患者糖代谢时发现,空腹血糖水平与炎性因子 IL-6和TNF-α具有正相关性,空腹血糖升高时,血清中IL-6和TNF-α水平也明显升高[27]。也有研究发现厌氧菌与需氧菌比值与血清中IL-6和TNF-α呈显著负相关性[28],而且IL-6会随患者菌群差异程度的升高而升高[29]。目前也有专家发现IL-6是具有肠道屏障功能障碍的关键分子[30]。在研究中也发现高脂饮食小鼠肠道菌群结构发生变化时血清中IL-6和TNF-α水平明显升高,而通过服用APS后小鼠肠道菌群结构发生逆转,此时小鼠IL-6和TNF-α水平有一定程度恢复。
4 结论
推测APS可以降低高脂饮食小鼠的血糖可能是通过改善小鼠肠道菌群结构和调节血清中炎性因子IL-6和TNF-α水平而实现的。

