益肾化湿颗粒在糖尿病肾病患者sirt1通路的影响
彭 珊 刘维萍 邵 雪 张隆业 郭永力 管仁苹 张彦芬 刘海荣 孙建丽 苏 娜 魏 鹍
(秦皇岛市第一医院,河北 秦皇岛,066000)
糖尿病肾病是糖尿病患者中常见的慢性微血管并发症,约有40%的糖尿病患者合并糖尿病肾病,临床上以白蛋白尿持续性升高和(或)肾小球滤过率进行性下降为主要表现,正逐渐成为我国ESRD的第一大病因[1]。2001年RENAAL研究及IDNT研究证实了肾素-血管紧张素-醛固酮系统(RAAS)抑制剂对2型糖尿病(T2DM)合并慢性肾脏病(CKD)患者有肾脏保护作用。近20年来糖尿病肾病导致CKD的治疗没有突破。2019年CREDENCE研究纳入了2型糖尿病合并CKD患者,在中期分析时,发现卡格列净具有降糖以外的肾脏保护作用,同时报道了卡格列净可致泌尿生殖系感染率增加。益肾化湿颗粒源于李东垣所著《脾胃论》[2]的“肺之脾胃虚论”中的名方“升阳益胃汤”,具有升阳补脾、益肾化湿、利水消肿的功效。本研究将观察益化湿颗粒联合血管紧张素Ⅱ受体拮抗剂(ARB)与钠-葡萄糖共转运蛋白 -2 抑制剂(SGLT2)抑制剂比仅使用ARB和SGLT2抑制剂疗效是否更优,为能够有效地预防和治疗糖尿病肾病提供理论依据。本课题积极响应国家科技部国家中医药管理局《十三五中医药科技创新专项规划》中提高中医药防治重大疾病,提升8 ~10种重大疾病和3~5种疑难病中医药疗效水平,建立10~15种民族医药临床诊疗方案等内容,探讨了益肾化湿颗粒对糖尿病肾病这一重大疾病的保护作用。
1 资料与方法
1.1 一般资料
选取2020年12月—2022年2月在秦皇岛市第一医院诊治的60例糖尿病肾病脾虚湿盛证患者作为研究对象,在随机分组前已接受血管紧张素转化酶抑制剂(ACEI)或ARB达到说明书中每日最大耐受剂量至少4周。将符合要求的入组人员按照随机数表法随机分为试验组和对照组,各30例。同时,选取秦皇岛市第一医院体检中心的体检者20例作为健康体检组。试验组与对照组性别构成、年龄及血清空腹血糖(FBG)、糖化血红蛋白(HbA1c)比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究对象对研究知情同意并签署知情同意书,且本课题已通过伦理委员会批准。
表1 试验组与对照组一般资料比较 [(±s)/n(%)]
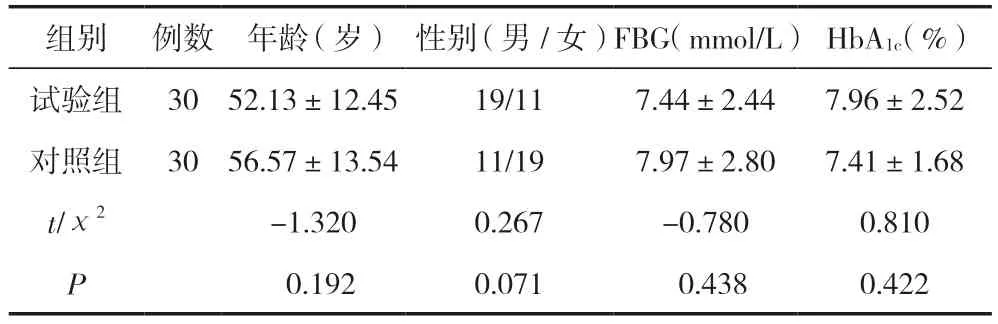
表1 试验组与对照组一般资料比较 [(±s)/n(%)]
组别例数年龄(岁)性别(男/女)FBG(mmol/L)HbA1c(%)试验组3052.13±12.4519/117.44±2.447.96±2.52对照组3056.57±13.5411/197.97±2.807.41±1.68 t/χ2-1.3200.267-0.7800.810 P 0.1920.0710.4380.422
1.2 纳入与排除标准
纳入标准: ①患有2型糖尿病[3],糖化血红蛋白水平为<9%;②eGFR≥30mL/(min·1.73m2);③尿白蛋白/肌酐>300 mg/g;④存在糖尿病视网膜病变; ⑤经肾脏穿刺确诊为糖尿病肾病;⑥符合中医消渴病肾病之脾虚湿盛证[4]。
排除标准:①非糖尿病肾病或1型糖尿病的患者;②合并其他肾小球疾病或肾小管间质疾病的患者;③在3个月内发生过糖尿病酮症酸中毒及其他急性并发症患者;④接受过免疫抑制剂治疗患者;⑤有透析或肾移植病史的患者;⑥有血尿、肾病综合症及原因未明的白蛋白尿患者。
1.3 方法
对照组患者给予降糖(SGLT2抑制剂、胰岛素、双胍类、糖苷酶抑制剂、列奈类、利汀类)、降脂(他汀类)、降压(ARB类、ACEI类、CCB类)、减轻水肿(利尿剂)等常规治疗;试验组加服益肾化湿颗粒(生产企业:广州康臣药业有限公司,国药准字Z20090250,规格:10 g/袋,9袋/盒)1袋/次,3次/d,开水冲服。两组均治疗3个月。
1.4 观察指标
分别于入组前、治疗3个月后抽取清晨空腹肘静脉血6 mL,送检验室测血清FBG、HbA1c、血肌酐(SCr)、尿酸(UA)、血尿素氮(BUN)、尿白蛋白排泄率(UAER)、肾小球滤过率估计值(eGFR)及β2微球蛋白(β2-MG)的量,同时留取6 mL静脉血,经离心(3000 r/min,20 min)后取血清置于EP管内,统一存于-80°C冰箱中待检;待标本收集完成后采用酶联免疫吸附测定(ELISA)法检测各组血清中沉默信息调节因子1(sirt1)的浓度。健康体检组留取血清,与对照组、试验组一样检测sirt1浓度。
1.5 统计学分析
通过SPSS 26.0软件进行数据分析,计数资料 用[n(%)]表示,采用χ2检验;计量资料正态分布用(±s)表示,非正态分布用M(P25,P75)表示,两组组间比较及治疗前后差值比较采用独立样本t检验,试验组与对照组治疗前后组内比较采用配对样本t检验分析。若不符合则采用秩和检验;应用双变量Pearson相关分析分别对sirt1与FBG、HbA1c、SCr、UA、BUN、UAER、eGFR、β2-MG等一般实验室指标进行统计,若P<0.05则表示差异有统计学意义。
2 结果
2.1 试验组与对照组治疗前肾功能及肾小管功能指标比较
治疗前,试验组与对照组SCr、UA、BUN、UAER、eGFR水平比较,差异无统计学意义(P>0.05),具有可比性;试验组与对照组β2-MG水平比较,差异无统计学意义(P>0.05),具有可比性,见表2。
表2 试验组与对照组治疗前肾功能及肾小管功能指标比较 (±s)

表2 试验组与对照组治疗前肾功能及肾小管功能指标比较 (±s)
组别例数SCr(μmol/L)UA(μmol/L)BUN(mmol/L)UAER(g/24 h)eGFR[ml/(min·1.73 m2)]β2-MG(mg/L)试验组30105.51±38.72377.48±119.408.57±3.243.48±3.2971.93±30.044.62±1.60对照组30105.09±60.08350.34±94.789.37±5.064.07±3.4572.53±33.515.11±2.87 t 0.0330.975-0.730-0.570-0.073-0.794 P 0.9740.3340.4680.5710.9420.431
2.2 试验组与对照组sirt1水平比较
治疗前试验组与对照组sirt1水平比较,差异无统计学意义(P>0.05);治疗后试验组与对照组sirt1水平比较,差异无统计学意义(P>0.05),见表3。
表3 试验组与对照组sirt1水平比较 (±s)

表3 试验组与对照组sirt1水平比较 (±s)
组别例数治疗前(ng/mL)治疗后(ng/mL)tP试验组301.35±1.251.57±1.22-1.2610.218对照组301.12±1.011.07±0.840.1910.850 t 0.4411.722 P 0.6610.091
2.3 试验组与对照组治疗前后临床各实验室指标水平变化
经治疗后,试验组患者较对照组患者SCr水平明显下降,差异有统计学意义(P<0.05);其余各实验室指标(血清FBG、HbA1c、UA、BUN、UAER、eGFR及β2-MG)组间比较,差异无统计学意义(P>0.05),见表4、表5。
表4 试验组治疗前后临床各实验室指标水平变化比较 (±s)

表4 试验组治疗前后临床各实验室指标水平变化比较 (±s)
项目试验组tP治疗前治疗后FBG(mmol/L)7.44±2.447.11±2.800.6740.506 HbA1c(%)7.96±2.527.35±1.591.7830.089 SCr(μmol/L) 105.51±38.72101.50±34.23# 0.9390.356 UA(μmol/L)377.48±119.40378.67±125.860.0960.924 BUN(mmol/L)8.57±3.248.83±2.98-0.5670.575 UAER(g/24 h)3.48±3.293.20±2.871.2850.211 eGFR(ml/(min·1.73 m²)71.93±30.0473.84±25.71#-0.7190.478 β2-MG(mg/L)4.62±1.604.88±2.11-0.9020.376
表5 对照组治疗前后临床各实验室指标水平变化比较 (±s)

表5 对照组治疗前后临床各实验室指标水平变化比较 (±s)
注:试验组与对照组组内治疗前后比较:*P<0.05;试验组与对照组组间差值比较:#P<0.05
项目对照组t/ZP治疗前治疗后FBG(mmol/L)7.97±2.807.29±2.721.2830.211 HbA1c(%)7.41±1.688.08±1.68*-2.5180.026 SCr(μmol/L)92.7(58.10,123.90)100.00(67.35,176.80)*-2.9170.007 UA(μmol/L) 350.34±94.78366.12±139.93-0.6020.552 BUN(mmol/L)8.00(6.07,11.33)8.85(5.60,12.15)-1.1090.277 UAER(g/24 h)4.07±3.454.48±3.79 -1.0360.322 eGFR(ml/(min·1.73 m²)71.68(40.67,104.37)59.86(29.83,94.34)* 3.5530.001 β2-MG(mg/L)4.18(2.87,7.79)5.83(3.63,9.62)*-2.9850.008
2.4 sirt1与临床各实验室指标的双变量Pearson相关分析
sirt1分别与血清FBG、HbA1c、SCr、UA、BUN、UAER、eGFR及β2-MG进行相关性分析,差异无统计学意义(P>0.05),均不存在相关性,见表6。

表6 sirt1与临床各实验室指标的双变量Pearson相关分析
2.5 糖尿病肾病组与健康体检组一般情况及sirt1比较
糖尿病肾病组与健康体检组性别构成、年龄比较,差异无统计学意义(P>0.05);而糖尿病肾病组血清sirt1水平均明显低于健康体检组,差异有统计学意义(P<0.05),见表7。
表7 糖尿病肾病组与健康体检组一般情况及sirt1比较 (±s)

表7 糖尿病肾病组与健康体检组一般情况及sirt1比较 (±s)
组别例数年龄(岁)性别(男/女)sirt1(ng/mL)糖尿病肾病组3054.35±13.0930/301.23±1.13健康体检组2060.10±9.0712/85.58±4.90 t/χ2-1.8200.602-3.927 P 0.0730.4380.001
3 讨论
糖尿病肾病常表现为大量白蛋白尿、高血压、踝部及双下肢水肿、体重增加、贫血及夜间尿频等[5],有研究表明,出现蛋白尿及糖尿病视网膜病变的糖尿病患者发生DN 的可能性很大[6]。就目前来看,全球糖尿病患病率约为9.3%(4.63亿人),预计2030年这一数字将增至10.2%(5.78亿人),2045年可高达10.9%(7亿人),其中女性患病率为9.0%,男性为9.6%[7]。同样,我国糖尿病患者数量也高达1.16亿人,并且约有40%的人可发生糖尿病肾病,使糖尿病的病死风险增加至31.1%[8-9],其中心血管事件、肾功能衰竭等为常见的病死原因。
sirt1途径在糖尿病肾病发病机制里为研究的一个热点方向。sirt1为Ⅲ类组蛋白去乙酰化酶,许多研究已表明它可以通过去乙酰化来起到减轻氧化应激、增强自噬、稳定线粒体等肾脏保护作用。有研究发现模拟人类T2DM 的db/db小鼠在给予sirt1激动剂白藜芦醇后,通过由AMP激活的蛋白激酶-sirt1-PGC1α轴,减轻了线粒体介导的氧化应激对肾小球系膜细胞的损伤。sirt1也可促进自噬来介导肾脏保护作用,通过促进自噬小体的形成、成熟和溶酶体的融合,成为肾脏自噬功能的重要诱导者[10]。此外,sirt1可维持线粒体网络的动态平衡[11-12]和保护过氧化物酶体系[12-13],并增强抗氧化酶活性[14]和抑制炎性反应介导的细胞损伤[15],故sirt1信号增强既可以改善细胞应激(自噬受损),也可以减轻肾脏损伤。
益肾化湿颗粒为近年来新上市的一类中成药,可适用于颜面或肢体浮肿、疲倦乏力、食少纳呆或便溏、畏寒肢冷、腰脊酸痛等脾虚湿盛证的早期糖尿病肾病患者,具有升阳补脾、益肾化湿、利水消肿的作用[16]。尹秀英等[17]应用益肾化湿颗粒治疗82例早期糖尿病肾病患者,通过观察试验组与对照组治疗前后肾功能指标的变化,发现了在糖尿病肾病常规西医治疗的基础上加用益肾化湿颗粒可明显改善水肿、蛋白尿等临床症状。研究发现糖尿病肾病患者在足量ACEI/ARB加SGLT2i基础上联合益肾化湿颗粒,对肾功能有进一步保护作用,表明益肾化湿颗粒在糖尿病肾病中可有不错的治疗效果。随着研究的深入,益肾化湿颗粒是如何发挥肾脏保护作用的机制也成为了目前探讨的热点话题。已有研究表明益肾化湿颗粒可能通过抑制炎性反应、减轻氧化应激、改变细胞外信号调节激酶通路等保护肾功能。在研究中,通过比较试验组与对照组患者中sirt1、肾功能等临床各试验室指标水平在治疗前后的改变,探讨益肾化湿颗粒是否通过激活sirt1途径保护糖尿病肾病患者,为益肾化湿颗粒在治疗糖尿病肾病患者提供理论依据。
将益肾化湿颗粒用于治疗糖尿病肾病患者的安全性方面是相对可靠的。在一项共纳入1254例患者的Meta分析中表明,益肾化颗粒能够明显改善肾功能受损,延缓糖尿病肾病的发展,且均未见严重不良反应发生[18]。但本次研究未能得出益肾化湿颗粒可以通过激活sirt1途径保护糖尿病肾病患者的有效结论,总结可能的原因:①样品的冻融欠规范。②糖尿病肾病患者不同分期是否对血清sirt1水平产生影响尚不明确。③是否存在其他因素影响血清sirt1水平尚不清楚。④本次研究入组的患者例数有限,观察的实验室指标不完全,未能对糖尿病肾病患者进行长期随访来动态观察。所以只能作为益肾化湿颗粒通过激活sirt1途径保护糖尿病肾病患者作用研究的初步探索,有待后续试验来进一步研究。

