基于PINK1/Parkin通路研究天麻芎苓止眩片对自发性高血压大鼠线粒体自噬的影响
雍苏南,房赤,任卫琼,刘林,蒋丽,喻珮,刘建和
湖南中医药大学第一附属医院,湖南 长沙 410007
高血压是我国患病人数最多的慢性非传染性疾病之一,我国现有高血压患者2.445亿[1],其常引起心、脑、肾等多器官功能破坏,是导致居民死亡的重要危险因素。血管内皮作为血管平滑肌和血液的重要机械屏障,可分泌多种血管收缩因子和舒张因子,以维持血管生理功能和正常血压[2]。线粒体是保证内皮细胞正常功能最基本的细胞器之一,线粒体自噬失衡时,内皮细胞活性氧(ROS)产生增加,炎症加重,导致内皮功能障碍,从而引发血管舒缩功能异常、血管重塑,导致血压升高[3]。天麻芎苓止眩片为湖南中医药大学第一附属医院院内制剂,基于高血压病“虚、瘀、风”病机,以平肝熄风、健脾逐瘀为治法创制,临床使用多年,能明显降低原发性高血压肝火亢盛、痰热内蕴证患者血压,改善临床症状,降低中医证候积分[4]。动物实验显示,天麻芎苓止眩片可维持血管炎症稳态,保护内皮功能[5]。基于此,本研究观察天麻芎苓止眩片对自发性高血压大鼠线粒体自噬的影响,进一步探讨其治疗高血压病的作用机制。
1 材料与方法
1.1 动物
SPF级雄性自发性高血压大鼠30只,体质量210~235 g;SPF级雄性正常血压大鼠(Wistar-Kyoto)10只,体质量212~238 g,均由北京维通利华实验动物技术有限公司上海分公司提供,动物生产许可证号SCXK(沪)2017-0011。饲养于湖南中医药大学第一附属医院实验动物中心标准动物房,使用许可证号SYXK(湘)2015-0003。本研究经湖南中医药大学第一附属医院实验动物伦理委员会批准(ZYFY20200518-02)。
1.2 药物及制备
天麻芎苓止眩片(天麻15 g,钩藤15 g,川芎10 g,野菊花12 g,茯苓15 g,法半夏6 g,牡蛎6 g,地龙15 g,罗布麻18 g,酸枣仁9 g,香附10 g,丹参15 g,甘草6 g),由湖南中医药大学第一附属医院制剂室提供,批号20210812,0.46 g/片,用超纯水配制成0.1 g/mL溶液。卡托普利片,中美上海施贵宝有限公司,批号20210823,12.5 mg/片,用超纯水配制成0.76 mg/mL溶液。
1.3 主要试剂与仪器
大鼠ROS、丙二醛(MDA)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)ELISA试剂盒(武汉赛培,批号分别为SP13358、SP30131、SP13470、SP12914、SP12673),PTEN诱导假定激酶1(PINK1)、E3泛素连接酶(Parkin)、Beclin1一抗(美国Proteintech公司,货号分别为23274-1-AP、14060-1-AP、11306-1-AP),GAPDH抗体(武汉贝茵莱,货号PAB36269),Trizol试剂(美国Invitrogen公司,货号15596018),反转录试剂盒、RTqPCR mix(美国Promega公司,货号分别为A3500、A6001)。
智能无创血压计(北京软隆科技有限公司,型号BP2010),全自动酶标分析仪(北京普朗新技术有限公司,型号DNM-9602),生物组织石蜡包埋机(孝感市亚光医用电子技术有限公司,型号YB-8LF),透射电镜(日立公司,型号HT7700),图像采集系统(日本Olympus,型号BX50),电泳仪(北京六一仪器厂,型号DYY-6C),全自动化学发光分析仪(上海天能科技有限公司,型号Tanon-5200),定量PCR仪(美国Bio-Rad公司,型号CFX Connect)。
1.4 分组及给药
采用分层随机法将30只自发性高血压大鼠分为模型组、西药组和中药组,每组10只,将10只Wistar-Kyoto大鼠作为正常组。中药组以1.0 g/kg灌胃天麻芎苓止眩片溶液,西药组以7.6 mg/kg灌胃卡托普利溶液,正常组和模型组予蒸馏水灌胃,体积10 mL/kg,每日1次,连续6周。
1.5 指标检测
1.5.1 收缩压测量
分别于给药前及给药各周第7日9:00—11:00采用智能无创血压计测量大鼠平静状态下尾动脉收缩压,保证相同实验条件,每只大鼠连续测量3次,取平均值。
1.5.2 血清氧化应激指标检测
干预结束后24 h,3%戊巴比妥钠腹腔注射麻醉大鼠,开腹,取下腔静脉血,3500 r/min离心15 min,收集血清,按照ELISA试剂盒说明书检测血清ROS、MDA、CAT、SOD、GSH含量。
1.5.3 胸主动脉形态观察
取血后分离大鼠胸主动脉,置于10%福尔马林溶液中固定,常规脱水,石蜡包埋,制成厚度5 μm切片,于45 ℃恒温箱中烘干,脱蜡复水,经HE染色、透明、封片后,显微镜下观察胸主动脉组织形态。
1.5.4 透射电镜观察
切取大鼠胸主动脉组织,置于2.5%戊二醛预固定,1%锇酸后固定,丙酮、环氧树脂脱水,聚合包埋箱聚合后,制成60 nm超薄切片,经醋酸铀、枸橼酸铅避光染色,透射电镜观察线粒体结构及自噬体数目。
1.5.5 免疫组化染色
石蜡切片70 ℃烤片2 h,经脱蜡、水洗后,高温高压法进行组织修复,3%过氧化氢溶液去除过氧化物酶,滴加PINK1、Parkin、Beclin1一抗(均为1∶100),4 ℃孵育24 h,PBS洗涤后,滴加二抗,37 ℃孵育20 min,DAB显色5 min,苏木素复染,脱水、透明后,中性树胶封片。显微镜下观察,以棕黄色颗粒为阳性表达,Adobe Photoshop图像分析软件计算阳性表达的积分光密度(IOD)。
1.5.6 Western blot检测
胸主动脉组织加入RIPA裂解液提取总蛋白,4 ℃、12000×g离心10 min,收集上清液,BCA法测定蛋白浓度,凝胶电泳后,200 mA转膜(PVDF膜)1 h,使用5%脱脂牛奶(0.5%TBST配制)封闭1 h,加入PINK1、Parkin、Beclin1一抗(均为1∶1000)、GAPDH一抗(1∶5000),4 ℃孵育过夜,加入二抗(1∶3000),室温孵育30 min,洗膜,ECL显影,以GAPDH为内参,AlphaEase FC软件分析目的蛋白相对灰度值。
1.5.7 RT-qPCR检测
胸主动脉组织加入Trizol试剂,4 ℃匀浆20 s,加入氯仿200 μL,摇匀,室温静置2 min,4 ℃、12000 ×g离心10 min,取上清液,加入等体积异丙醇,静置、离心后,加入75%乙醇1 mL漂洗沉淀,离心2次,加入DNase/RNase-Free Water 40 μL溶解RNA,按试剂盒说明书反转录成cDNA。PCR条件:95 ℃、3 min,95 ℃、3 s,56 ℃、10 s,72 ℃、25 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。

表1 各基因PCR引物序列
1.6 统计学方法
采用SPSS24.0统计软件进行分析。计量资料以±s表示,多组间比较服从正态分布且方差齐用方差分析,两两比较采用LSD-t检验;不符合正态分布或方差不齐采用秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 天麻芎苓止眩片对自发性高血压大鼠收缩压的影响
与同一时点正常组比较,模型组大鼠收缩压显著升高,差异有统计学意义(P<0.05);与同一时点模型组比较,西药组给药第1周收缩压开始下降,中药组给药第3周收缩压开始下降,差异均有统计学意义(P<0.05),且中药组收缩压高于西药组(P<0.05),给药第5、6周,中药组与西药组收缩压差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠不同时点收缩压比较(±s,mm Hg)
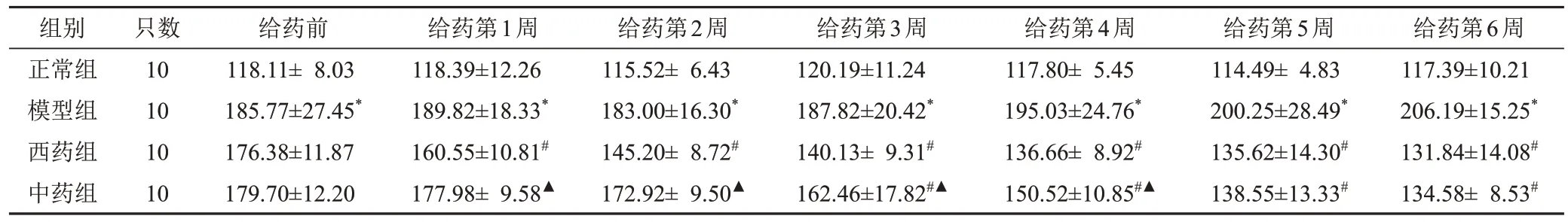
表2 各组大鼠不同时点收缩压比较(±s,mm Hg)
注:1 mm Hg=0.133 kPa;与同一时点正常组比较,*P<0.05;与同一时点模型组比较,#P<0.05;与同一时点西药组比较,▲P<0.05
组别正常组模型组西药组中药组给药第6周117.39±10.21206.19±15.25*131.84±14.08#134.58± 8.53#只数1010 1010给药前118.11± 8.03185.77±27.45*176.38±11.87179.70±12.20给药第1周118.39±12.26189.82±18.33*160.55±10.81#177.98± 9.58▲给药第2周115.52± 6.43183.00±16.30*145.20± 8.72#172.92± 9.50▲给药第3周120.19±11.24187.82±20.42*140.13± 9.31#162.46±17.82#▲给药第4周117.80± 5.45195.03±24.76*136.66± 8.92#150.52±10.85#▲给药第5周114.49± 4.83200.25±28.49*135.62±14.30#138.55±13.33#
2.2 天麻芎苓止眩片对自发性高血压大鼠血清氧化应激指标的影响
与正常组比较,模型组大鼠血清ROS、MDA含量显著升高,CAT、SOD、GSH含量显著降低(P<0.05);与模型组比较,西药组和中药组大鼠血清ROS、MDA含量显著降低,CAT、SOD、GSH含量显著升高(P<0.05);中药组与西药组CAT、SOD、GSH差异有统计学意义(P<0.05)。见表3。
表3 各组大鼠血清ROS、MDA、CAT、SOD、GSH含量比较(±s)

表3 各组大鼠血清ROS、MDA、CAT、SOD、GSH含量比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与西药组比较,▲P<0.05
GSH/(nmol/L)131± 6.2176.71±10.37*103.49±11.32#116.86± 7.65#▲组别正常组模型组西药组中药组只数1010 1010 ROS/(U/mL)39.47±15.6574.67±10.29*53.53±11.93#50.64±13.54#MDA/(nmol/mL)3.92±0.429.82±0.31*6.37±0.49#6.76±0.51#CAT/(U/mL)12.35±0.576.21±0.36*9.12±0.43#8.87±0.53#▲SOD/(U/mg)142.65±8.6586.27±7.41*126.46±8.32#116.45±9.79#▲
2.3 天麻芎苓止眩片对自发性高血压大鼠胸主动脉组织形态的影响
正常组胸主动脉组织血管平滑肌细胞排列规则,内膜较完整,管壁未见增厚;与正常组比较,模型组胸主动脉组织平滑肌细胞增生肥大、排列欠规则,内膜粗糙、缺损,管壁增厚;与模型组比较,西药组和中药组胸主动脉组织平滑肌细胞增生减少、排列较规则,管壁厚度接近正常。见图1。
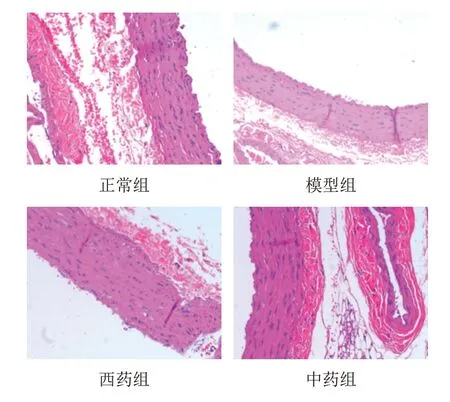
图1 各组大鼠胸主动脉组织形态(HE染色, ×400)
2.4 天麻芎苓止眩片对自发性高血压大鼠胸主动脉内皮细胞线粒体结构及自噬体数目的影响
正常组胸主动脉内皮细胞线粒体结构较完整,线粒体嵴明显,无空泡;模型组胸主动脉内皮细胞线粒体明显肿胀,内部嵴结构破坏或消失,可见大量包裹自噬溶酶体的自噬泡及少量自噬体;与模型组比较,西药组胸主动脉内皮细胞可见少量正常线粒体,自噬泡减少,中药组胸主动脉内皮细胞线粒体损伤明显改善,可见少量包裹自噬溶酶体的自噬泡。见图2。
2.5 天麻芎苓止眩片对自发性高血压大鼠胸主动脉组织PTEN诱导假定激酶1、E3泛素连接酶、Beclin1蛋白表达的影响
免疫组化染色显示,正常组胸主动脉组织未见明显棕黄色染色;与正常组比较,模型组胸主动脉组织PINK1、Parkin、Beclin1蛋白表达显著升高(P<0.05);与模型组比较,西药组和中药组胸主动脉组织PINK1、Parkin、Beclin1蛋白表达均显著降低(P<0.05),中药组与西药组差异无统计学意义(P>0.05)。见图3、表4。

图3 各组大鼠主动脉组织PINK1、Parkin、Beclin1阳性表达(免疫组化染色,×400)
表4 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白表达比较(±s,IOD)

表4 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白表达比较(±s,IOD)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别正常组模型组西药组中药组Beclin128.81± 3.65126.19±26.72*78.54± 7.63#92.56±15.39#只数1010 1010 PINK1204.36± 25.63601.86±108.54*346.59± 53.19#317.18± 41.11#Parkin 73.37± 16.88528.01±119.21*129.10± 41.64#119.87± 19.21#
Western blot结果显示,与正常组比较,模型组胸主动脉组织PINK1、Parkin、Beclin1蛋白表达显著升高(P<0.05);与模型组比较,西药组和中药组胸主动脉组织PINK1、Parkin、Beclin1蛋白表达均显著降低(P<0.05),中药组与西药组差异无统计学意义(P>0.05)。见图4、表5。

图4 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白免疫印迹
表5 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白表达比较(±s,相对灰度值)

表5 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白表达比较(±s,相对灰度值)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
Beclin11.01±0.104.01±0.15*2.03±0.13#2.86±0.10#组别正常组模型组西药组中药组只数1010 1010 PINK11.03±0.083.54±0.72*2.42±0.52#2.18±0.41#Parkin 0.96±0.064.16±0.69*2.76±0.53#2.13±0.46#
2.6 天麻芎苓止眩片对自发性高血压大鼠胸主动脉组织PTEN诱导假定激酶1、E3泛素连接酶、Beclin1 mRNA表达的影响
与正常组比较,模型组胸主动脉组织PINK1、Parkin、Beclin1 mRNA表达显著升高,差异有统计学意义(P<0.05);与模型组比较,西药组和中药组胸主动脉组织PINK1、Parkin、Beclin1 mRNA表达显著降低(P<0.05),中药组与西药组差异无统计学意义(P>0.05)。见表6。
表6 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1 mRNA表达比较(±s)

表6 各组大鼠胸主动脉组织PINK1、Parkin、Beclin1 mRNA表达比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
Beclin11.17±0.092.19±0.64*1.71±0.32#1.35±0.09#组别正常组模型组西药组中药组只数1010 1010 PINK11.02±0.256.40±1.08*2.71±0.94#2.22±0.41#Parkin 1.00±0.107.42±1.08*2.26±0.42#1.96±0.38#
3 讨论
根据临床症状,高血压病属中医学“眩晕”“头痛”等范畴。临床研究发现,“虚、瘀、风”的病机状态贯穿高血压病始终[6-7],天麻芎苓止眩片对高血压病有多成分、多靶点、多途径的干预效果[4-5]。方中天麻味甘、性平,归肝经,可熄风止痉、平抑肝阳、祛风通络;钩藤、川芎清热熄风、活血行气;茯苓、法半夏、野菊花健脾化痰、平肝清热;地龙、香附、丹参疏肝理气、祛瘀通络;牡蛎、罗布麻、酸枣仁滋阴潜阳、养肝清热;甘草调和诸药。诸药相伍,在平肝熄风同时健运脾气、清热化痰、祛瘀通络。前期研究表明,天麻芎苓止眩片可降低血清白细胞介素(IL)-1、IL-10含量,降低胸主动脉组织Atg8、LC3表达,调节基质金属蛋白酶-2、基质金属蛋白酶抑制因子2表达,从而恢复自噬稳态、减轻内皮损伤、逆转血管重塑、降低血压[5,8-9]。本研究观察到,模型组大鼠胸主动脉内皮细胞线粒体结构破坏,出现大量自噬泡和自噬体,血清ROS、MDA含量升高,CAT、SOD、GSH含量降低,说明高血压状态下线粒体自噬明显。天麻芎苓止眩片干预后,模型大鼠血压显著降低,血清ROS、MDA含量降低,CAT、SOD、GSH含量升高,胸主动脉内皮细胞线粒体损伤明显改善,自噬泡和自噬体数目减少,表明天麻芎苓止眩片可减轻氧化应激,调节线粒体过度自噬,保护内皮功能。
内皮损伤是高血压病内皮细胞被激活的典型特征[10],包括血管通透性增加、氧化应激水平升高、不同内皮来源信使的释放失衡,以及血栓前和促炎表型等,而内皮细胞线粒体自噬失衡是内皮损伤的关键机制之一[11-12]。PINK1/Parkin通路是研究线粒体自噬相关疾病的经典通路[13-14]。生理状态下,磷酸酶与张力蛋白同源物将PINK1诱导进入线粒体后降解。在健康线粒体中,由于转录后调节和蛋白水解的快速降解,PINK1维持在低水平。在受损线粒体中,线粒体膜去极化后损伤部分被暴露出来,PINK1在去极化的膜表面大量聚集并募集Parkin,PINK1在Ser65位点对Parkin进行磷酸化,活化的Parkin促使线粒体表面蛋白泛素化,持续聚集p62,最后经p62-LC3进入自噬-溶酶体系统降解[15]。Beclin1是哺乳动物主要的自噬调节基因,在自噬初始阶段,其通过与PI3KC3结合参与自噬体形成,从而起到关键作用[16]。线粒体过度自噬时,小鼠血管内皮功能受损,导致主动脉收缩功能下降,Beclin1表达也明显上升[17]。本研究发现,模型组大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白和mRNA表达显著升高,经天麻芎苓止眩片干预后,模型大鼠胸主动脉组织PINK1、Parkin、Beclin1蛋白和mRNA表达显著降低,表明其可能通过调控PINK1/Parkin通路调节线粒体过度自噬,减轻氧化应激损伤。
综上,天麻芎苓止眩片可能通过调节PINK1/Parkin通路介导的线粒体自噬逆转血管内皮氧化应激损伤,维持血管内皮功能稳态,从而发挥降压作用。

