基于Notch1-Hes1-Prdx 蛋白家族通路探究强骨胶囊治疗绝经后骨质疏松的炎症及氧化应激机制
鲁 林 方 虹
1.武汉市中医医院骨科,湖北武汉 430000;2.湖北省中医院 湖北中医药大学附属医院 湖北省中医药研究院妇科,湖北武汉 430000
骨质疏松是以骨量减少和骨组织微结构异常改变为特征,骨脆性增加、易骨折的一种全身代谢性骨病。女性在绝经后体内雌激素水平的下降导致骨形成——骨吸收偶联失衡,骨密度(bone mineral density,BMD)降低,进而发生绝经后骨质疏松(postmenopausal osteoporosis,PMOP)[1]。据报道,>50 岁女性中PMOP 的发病率超过30%[2],俨然成为全球性的公共卫生问题。研究表明,氧化应激和炎症反应在PMOP 的发生发展中扮演重要角色,雌激素对PMOP 的作用可能与其抗氧化、抗炎作用有关[3]。氧化应激可通过促进破骨细胞介导的骨吸收、抑制成骨细胞介导的骨形成,诱发PMOP[4]。Notch1 信号通路可通过与其配体Jagged1 结合激活,从而发挥维持机体成骨细胞和破骨细胞的平衡和稳态作用[5]。本课题组前期研究发现,在PMOP 患者体内过氧化物还原酶蛋白家族(peroxiredoxin 1~6,Prdx1~6)普遍表达降低[6],推测其是通过降低机体的抗氧化能力,增强氧化应激,进而诱发PMOP。强骨胶囊是目前防治骨质疏松症的中药二类新药,其主要成分为骨碎补总黄酮。骨碎补总黄酮是水龙骨科植物槲蕨根茎中的主要活性成分,能够有效调节骨代谢、增加骨量,从而发挥抗骨质疏松症的作用[7]。然而,目前强骨胶囊治疗PMOP 的分子生物学机制尚不明确,因此本研究通过构建PMOP 大鼠模型,基于Notch1-Hes1-Prdx 蛋白家族通路探究强骨胶囊治疗PMOP的炎症及氧化应激机制。
1 资料与方法
1.1 实验材料
1.1.1 实验动物 60 只5 月龄的野生型、清洁级雌性SD 大鼠,体重(300±20)g,购自武汉大学动物实验中心[许可证号:SCXK(鄂)2019-0004],实验期间喂养于湖北中医药大学清洁级实验动物房[SYXK(鄂)2019-0016],室内自然采光,温度为21~24℃,相对湿度为60%~80%,自由摄取饲料、饮水。本研究经武汉市中医医院伦理委员会审批通过(武中医伦KY2020-015)。
1.1.2 药物与试剂 强骨胶囊(北京岐黄制药有限公司,批号:12001881716);雌二醇(湖北信康医药化工有限公司,批号:2016-09-06);HE 试剂盒(上海抚生实业有限公司,货号:A100005);酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(美国TSZ 公司,货号:20190105、20190522、20190417、20190226、20190121、20200210、20200119、20191004、20190828、20200425、20190502、20180714、20191106、20200108、20181003、20191218、20200212、20191207);逆转录试剂盒(德国Qiagen 公司,货号:169025387);荧光定量PCR 试剂盒(上海泽叶生物科技有限公司,货号:RT0411-02);蛋白提取试剂盒(上海钰博生物科技有限公司,货号:bc0345)。
1.1.3 实验器材Horizon-A/W/Wi/Ci 型双能X 线(美国Hologic 公司);Vert.A1 型光学显微镜(德国ZEISS 公司);S1000TM96 Well 型PCR 仪(美国BIO-RAD 公司);EPS-300 型电泳仪(韩国Lab Companion 公司);DLAB GelSMART 凝胶成像仪[大龙兴创实验仪器(北京)股份公司]。
1.2 研究方法
1.2.1 建模、分组与干预60 只SD 大鼠采用随机数字表法分为假手术组,模型对照组,阳性对照组及强骨胶囊低、中、高剂量组,每组10 只。除假手术组外,其余大鼠通过腹腔注射3.0 mg/kg 戊巴比妥钠麻醉后,无菌条件下从背部双侧分别切口摘除双侧卵巢,缝合切口[8];假手术组仅切除双侧卵巢周边脂肪组织。术后8 周采用双能X 线对腰椎和股骨进行扫描并计算双能X 线测定大鼠股骨BMD 值以确认PMOP 是否造模成功[9]。阳性对照组皮下注射200 μg/kg 雌二醇,2次/周;按照大鼠的等效剂量为人日剂量的7 倍计算,强骨胶囊低剂量组为等效剂量的1/2,强骨胶囊中剂量组为等效剂量,强骨胶囊高剂量组为等效剂量的2 倍。强骨胶囊低、中、高剂量组分别予以100、200、300 mg/(kg·d)强骨胶囊灌胃;假手术组及模型对照组灌胃等量生理盐水,连续治疗12 周。
1.2.2 样本采集①血清及外周血单个核细胞(peripheral blood mononuclear cell,PBMC)采集:给药结束后禁食12 h,经腹腔采血,分离血清,于-80℃冰箱保存待用;向下层剩余的血细胞中加入外周血淋巴细胞分离液分离并收集PBMC,于-80℃冰箱保存待用。②双侧股骨采集:断头法处死大鼠后分离出双侧的股骨组织,左侧固定于10%甲醛,右侧冻存于液氮中待用。
1.2.3 双能X 线测定大鼠股骨BMD 取各组大鼠股骨组织,采用Hologic 双能X 线骨密度仪检测大鼠股骨的BMD。
1.2.4 HE 染色观察大鼠骨组织病理学变化 取各组大鼠固定于10%甲醛中的股骨组织,流水冲洗2 h 脱钙,脱水、透明后石蜡包埋,组织切片,HE 染色,中性树脂封片,光学显微镜下观察其病理学变化。
1.2.5 ELISA 法检测各组大鼠血浆炎症标志物、氧化应激标志物水平及Jagged1、Notch1、Hes1、Prdx1~6 蛋白表达水平 取各组大鼠血清,按照ELISA 试剂盒说明分别检测各大鼠血浆炎症标志物[白细胞介素(interleukin,IL)-1β、IL-6、IL-8、IL-17、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]、氧化应激标志物[单胺氧化酶A(monoamine oxidase-A,MAOA)、总抗氧化能力(total antioxidant capacity,T-AOC)、高级氧化蛋白产物(advanced oxidation pro-tein products,AOPP)、超氧化物歧化酶(superoxide dismutase,SOD)]水平及Jagged1、Notch1、Hes1 及Prdx1~6 的蛋白表达水平
1.2.6 RT-qPCR 测定PBMC 及骨组织中的Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平 取各组大鼠PBMC 提取总RNA,逆转录得到cDNA,通过荧光定量PCR 试剂盒进行PCR 扩增。以Primer Premier 5.0 软件设计引物序列,见表1。反应体系:10 μl 2×SYBR Mix,cDNA 模板1 μl,正、反向引物各1 μl,无酶双蒸水7 μl。反应程序:预变性95℃30 s,变性95℃5 s,退火55℃10 s,延伸72℃15 s,40 个循环。以GAPDH 为内参,2-ΔΔCt法计算各基因的相对表达量。另取各组大鼠冻存的股骨组织,加液氮研磨至粉末状,RT-qPCR 检测Jagged1、Notch1、Hes1 及Prdx1~6的表达水平,步骤同上。

表1 引物序列
1.2.7 Western blot 检测骨组织中的Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达水平 取各组大鼠股骨组织,提取总蛋白。按40 μg/ 孔加样至SDS-PAGE 凝胶中进行电泳,转膜至PVDF 膜上。5%脱脂牛奶封闭1 h,加入一抗4℃孵育过夜,次日加入二抗室温孵育2 h,曝光显影,DLAB GelSMART 凝胶成像仪成像,Image J 软件分析各目的蛋白相对表达量。
1.3 统计学方法
采用SPSS 22.0 统计学软件进行数据分析。计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验;两组间比较采用独立样本t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠股骨BMD 值比较
与假手术组比较,模型对照组大鼠股骨BMD 值降低(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠股骨BMD 值升高(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠股骨BMD值升高(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠股骨BMD 值升高(P<0.05)。见表2。
表2 各组大鼠股骨BMD 值比较(g/cm2,)
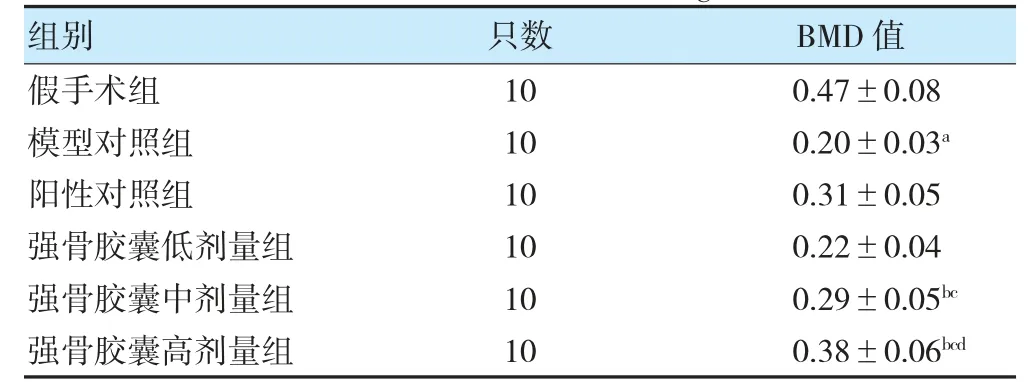
表2 各组大鼠股骨BMD 值比较(g/cm2,)
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。BMD:骨密度。
2.2 各组大鼠股骨组织病理学改变
假手术组大鼠股骨组织形态结构清晰完整,骨小梁饱满丰富、相互交织形成网状结构;模型对照组大鼠骨小梁数量减少,排列松散,间距增大,并出现断裂,呈典型骨质疏松病理学改变;与模型对照组比较,强骨胶囊中、高剂量组大鼠可见骨小梁数量明显增多,间距变小,形态相对完整。见图1。

图1 各组大鼠股骨组织病理学改变(HE 染色)
2.3 各组大鼠血浆炎症标志物水平比较
与假手术组比较,模型对照组大鼠血浆IL-1β、IL-6、IL-8、IL-17、TNF-α 水平升高(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠血浆IL-1β、IL-6、IL-8、IL-17、TNF-α 水平降低(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠血浆IL-1β、IL-6、IL-8、IL-17、TNF-α 水平降低(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠血浆IL-1β、IL-6、IL-8、IL-17、TNF-α 水平降低(P<0.05)。见表3。
表3 各组大鼠血浆炎症标志物水平比较(pg/ml,)
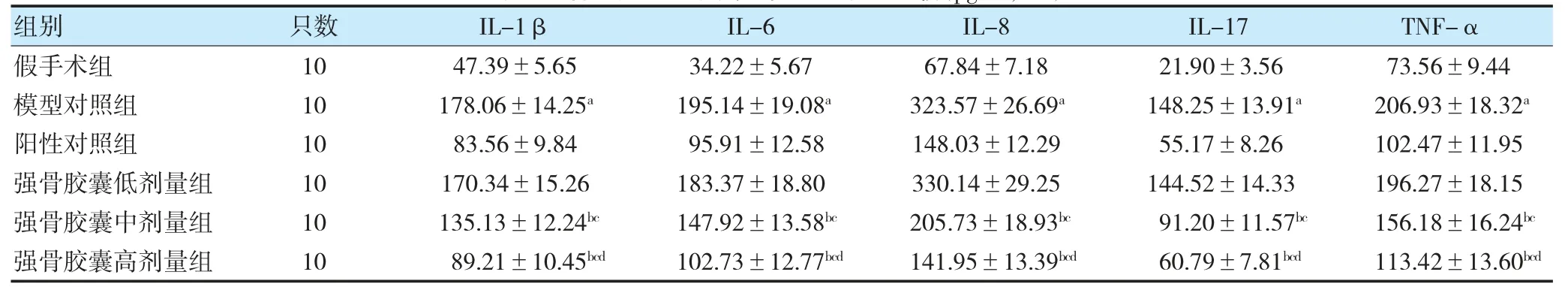
表3 各组大鼠血浆炎症标志物水平比较(pg/ml,)
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。IL:白细胞介素;TNF-α:肿瘤坏死因子-α。
2.4 各组大鼠血浆氧化应激标志物水平比较
与假手术组比较,模型对照组大鼠血浆MAOA、AOPP 水平升高,T-AOC、SOD 水平降低(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠血浆MAOA、AOPP 水平降低,T-AOC、SOD 水平升高(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠血浆MAOA、AOPP 水平降低,T-AOC、SOD 水平升高(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠血浆MAOA、AOPP 水平降低,T-AOC、SOD水平升高(P<0.05)。见表4。
表4 各组大鼠血浆氧化应激标志物水平比较()

表4 各组大鼠血浆氧化应激标志物水平比较()
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。MAOA:单胺氧化酶A;T-AOC:总抗氧化能力;AOPP:高级氧化蛋白产物;SOD:超氧化物歧化酶。
2.5 各组大鼠血浆Jagged1、Notch1、Hes1 及Prdx1~6蛋白表达水平比较
与假手术组比较,模型对照组大鼠血浆Jagged1、Notch1、Hes1 蛋白表达水平升高,Prdx1、Prdx6 蛋白表达水平降低(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠血浆Jagged1、Notch1、Hes1 蛋白表达水平降低,Prdx1、Prdx6 蛋白表达水平升高(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠血浆Jagged1、Notch1、Hes1 蛋白表达水平降低,Prdx1、Prdx6 蛋白表达水平升高(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠血浆Jagged1、Notch1、Hes1 蛋白表达水平降低,Prdx1、Prdx6 蛋白表达水平升高(P<0.05)。各组大鼠血浆Prdx2~5 蛋白表达水平比较,差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠血浆Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达水平比较(ng/L,)
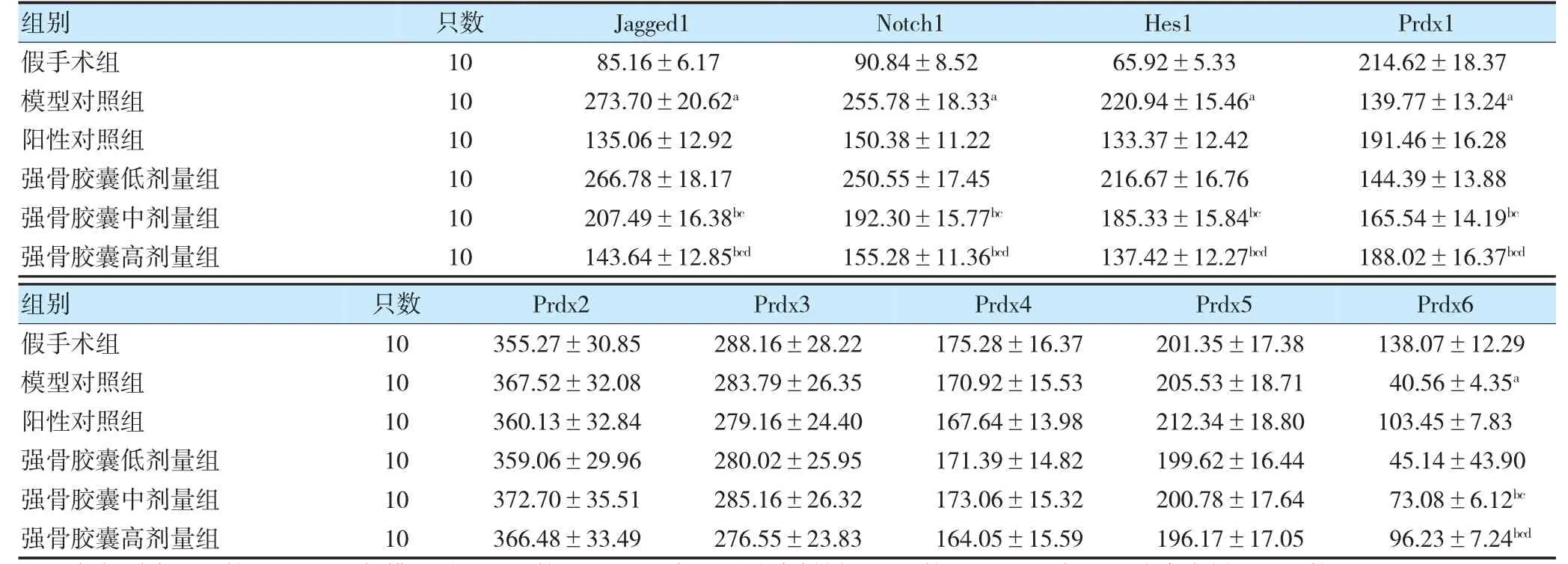
表5 各组大鼠血浆Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达水平比较(ng/L,)
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。
2.6 各组大鼠PBMC 中Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平比较
与假手术组比较,模型对照组大鼠PBMC 中Jagged1、Notch1、Hes1 mRNA 表达水平升高,Prdx1、Prdx6 mRNA 表达水平降低(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠PBMC 中Jagged1、Notch1、Hes1 mRNA 表达水平降低,Prdx1、Prdx6 mRNA表达水平升高(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠PBMC 中Jagged1、Notch1、Hes1 mRNA 表达水平降低,Prdx1、Prdx6 mRNA 表达水平升高(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠PBMC 中Jagged1、Notch1、Hes1mRNA 表达水平降低,Prdx1、Prdx6 mRNA 表达水平升高(P<0.05)。各组大鼠PBMC 中Prdx2~5 mRNA 表达水平比较,差异无统计学意义(P>0.05)。见表6。
表6 各组大鼠PBMC 中Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平比较()
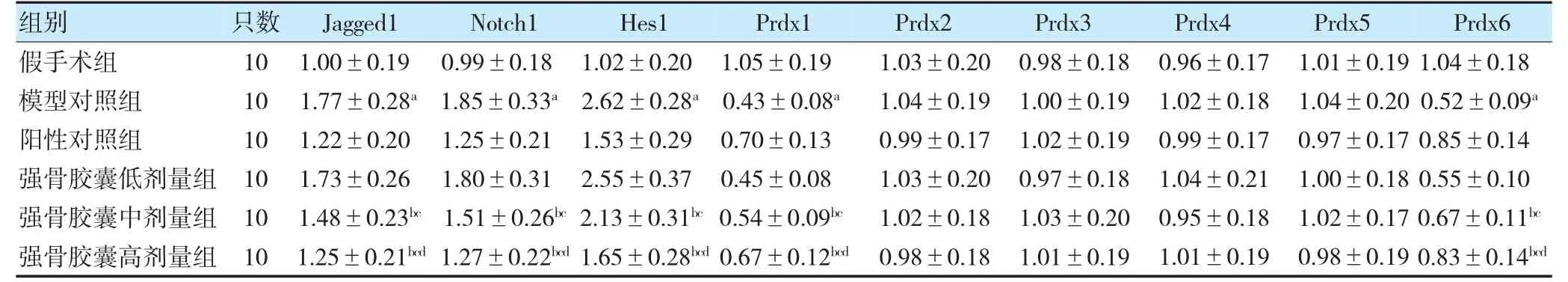
表6 各组大鼠PBMC 中Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平比较()
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。PBMC:外周血单个核细胞。
2.7 各组大鼠骨组织中Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平比较
与假手术组比较,模型对照组大鼠骨组织中Jagged1、Notch1、Hes1 mRNA 表达水平升高,Prdx1、Prdx6 mRNA 表达水平降低(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠骨组织中Jagged1、Notch1、Hes1 mRNA 表达水平降低,Prdx1、Prdx6 mRNA 表达水平升高(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠骨组织中Jagged1、Notch1、Hes1 mRNA 表达水平降低,Prdx1、Prdx6 mRNA 表达水平升高(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠骨组织中Jagged1、Notch1、Hes1 mRNA 表达水平降低,Prdx1、Prdx6 mRNA 表达水平升高(P<0.05)。各组大鼠骨组织中Prdx2~5 mRNA表达水平比较,差异无统计学意义(P>0.05)。见表7。
表7 各组大鼠骨组织中Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平比较()
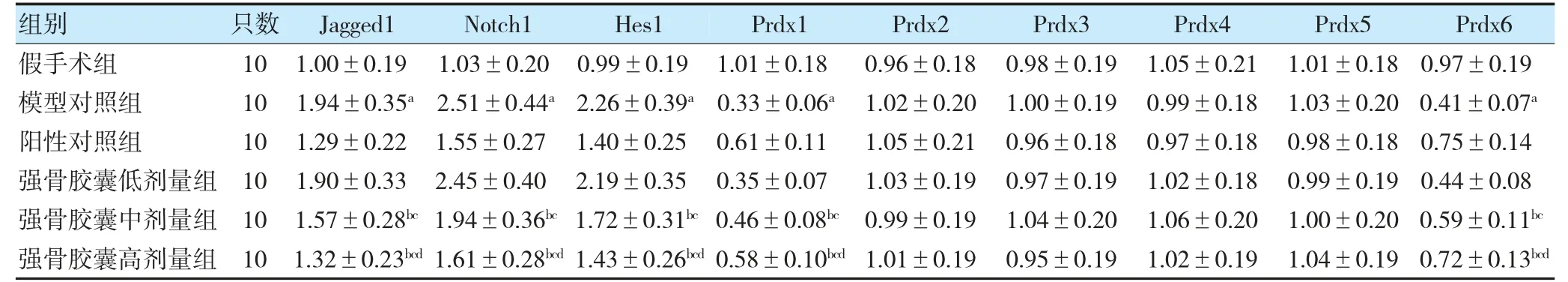
表7 各组大鼠骨组织中Jagged1、Notch1、Hes1 及Prdx1~6 mRNA 表达水平比较()
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。
2.8 各组大鼠骨组织中Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达水平比较
与假手术组比较,模型对照组大鼠骨组织中Jagged1、Notch1、Hes1 蛋白表达水平升高,Prdx1、Prdx6蛋白表达水平降低(P<0.05);与模型对照组比较,强骨胶囊中、高剂量组大鼠骨组织中Jagged1、Notch1、Hes1 蛋白表达水平降低,Prdx1、Prdx6 蛋白表达水平升高(P<0.05);与强骨胶囊低剂量组比较,强骨胶囊中、高剂量组大鼠骨组织中Jagged1、Notch1、Hes1 蛋白表达水平降低,Prdx1、Prdx6 蛋白表达水平升高(P<0.05);与强骨胶囊中剂量组比较,强骨胶囊高剂量组大鼠骨组织中Jagged1、Notch1、Hes1 蛋白表达水平降低,Prdx1、Prdx6 蛋白表达水平升高(P<0.05)。各组大鼠骨组织中Prdx2~5蛋白表达水平比较,差异无统计学意义(P>0.05)。见图2、表8。

图2 各组大鼠骨组织Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达
表8 各组大鼠骨组织Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达水平比较()

表8 各组大鼠骨组织Jagged1、Notch1、Hes1 及Prdx1~6 蛋白表达水平比较()
注 与假手术组比较,aP<0.05;与模型对照组比较,bP<0.05;与强骨胶囊低剂量组比较,cP<0.05;与强骨胶囊中剂量组比较,dP<0.05。
3 讨论
PMOP 是一种绝经后中老年女性中的常见疾病,目前临床上PMOP 的治疗主要以双膦酸盐、激素类似物等药物为主,但尚无根治PMOP 的方法[10]。强骨胶囊能够有效地调节骨代谢并改善骨组织结构,从而发挥抗骨质疏松症的作用[11],然而其治疗PMOP 的分子生物学机制尚不清楚,鉴于此本研究选用强骨胶囊探究其治疗PMOP 的作用机制。
骨质疏松的发生与氧化应激关系密切[12],雌激素有显著抗氧化作用,由于绝经后女性体内雌激素水平下降,机体长期处于氧化应激状态,导致大量的活性氧生成并累积在体内,从而损伤骨质并引起基质重塑,最终诱发PMOP,因此改善机体氧化应激是治疗PMOP 的关键所在[13-14]。MAOA 是一类催化单胺类物质氧化脱氨反应的酶,其水平的高低反映了机体的氧化应激水平[15];AOPP 具有高蛋白氧化敏感性,是蛋白质氧化的特异性标志之一[16-17];T-AOC 是反映机体抗氧化能力总和的重要指标;SOD 是机体内重要的抗氧化酶,机体清除活性氧的重要因子[18]。研究显示[19-20],绝经后雌激素水平的降低可通过介导TNF-α、IL-1β、IL-6、IL-17 等一系列炎症细胞因子的分泌,促进破骨细胞增殖和分化,打破骨形成与骨吸收的平衡,导致PMOP。甘东浩等[21]研究指出,骨碎补可通过改善氧化应激调控骨质疏松患者成骨细胞、破骨细胞增殖分化从而发挥抗骨质疏松的作用。本研究结果显示,与假手术组比较,PMOP 大鼠BMD 值降低、骨小梁数量减少,血浆中炎症标志物水平升高,氧化应激标志物MAOA、AOPP 水平升高,T-AOC 和SOD 水平降低。经强骨胶囊治疗后,大鼠BMD值升高、骨小梁数量增多,血浆中炎症标志物水平降低,氧化应激标志物MAOA、AOPP 水平降低,T-AOC 和SOD 水平升高,其中低剂量强骨胶囊对上述指标无明显改善,中、高剂量强骨胶囊效果明显。提示一定剂量的强骨胶囊能改善PMOP 大鼠BMD 值和骨组织病理学改变,抑制机体氧化应激和炎症反应。
Notch 信号通路通过调控细胞增殖、分化和凋亡等多种生物学过程参与疾病的发生发展[22]。近年来发现[23],Notch1 为Notch 通路最重要的受体之一,Notch1可通过其与上游配体Jagged1 特异性结合激活Notch信号通路及其下游靶基因Hes1,进而启动一系列级联式信号反应,促进破骨细胞的成熟和分化,抑制成骨细胞介导的骨形成和骨矿物质沉积[24]。Prdxs 蛋白家族是一组抗氧化蛋白,在机体内发挥清除自由基、保护机体免受氧化应激损伤的作用[25]。黄翔宇等[26]研究显示,强骨胶囊的主要成分骨碎补总黄酮可通过抑制Notch 信号通路改善骨质疏松的临床症状。本研究结果显示,与假手术组比较,PMOP 大鼠血浆、PBMC及骨组织中Jagged1、Notch1、Hes1 mRNA 表达水平升高,Prdx1、Prdx6 mRNA表达水平降低,Prdx2~5 mRNA无明显变化,经强骨胶囊治疗后,大鼠血浆、PBMC 及骨组织中Jagged1、Notch1、Hes1 mRNA表达水平降低,Prdx1、Prdx6 mRNA 表达水平升高,其中低剂量强骨胶囊对上述指标无明显改善,中、高剂量强骨胶囊效果明显。推测强骨胶囊可能是通过抑制Notch1-Hes1-Prdx 信号通路下调Jagged1、Notch1、Hes1 表达,上调Prdx1、Prdx6 表达,增强机体抗氧化应激能力并改善炎症反应发挥抗骨质疏松作用,Prdx2~5 在该过程中可能不发挥作用。
综上所述,强骨胶囊可能是通过抑制Notch1-Hes1-Prdx 信号通路下调Jagged1、Notch1、Hes1 表达,上调Prdx1、Prdx6 表达,增强机体抗氧化应激能力并改善炎症反应发挥抗骨质疏松作用。本研究通过动物体内实验初步阐释了强骨胶囊对PMOP 的治疗作用及机制,为强骨胶囊用于PMOP 的临床治疗提供了实验依据。

