叉头框蛋白P3 阳性调节性T 细胞和程序性死亡受体1/ 程序性死亡受体配体1 通路在早期胃癌中的表达及相关性分析
秦玉翠 夏 芸
1.南京市浦口区中医院健康管理中心,江苏南京 211800;2.南京市浦口区中医院脾胃科,江苏南京 211800
胃癌是全球最常见的恶性肿瘤之一[1-2],一般的早期胃癌患者无明显症状,而当患者出现明显症状时多为进展期胃癌,其恶性程度较高,且往往伴有转移倾向。调节性T 细胞(regulatory T cells,Tregs)是一类控制体内自身免疫反应性的T 细胞亚群[3],也是近年来的研究热点。叉头框蛋白P3(forkhead box protein P3,FOXP3)是目前检测Tregs 表达及功能的精准分子之一,在免疫抑制方面起重要作用[4]。有研究显示,在胃癌患者外周血中Tregs 数目显著增加[5],提示靶向Tregs 可能是未来治疗胃癌的新策略[6]。程序性死亡受体1(programmed death-1,PD-1)是一种抑制免疫应答激活的关键分子。PD-1 与其配体(programmed death-ligand 1,PD-L1)相互作用能够导致激活的T细胞发生凋亡从而发挥自生免疫抑制效应[7]。PD-1 在卵巢癌、胰腺癌和结直肠癌等多种肿瘤组织的肿瘤浸润淋巴细胞中呈高表达状态[8-10]。目前,PD-1/PD-L1与FOXP3+Tregs 在早期胃癌组织中的表达情况尚少见报道。因此,本研究主要针对PD-1/PD-L1 与FOXP3+Tregs 在早期胃癌组织中的表达情况进行考察,为临床胃癌的早期诊断和抗肿瘤免疫治疗策略提供参考。
1 资料与方法
1.1 一般资料
收集2020 年10 月至2022 年6 月南京市浦口区中医院(以下简称“我院”)收治的胃癌初治患者10例为早期胃癌组,均无自身免疫性疾病和任何抗癌治疗史,所有纳入患者均经病史、临床特征、胃镜检查和组织病理学检查确诊为早期胃癌。另选取我院10 例慢性胃炎患者作为对照组。纳入标准:①临床、病理等相关资料完整;②病理检查证实为早期胃癌或慢性胃炎。排除标准:①术前曾接受过化学药物治疗;②术后病理证实为多灶性病变;③残胃癌。本研究经我院伦理委员会批准(20220082)。
1.2 主要试剂与仪器
FOXP3 抗体购自Invitrogen 公司(货号:13-4776-82);PD-1 抗体购自CellSignalingTechnology 公司(货号:86163);PD-L1 抗体均购自abcam 生物技术有限公司(货号:ab279292);荧光二抗均购自Proteintech 生物技术有限公司(货号:SA00003-11、SA00009-2、SA00007-1);病理切片机购自徕卡公司(型号:LeiCA RM2016);荧光全扫仪购自匈牙利3DHISTECH Lt 公司(型号:Pannoramic MIDI)。
1.3 组织免疫荧光染色
采用4%的多聚甲醛对样本进行固定,两组胃黏膜组织经石蜡包埋后切片,将石蜡切片置于68℃的烘箱中加热20 min;脱蜡脱水:二甲苯脱蜡,酒精梯度脱水,3%H2O2,37℃孵育10 min,蒸馏水冲洗3 次。抗原修复:将切片置于含EDTA 的抗原修复缓冲液中于微波炉内,中火加热8 min 后冷却8 min,再次中低火加热7 min,冷却后置于PBS 中洗涤3 次。封闭:滴加3%的BSA 孵育30 min;滴加适量一抗(稀释倍数:FOXP3 为1∶150;PD-1 为1∶250 稀释;PD-L1 为1∶200)于湿盒内4℃过夜;滴加适量二抗(稀释倍数:1∶200),室温避光孵育50 min;DAPI 染核:滴加适量DAPI 溶液,室温孵育10 min;将玻片用抗荧光淬灭封片剂封片,4℃避光保存待测或直接上机检测。
1.4 组织免疫荧光染色结果的判定标准
细胞浆、细胞核和/或细胞膜出现绿色(FOXP3+Tregs)/粉色(PD-1)/红色(PD-L1)即判定为阳性。采用PANNORAMIC 全景切片扫描仪对切片进行拍摄,通过CaseViewer 2.4 软件,在100~400 任意倍数下进行观察,通过计算阳性表达面积与组织面积的占比得出FOXP3+Tregs、PD-1 和PD-L1 的阳性表达率。
1.5 统计学方法
采用SPSS 21.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验。采用Pearson 相关系数分析相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组胃黏膜组织FOXP3+Tregs 表达情况比较
对照组胃黏膜组织中几乎无绿色荧光,而早期胃癌组存在明显绿色荧光。早期胃癌组Foxp3+Tregs 表达水平均高于对照组,差异有高度统计学意义(P<0.01)。见图1。

图1 两组胃黏膜组织FOXP3+Tregs 表达情况比较
2.2 两组胃黏膜组织PD-1/PD-L1 表达情况比较
对照组胃黏膜组织中几乎无粉色或红色荧光,而早期胃癌组存在明显粉色或红色荧光。早期胃癌组PD-1、PD-L1 表达水平均高于对照组,差异有统计学意义(P<0.01 或P<0.05)。见图2。
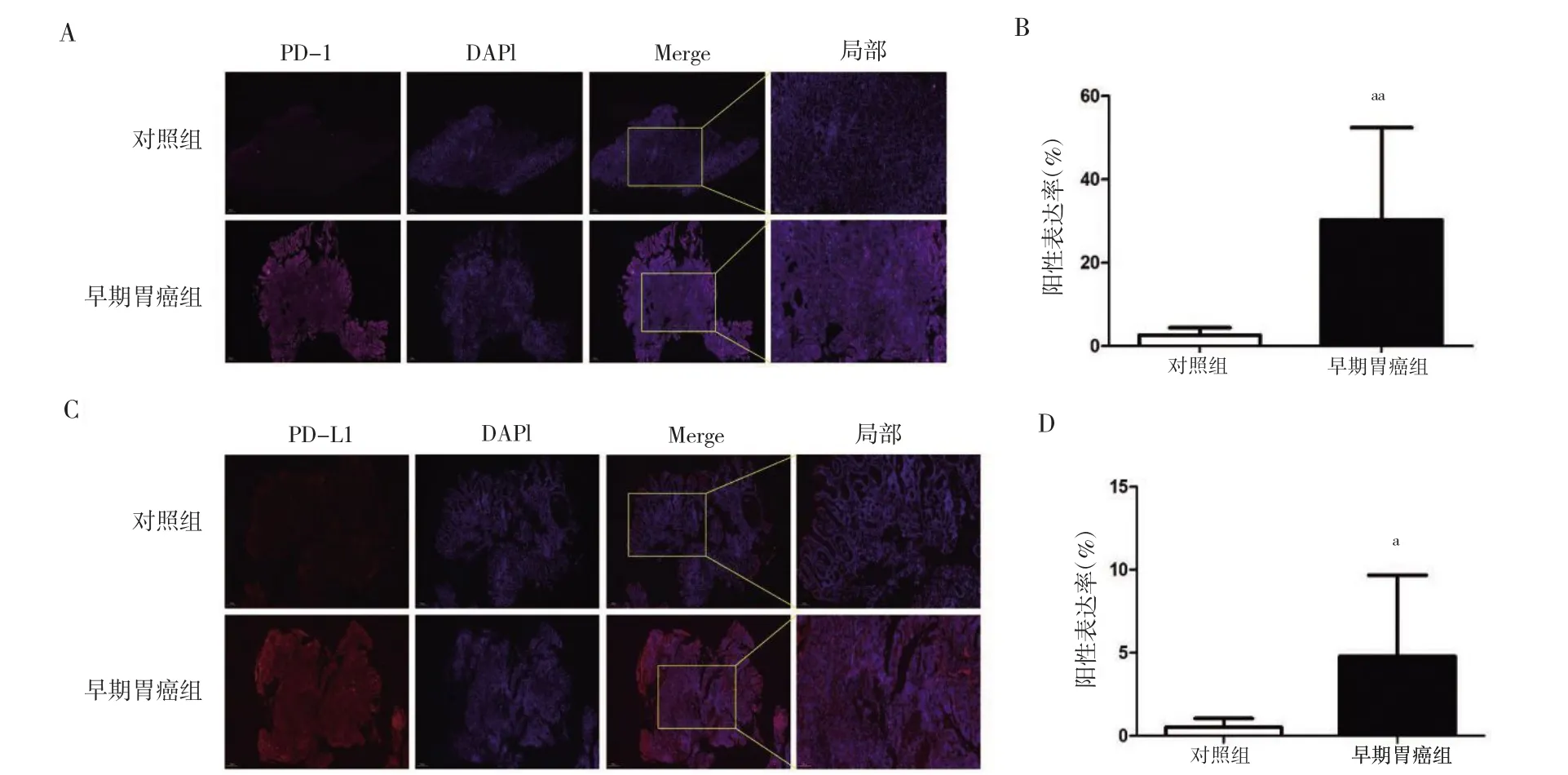
图2 两组胃黏膜组织PD-1/PD-L1 表达情况比较
2.3 早期胃癌患者胃黏膜组织中FOXP3+Tregs 与PD1/PDL1 表达的相关性
早期胃癌患者胃黏膜组织中FOXP3+Tregs 与PD-1(r=0.841 3,P=0.002)、PD-L1(r=0.995 2,P<0.001)表达水平呈正相关。见图3。
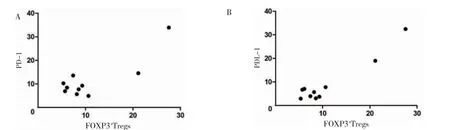
图3 早期胃癌患者胃黏膜组织中FOXP3+Tregs 与PD1/PDL1 表达的相关性
3 讨论
3.1 FOXP3+Tregs 在早期胃癌患者组织中的表达及意义
目前,治疗胃癌的手段主要以手术、放化疗、靶向药和免疫疗法为主,虽然在一定程度上可缓解患者的疾病进程,但病死率仍居高不下[11-14],这可能与胃癌初期患者无明显症状,易误诊为上消化道溃疡相关。因此,在临床上寻找早期胃癌的生物标志物,阻遏胃癌的进一步恶化,提升患者的生存率具有重要意义。
FOXP3 是Tregs 的标记分子,对其发育、分化和功能维持具有重要作用[15]。FOXP3+Tregs 数目及比例在肿瘤患者中明显升高,其升高可导致患者自身免疫效应T 细胞对肿瘤产生免疫耐受,预后不良[16]。在肿瘤的进程中,大量活化的Tregs 可增加机体过度的免疫应答,从而为肿瘤的免疫逃逸提供便利条件[17]。研究显示,胃癌患者外周血中Tregs 比例显著增高,将原发性肿瘤切除后,患者机体内Tregs 数目明显下降[18]。当肿瘤复发时,Tregs 数目及比例明显上调[19-20],提示Tregs 比例对胃癌病程及预后的判断具有重要意义。目前,在早期胃癌患者中Tregs 数目的变化尚少见报道,本研究显示,在早期胃癌患者Tregs 数目就已明显增加,提示其可作为早期胃癌患者诊断的生物学指标。
3.2 PD-1/PD-L1 通路在早期胃癌患者组织中的表达及意义
PD-L1 可诱导能诱导幼稚CD4+T 细胞向Tregs分化,从而发挥抑制T 细胞的增殖、分化及分泌细胞因子等效应[21-22]。对PD-1 或PD-L1 进行沉默或干扰后,效应T 细胞的抗肿瘤效果明显提升,这可能与抑制肿瘤细胞增殖作用相关[17,23-24]。研究显示,在转移性黑色素瘤、结直肠癌、非小细胞肺癌、前列腺癌及肾癌患者中采用PD-1 抗体间歇性治疗均表现出较好的抗肿瘤效应[25-28]。本研究结果显示,PD-1/PD-L1 在早期胃癌组织中即已呈现高表达状态,提示在胃癌的早期阶段对PD-1/PD-L1 通路进行阻断,可能是一种有效的抗肿瘤免疫治疗手段。
PD-1/PD-L1 通路活化后能够诱导FOXP3 的表达,而阻断PD-1/PD-L1 信号后FOXP3+Tregs 的增殖作用明显被抑制[29-30]。本研究结果显示,FOXP3+Tregs数目及比例和PD-1/PD-L1 的蛋白表达在早期胃癌组织中均显著升高,且两者呈正相关,提示早期胃癌组织中PD-1/PD-L1 通路活化可能参与调节FOXP3+Tregs 的分化和负向调控免疫功能。
综上所述,早期胃癌组织中存在FOXP3+Tregs 和PD-1/PD-L1 共同表达,提示联合二者可为临床早期胃癌患者结果的判定提供重要参考。然而,肿瘤微环境中PD-1/PD-L1 通路对FOXP3+Tregs 调节的作用机制尚未明确,PD-1/PD-L1 信号是否直接介导FOXP3的表达仍有待进一步研究。

