HRT-FET 中雌激素应用天数对妊娠结局的影响
潘正美,吴妍芝,李 艳,赵怡越,胡 希,刘 洋
(昆明医科大学第二附属医院 生殖医学科,云南 昆明 650101)
辅助生殖技术(assisted reproductive technology,ART)是目前临床上治疗不孕症的主要手段。冻融胚胎移植(frozen-thawed embryo transfer,FET)是指将在ART 周期中获得的优质胚胎进行冷冻保存,以便进行下一次移植,减少控制性超促排卵(controlled ovarian hyperstimulation,COH)的次数,提高累积妊娠率,同时减少卵巢过度刺激综合征的发病率,并为胚胎植入前遗传学检测的实施预留时间[1-3]。近10 a 来,随着胚胎玻璃化冷冻技术的发现,胚胎的存活率和FET 的妊娠率得到极大提高[4]。FET 已越来越多地应用于ART 中。
研究表明,子宫内膜容受性是除了胚胎质量以外影响胚胎移植结局的最重要因素[5-6],尤其是在FET 周期。因此,通过改善子宫内膜容受性对提高妊娠率尤为重要。近年来,采用转录组测序技术(RNA-seq)评估子宫内膜容受性,协助判断种植时间窗,指导胚胎移植时间受到广泛关注,但其费用昂贵,且为侵袭性操作,其结果用来指导下一次月经周期的移植时间窗是否准确尚不清楚[7]。因此,目前临床上检测子宫内膜容受性最常用的方法是通过阴道超声检查综合评估子宫内膜的厚度、分型和子宫动脉血流来判断种植时间窗。大量研究表明,子宫内膜厚度是影响胚胎移植成功的主要因素之一,因此,选择最佳的子宫内膜准备方案以便有效促进子宫内膜增殖对于提高FET 的妊娠率尤为重要。
目前冻融胚胎移植技术的子宫内膜准备方案主要包括自然周期、激素替代周期(hormone replacement therapy,HRT)、促排卵周期[8],虽然缺乏高质量证据明确FET 周期最佳的子宫内膜准备方案,但无论何种内膜准备方案,确保胚胎与子宫发育的同步性是移植成功的关键。HRT 是指通过补充外源性雌激素和孕激素来促进子宫内膜的增长和转化,寻找种植时间窗。因HRT 周期具有就诊次数少,移植时间灵活,患者依从性高,近年来在临床中得到广泛应用[9]。研究表明在HRT 周期中,应该模拟28 d 正常月经周期内激素变化,在早卵泡期给予补充外源性雌激素,持续约14 d 左右,以达到促进子宫内膜增生的目的,当内膜厚度超过8 mm,另外补充孕激素使子宫内膜在雌激素和孕激素共同作用下向分泌期转化。对于薄型子宫内膜的患者,可以采用增加雌激素使用剂量和延长使用时间使内膜增长。但是目前,最佳雌激素应用时长和剂量需要进一步研究,且超生理剂量的雌激素是否影响子宫内膜容受性及妊娠结局,目前还没有确切结论。有研究表明,雌激素暴露时间控制在12~19 d,少于12 d 或超过19 d 妊娠率均会下降[10]。本中心HRT 周期雌激素的使用时间分布在10~28 d,因此本研究将1 348 个周期HRT-FET 的数据按照雌激素的使用天数分为4 组:A 组(≤12 d),B 组(13~16 d),C 组(17~20 d),D 组(> 20 d),探讨雌激素应用天数对HRT-FET 周期妊娠结局的影响。
1 资料与方法
1.1 研究对象
收集在昆明医科大学第二附属医院生殖医学科 从2017 年01 月 至2020 年12 月应用HRTFET 治疗患者的临床资料,根据纳入及排除标准,共纳入1 348 个周期。
纳入标准:(1)取卵年龄≤40 岁;(2)接受FET 的患者;(3)使用HRT 周期准备内膜;(4)HRT 方案中采用补佳乐准备内膜;(5)每周期至少有一枚优质胚胎。
排除标准:(1)夫妻任何一方染色体异常;(2)子宫畸形、重度宫腔粘连等解剖异常;(3)BMI≥30 kg/m2;(4)采用降调+HRT 周期准备内膜;(5)反复流产和反复种植失败;(6)自身免疫性疾病。
1.2 方法
纳入的周期根据患者内膜转化前补佳乐使用天数分为4 组:A 组(≤12 d),B 组(13~16 d),C 组(17~20 d),D 组(> 20 d)。
1.3 HRT 周期子宫内膜准备
对于纳入研究准备进行冷冻胚胎移植的患者,在月经周期的第2~4 天予以口服戊酸雌二醇片(4~6 mg/d,补佳乐,拜耳,德国),连续口服10 d 后,检测患者性激素水平,并通过阴道超声检查子宫内膜厚度,根据患者的雌激素及子宫内膜厚度对补佳乐用量进行调整。当子宫内膜厚度≥8 mm 时,给予黄体酮转化内膜并安排冻融胚胎移植时间。所有胚胎均采用玻璃化冷冻复苏,每周期至少有一枚优质胚胎。移植后继续原剂量口服补佳乐,并补充外源性孕激素进行黄体支持治疗。
1.4 妊娠结局判定
在胚胎移植后14 d 检测血清β-人绒毛膜促性腺激 素(β-HCG),β-HCG 大 于10 U/L 为HCG 阳性;FET 后30 d 行经阴道超声检查,超声下见妊娠囊诊断为临床妊娠;早期流产定义为妊娠12 周以前宫内妊娠终止;异位妊娠为胚胎种植在子宫腔外并发育;妊娠28 周后分娩一名或多名活婴儿则为活产;早产定义为妊娠37 周前分娩;低出生体重儿为新生儿出生体重小于10 个百分位。
1.5 比较项目
比较4 组患者的一般特征(主要包括不孕年限、取卵年龄、BMI、AMH、内膜转化日子宫内膜厚度、内膜转化日血清E2水平、内膜转化日血清孕酮水平等)和妊娠结局(包括HCG 阳性率、临床妊娠率、异位妊娠率、早期流产率、活产率、单胎早产率、单胎低出生体重儿率等)。
1.6 统计学处理
采用SPSS26.0 软件分析,计量资料以均数±标准差()表示,并通过单因素方差分析对多组间进行比较。分类资料采用百分率(%)表示,多组组间比较采用χ2检验。P< 0.05 表示差异具有统计学意义。
2 结果
总共分析了1 348 个周期,根据患者内膜转化前补佳乐使用天数分为A 组(≤12 d,n=165 例),B 组(13~16 d,n=672 例),C 组(17~20 d,n=430 例),D 组(> 20,n=81 例)。
2.1 4 组基本情况的比较
A、B、C、D 4 组患者临床特征比较,取卵年龄、不孕年限、BMI、AMH 比较均无显著性统计学差异(P> 0.05),见表1。
表1 4 组患者的基线资料()Tab.1 Baseline characteristics of the four groups patients()
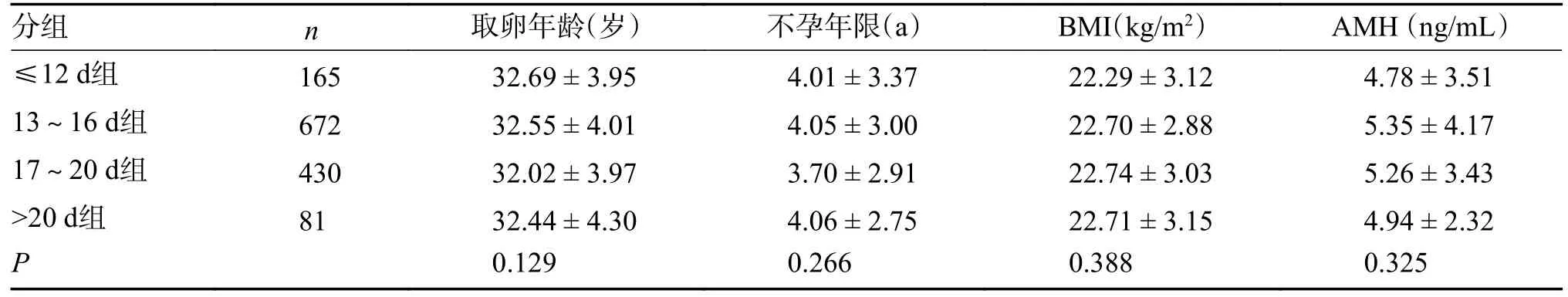
表1 4 组患者的基线资料()Tab.1 Baseline characteristics of the four groups patients()
2.2 4 组移植情况的比较
A、B、C、D 4 组患者移植情况比较,内膜转化日的子宫内膜厚度、雌激素水平比较具有统计学差异(P< 0.05),其中A 组的子宫内膜厚度最高,其他组依次递减,A 组的雌激素水平最低,其他组依次递增,见表2。
表2 4 组移植情况的比较()Tab.2 Embryo parameters of the four groups patients()
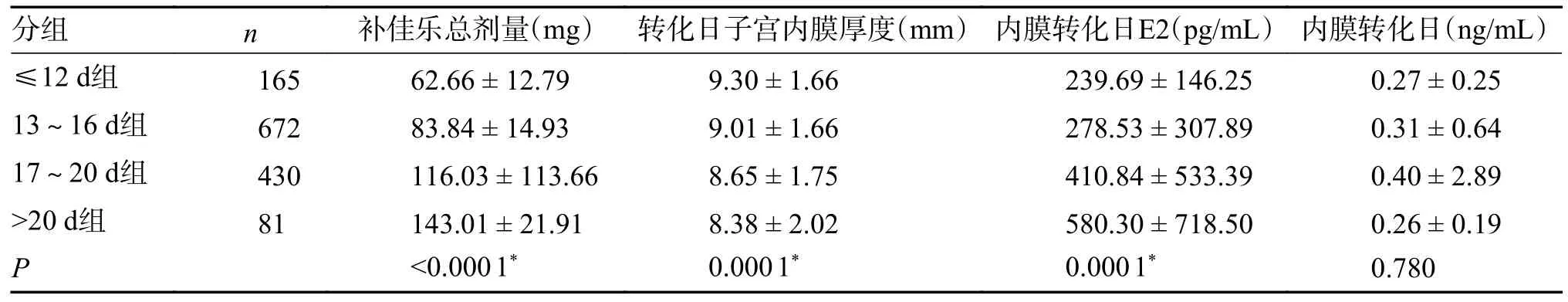
表2 4 组移植情况的比较()Tab.2 Embryo parameters of the four groups patients()
*P < 0.05。
2.3 4 组妊娠结局的比较
A、B、C、D 4 组妊娠结局比较,HCG 阳性率、临床妊娠率、异位妊娠率、早期流产率、活产率、单胎早产率、单胎低出生体重儿率比较均无显著性差异(P> 0.05),见表3。
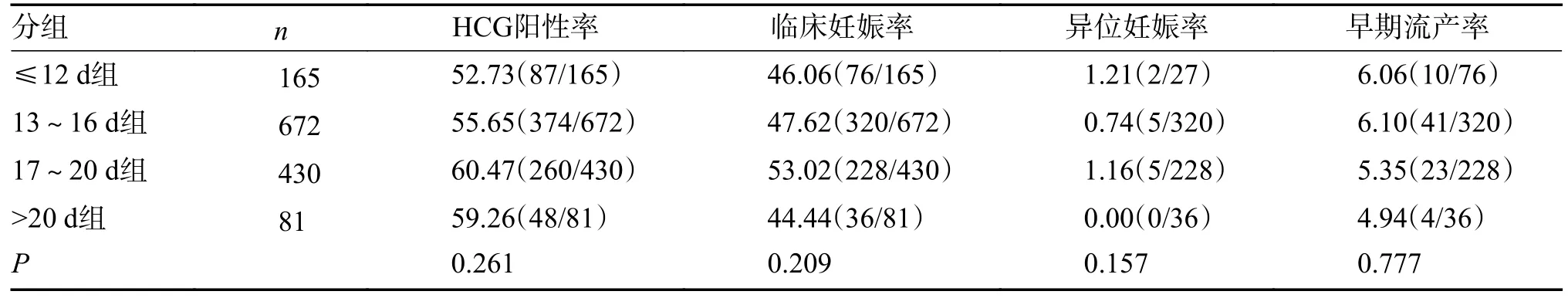
表3 4 组妊娠结局的比较(%)(1)Tab.3 Clinical outcomes of the four groups(%)(1)
3 讨论
自从1984 年首例FET 成功,FET 得以快速发展,并随着胚胎冷冻保存技术的改进,目前在ART 得到广泛的应用[10]。FET 周期妊娠结局的影响因素有很多,其中胚胎与子宫内膜发育的同步性是胚胎着床成功的关键[11]。近年来,随着 COH 技术的完善和胚胎体外培养技术的改进,获得优质的胚胎不再是临床医生的主要困扰。因此,学者们将提高胚胎种植成功的关键锁定在改善子宫内膜容受性上。FET 中内膜准备方案是影响子宫内膜和胚胎同步发育的重要因素。然而FET 的最佳子宫内膜准备方案需要进一步研究。HRT 周期因方法简单、灵活,已经成为最常用的FET 方案[12]。在HRT 周期中,在通过大剂量补充外源性雌激素,使得子宫内膜上雌激素受体的数量增加,内膜的血管内皮生长因子表达上调,促进血管生成,改善内膜发育,从而提升胚胎种植率[13]。对于子宫内膜薄的FET 患者,临床上常采用超生理剂量的雌激素或延长雌激素的使用天数,使子宫内膜能达到可移植厚度[14-16]。但HET 周期最佳雌激素水平和应用时长,目前没有确切的结论。
本研究发现,A、B、C、D 4 组患者内膜转化日的子宫内膜厚度、雌激素水平比较具有统计学差异(P< 0.05),其中A 组的子宫内膜厚度最高,其他组依次递减。A 组的雌激素水平最低,其他组依次递增。四组患者HCG 阳性率、临床妊娠率、异位妊娠率、早期流产率、活产率、单胎早产率、单胎低出生体重儿率,均无显著性差异(P> 0.05)。结果提示,使用HRT-FET 周期准备内膜,对于子宫内膜较薄的患者,或许可以延长雌激素应用时长可以改善子宫内膜,达到与正常子宫内膜厚度相类似的妊娠结局。Ying 等[17]通过研究接受固定雌激素剂量组和增加剂量组的妊娠结局,发现与固定剂量组相比,增加剂量组延长雌激素使用时间,其子宫内膜仍较薄,但是两组的妊娠率相似,这提示笔者是否薄型子宫内膜的患者可以通过延长雌激素的使用时间来提高妊娠率。
适度的雌激素水平是胚胎的植入成功所必须的。但有学者发现,暴露于高雌激素水平下会使子宫内膜容受性降低,降低临床妊娠率。在超高雌激素水平状态,子宫内膜的血流流量减少,并抑制胚胎着床和滋养细胞入侵[18]。Bourdon 等[19]研究发现,延长E2暴露会显着降低冻融囊胚移植后的活产率,他们发现当冻融囊胚移植前的E2暴露超过28 d 时,活产率显着下降。闫娅妮等[20]发现,使用雌激素天数超过28 d 的患者与21 d 以内相比,临床妊娠率明显下降,流产率随着雌激素时间的延长呈上升趋势。在笔者的研究中,虽然四组患者HCG 阳性率、临床妊娠率、活产率并无统计学差异,但是A 组(≤12 d)和D 组(>20 d)的HCG 阳性率、临床妊娠率、活产率均低于B组(13~16 d)、C(17~20 d 组)2 组,而统计结果无显著性差异可能与样本量受限有关,若加大样本量,同时考虑内膜生长不良而取消移植的周期,可能研究结果的差异性会比较明显[21]。
HRT-FET 周期血清E2水平是否对FET 结局有影响尚为达成共识。在自然周期中,笔者发现雌激素水平在促卵泡素作用下逐渐升高,并促进卵泡发育成熟,当雌激素达到200 pg/mL 以上至少50 h 促发LH 高峰诱发排卵,随后雌激素水平开始下降[18,22]。因此,在HRT 周期中,笔者使用激素递增方案尽可能地模拟这一生理过程,使得HRT 周期的患者血清E2浓度能够达到自然周期的正常雌激素水平。但实际上,HRT 周期患者血清雌激素浓度通常高于自然周期雌激素的生理水平,且高血清雌激素水平对妊娠结局的影响尚未明确,雌激素应该维持在怎样的水平仍存在争议。在一些研究中,血清高E2水平能够提高胚胎种植率,但Kong 等[22]研究却提示,高水平E2可能与胚胎移植失败有关,当血清E2水平大于300 pg/mL 时,患者临床妊娠率显着下降,当血清E2水平大于1 400 pg/mL 与临床妊娠率无相关性。然而,在笔者的研究中,四组患者的内膜转换日的雌激素水平不同其妊娠结局没有差异,Boynukalin 等[24]的研究结果也证实这一点。目前大多数研究并没有得出HRT 周期是否存在雌激素水平的上限的确切结论。但是结合既往的研究,过高的血清雌激素水平可能影响子宫内膜的容受性和胎盘形成,从而导致胚胎种植率下降和不良产科结局。在笔者的研究中,D 组(>20 d)的单胎早产率和单胎低出生儿体重率均高于其他3 组,虽然结果并无统计学差异。所以作者合理推测,在HRT-FET 周期,过高的雌激素水平可能对子宫内膜产生不利影响,降低临床妊娠率,增加不良产科结局风险,因此,超生理剂量的雌激素水平可能成为不良妊娠结局的一个预测指标[23]。当然,其预测结果的准确性还需要大样本研究进行验证。
综上所述,延长雌激素应用天数,在一定的成度上可以增加内膜增长不良患者的子宫内膜厚度,达到和正常内膜患者相似的妊娠结局,但是过长时间的雌激素暴露,可能降低子宫内膜的容受性,还会增加不良产科结局风险。此外,还加大了患者的经济负担。最后,过长时间的雌激素暴露是否造成不良的妊娠结局,还需要大样本前瞻性研究进一步验证。

