加味丹玄口康对大鼠口腔黏膜下纤维化及其自噬水平的影响
贺 珺 张 婷 胡 亮 潘世杰 邹 红 连科荃 谭 劲 胡兆勇▲
1.湖南中医药大学医学院,湖南长沙 410208;2.湖南中医药大学第一附属医院口腔科,湖南长沙 410007
口腔黏膜下纤维化(oral submucosal fibrosis,OSF)是常见的慢性口腔黏膜炎症性疾病,为癌前病变之一,1.2%~23.0%的OSF 患者会发展为口腔鳞状细胞癌,其主要病因是长期咀嚼槟榔[1-2]。近年来,随着槟榔产业的急速扩张和咀嚼槟榔流行范围的迅速扩大,OSF及其癌变患者的绝对数量剧增,并向低龄人群蔓延,成为严重的社会公共卫生问题[3]。因此,探究OSF 的发病机制及寻找干预OSF 的有效方法具有重要意义。自噬是一种自我降解过程,指细胞利用溶酶体降解自身受损的细胞器和蛋白质的生命现象[4-5]。自噬被认为是细胞外基质沉积、组织重塑和纤维形成的重要调节因子,在多种器官纤维化疾病中起着关键作用,参与肺、肝、肾纤维化等疾病[6-9],且研究表明自噬可能与OSF 密切相关,但其具体作用仍有待进一步阐明[10]。因此,本课题组对大鼠OSF 的自噬水平进行探究。目前关于OSF 尚无标准化的治疗方案[11],本课题组前期研究发现,王宗康等[12]在古方桃红四物汤基础上加减的加味丹玄口康可有效干预OSF,阻碍OSF 发展及癌变,但关于加味丹玄口康是否通过调节自噬水平干预OSF 的研究尚少见报道。因此,本研究通过建立OSF 大鼠模型,探讨加味丹玄口康干预OSF 是否与调控大鼠口腔黏膜的自噬程度有关,为临床应用加味丹玄口康治疗OSF 提供新的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选取SPF 级SD 雄性大鼠24 只,4~8周龄,体重180~200 g,由湖南中医药大学(以下简称“我校”)动物实验中心统一订购于湖南斯莱克景达实验动物有限公司,并饲养于我校动物实验中心无菌环境中,饲养温度为20~24℃,湿度为55%~65%,予光照12 h/d,健康状况良好,动物许可证号为SCXK(湘)2019-0004,动物检疫合格,质量合格证编号为43072722 1100100512。本研究由我校实验动物伦理委员会批准(LL2022011206)。
1.1.2 药物与主要试剂 加味丹玄口康颗粒:丹参10 g(批号:2017003C),玄参10 g(批号:2108005C),生地黄10 g(批号:2108020S),白芍10 g(批号:2105009S),生黄芪10 g(批号:2102003C),当归10 g(批号:2106029C),红花5 g(批号:2103003C),白花蛇舌草10 g(批号:2101001S),夏枯草10 g(批号:2109004S),茵陈10 g(批号:2108001C),薄荷10 g(批号:2102001C),桔梗10 g(批号:2107001S)均由湖南中医药大学第一附属医院提供;槟榔碱(批号:DST DQ009201)由成都德斯特生物公司提供;上皮钙黏素(批号:00092361)、微管相关蛋白轻链3Ⅰ/Ⅱ(light chain 3-Ⅰ/Ⅱ,LC3-Ⅰ/Ⅱ)一抗(批号:10021292)、选择性自噬接头蛋白p62 一抗(批号:00109471)由Proteintech 公司提供;细胞裂解液(批号:P0013)、山羊抗兔二抗(批号:ZK-0295G-SA)由Abiowell 公司提供。
1.2 实验方法
1.2.1 造模、给药和取材 将24 只大鼠采用随机数字表法分为空白组、模型组和加味丹玄口康组,每组8只。空白组不作干预,模型组和加味丹玄口康组建立OSF 模型:采用异氟烷麻醉大鼠,在大鼠双侧颊黏膜组织注射10 mg/ml 的槟榔碱0.2 ml,1 次/2 d,同时每日使用小牙刷沾取适量槟榔碱均匀施力刷大鼠双侧颊黏膜,持续8 周,观察到大鼠颊黏膜出现白色病变等确认造模成功[13-15]。前期研究表明,加味丹玄口康干预OSF 的有效剂量为8 ml/(kg·d),药物浓度为0.23 g/ml[12],造模成功后加味丹玄口康组给予该剂量加味丹玄口康灌胃,空白组和模型组每日给予等量生理盐水,1 次/d,持续4 周。给药结束后,使用2%戊巴比妥钠腹腔注射麻醉大鼠,取大鼠双侧颊黏膜组织,保存于4%多聚甲醛溶液、戊二醛溶液,于-80℃冰箱中待用。
1.2.2 大鼠口腔黏膜组织病理学检测 采用4%多聚甲醛溶液固定大鼠口腔黏膜组织、脱水、石蜡包埋、常规切片、烘干、再脱蜡,苏木精-伊红染色、Masson 染色后镜下观察三组口腔黏膜组织病理变化和胶原沉积情况。
1.2.3 透射电镜观察自噬小体 取大鼠颊黏膜组织,以2.5%戊二醛、25%锇酸分别固定2 h 后,脱水、包埋、切片,65℃条件下各聚合48 h 以上、3%醋酸铀-枸橼酸铅双染色,透射电镜下观察自噬小体。
1.2.4 免疫组织化学染色检测上皮钙黏素、LC3 阳性表达细胞 将大鼠口腔黏膜石蜡切片烤片后,进行梯度脱蜡,EDTA/柠檬酸盐修复,滴加过氧化酶阻断剂孵育10 min,PBS 洗涤后滴加5%BSA 封闭1 h,上皮钙黏素一抗(1∶2 000)、LC3 一抗(1∶300)孵育过夜,经PBS 洗涤,二抗孵育,滴加DAB 显色液显色,复染封片,显微镜下观察,Image J 软件对阳性信号定量分析。
1.2.5 Western blot 检测上皮钙黏素、LC3-Ⅱ、p62表达 剪取大鼠颊黏膜组织加入RIPA 裂解缓冲液和PMSF,冰上裂解、离心提取组织总蛋白,BCA 法检测蛋白浓度,经电泳分离后转移到PVDF 膜,5%脱脂牛奶封闭2 h,TBST 洗涤后分别加入上皮钙黏素(1∶5 000)、LC3-Ⅱ(1∶2 000)、p62(1∶2 000)、GAPDH(1∶10 000)相应一抗溶液中孵育4℃过夜,洗涤,加入二抗(1∶15 000)室温孵育2 h,TBST 洗涤后进行显影,凝胶图像仪观察并照相,Image J 软件分析条带灰度值。
1.2.6 RT-PCR 检测LC3-Ⅱ、p62 mRNA 表达 提取组织中总RNA,测定样本RNA 浓度,进行逆转录反应,获得模板cDNA,对目标基因进行扩增,取2×Novo-ScriptPlus 1st Strand cDNA Synthesis SuperMix 10 μl、gDNAPurge1μl、RNaseFreeWater 及模板RNA(0.1 ng~1.0 μg)配至20 μl,移液器轻轻混匀后短暂离心至离心管管底,反应程序为50℃反应15 min、85℃反应5 s。将合成的第一链cDNA 直接用于qPCR,2×NovoStartSYBR qPCR Super Mix Plus 10 μl,正向引物终浓度为0.2~1.0 μmol/L,反向引物终浓度为0.2~1.0 μmol/L,模板1~2 μl、ROX 0.4 μl,RNase Free Water 加至20 μl,两步法扩增程序,95℃1 min、35 次循环(95℃20 s,60℃1 min)。LC3-Ⅱ正向引物为5’-GATGTCCGACTTATTCGAGAGC-3’,片段长度为20 bp;反向引物为5’-TTGAGCTGTAAGCGCCTTCTA-3’,片段长度为22 bp。p62 正向引物为5’-ATCAGCTTCTGGTCCATCGG-3’,片段长度为20 bp;反向引物为5’-GCTTCTTTTCCCTGTGCT-3’,片段长度为20 bp。GAPDH 正向引物为5’-CAGGAGGCATTGCTGATGAT-3’,片段长度为20 bp;反向引物5’-GAAGGCTGGGGCTCATTT-3’,片段长度为20 bp。荧光定量PCR 仪检测荧光信号,以GAPDH 作为内参,采用2-ΔΔCt法计算目标基因mRNA 相对表达水平。
1.3 统计学方法
采用SPSS 22.0 统计学软件进行数据分析。计量资料采用均数±标准差(±s)表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 三组口腔黏膜组织病理观察
苏木精-伊红染色结果显示,空白组口腔黏膜结构正常;与空白组比较,模型组口腔黏膜上皮明显萎缩,胶原纤维显著变粗、增多,上皮钉突变平;加味丹玄口康组口腔黏膜上皮层较模型组增厚,胶原纤维减少。Masson 染色结果显示,空白组口腔黏膜上皮结构基本完整,胶原纤维沉积较少;与空白组比较,模型组大鼠口腔黏膜上皮萎缩,固有层内大量胶原纤维沉积,血管和细胞成分减少,固有层下出现肌组织萎缩;与模型组比较,加味丹玄口康组口腔黏膜上皮层萎缩程度减轻,胶原纤维明显减少。见图1~2。

图1 三组口腔黏膜组织苏木精-伊红染色(100×)

图2 三组口腔黏膜组织Masson 染色(100×)
2.2 三组口腔黏膜组织自噬小体比较
模型组自噬小体数量低于空白组,加味丹玄口康组自噬小体数量高于模型组,差异有统计学意义(P<0.05)。见图3~4。

图3 三组口腔黏膜组织自噬小体透射电镜图(整体:3 000×;局部:10 000×)

图4 三组口腔黏膜组织自噬小体数量比较(n=8)
2.3 三组口腔黏膜组织上皮钙黏素、LC3 阳性细胞数比较

图5 三组口腔黏膜组织免疫组织化学染色(400×)

图6 三组口腔黏膜组织上皮钙黏素、LC3 阳性细胞数比较(n=8)
模型组上皮钙黏素、LC3 阳性细胞数低于空白组,加味丹玄口康组上皮钙黏素、LC3 阳性细胞数高于模型组,差异有统计学意义(P<0.05)。见图5~6。
2.4 三组口腔黏膜组织上皮钙黏素、LC3-Ⅱ、p62 蛋白表达比较
模型组上皮钙黏素、LC3-Ⅱ蛋白表达低于空白组,p62 蛋白表达高于空白组,加味丹玄口康组上皮钙黏素、LC3-Ⅱ蛋白表达高于模型组,p62 蛋白表达低于模型组,差异有统计学意义(P<0.05)。见图7。
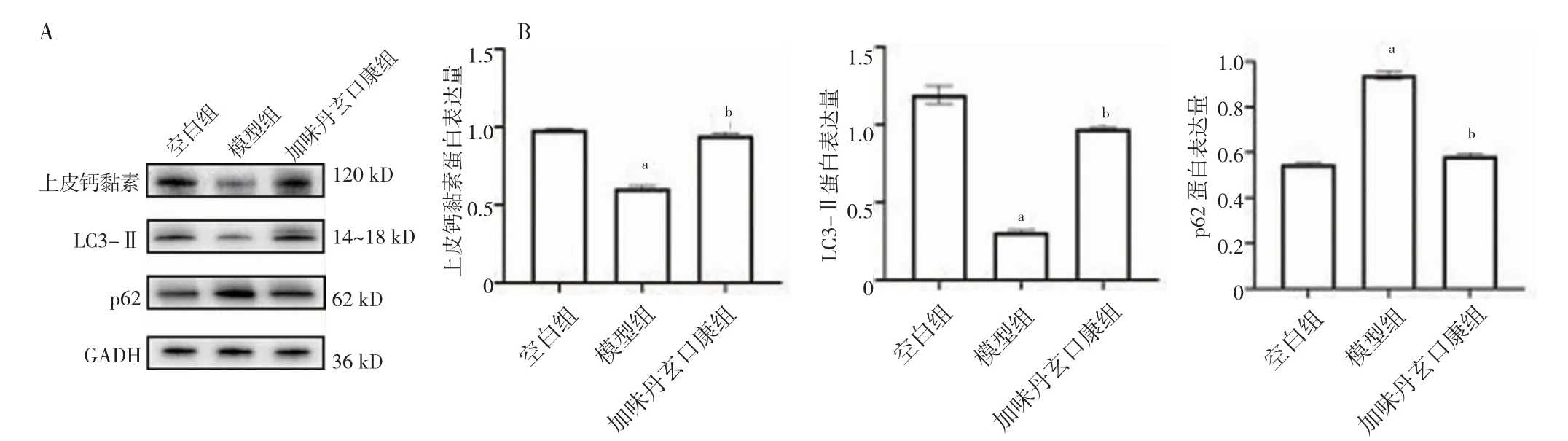
图7 三组口腔黏膜组织上皮钙黏素、LC3-Ⅱ、p62 蛋白表达比较(n=8)
2.5 三组口腔黏膜组织LC3-Ⅱ、p62 mRNA 表达比较
模型组LC3-ⅡmRNA 表达低于空白组,p62 mRNA 表达高于空白组,加味丹玄口康组中LC3-ⅡmRNA 表达高于模型组,p62 mRNA 表达低于模型组,差异有统计学意义(P<0.05)。见图8。

图8 三组口腔黏膜组织LC3-Ⅱ、p62 mRNA 表达比较(n=8)
3 讨论
自噬作为一种蛋白质和细胞器降解的细胞途径,与人类疾病有着密切联系[16-17]。临床一般认为自噬是机体的防御机制之一,可清除细胞内的有害物质和衰老、损伤的细胞器,消耗自身成分产生脂肪酸、氨基酸等,为处于饥饿状态的细胞提供能量,然而自噬也可能作为一种细胞死亡机制,通过调节细胞周期来抑制细胞增殖、促进细胞凋亡,具有复杂的双向作用[18-19]。LC3-Ⅱ可结合到胞内自噬体的膜上,其含量的多少与自噬泡数量呈正相关,在发生自噬时,p62 所形成的复合物在自噬溶酶体内被降解,因此组织整体的p62 水平与自噬水平呈负相关,这些蛋白可作为自噬水平的标志物[20-21]。
近年来,越来越多的研究表明,自噬影响肺、肾、肝等多种器官纤维化的发生发展,调控自噬成为减轻器官纤维化的一个潜在治疗靶点[7-9]。在肺纤维化患者组织中存在缺陷的自噬反应,抑制肺泡上皮细胞中的自噬可促进上皮间质转化,从而促进肺纤维化的发生[7]。在敲除自噬活性基因小鼠的肾纤维化研究中发现,下调自噬活性会导致阻塞肾脏的胶原沉积和成熟促纤维化因子水平增加,促进自噬可减轻细胞衰老从而抑制肾纤维化[8]。在肝纤维化中,肝星状细胞中的自噬可通过抑制纤维化细胞外囊泡的释放来减轻肝纤维化,但是当肝细胞过度自噬,如肝细胞发生自噬性细胞死亡和细胞焦亡,Hh 配体会被释放,肝星状细胞可能被Hh 信号激活,最终导致肝纤维化[9,22]。
OSF 研究中也存在相关报道,抑制自噬可改善由活性转化生长因子β 受体Ⅰ型信号传导诱导的纤维化,促进成纤维细胞凋亡、抑制其增殖,在OSF 中起重要作用[10]。以上研究表明,自噬可能与OSF 的发生发展密切相关。因此本研究通过建立OSF 大鼠模型,观察大鼠OSF病变,检测自噬相关表达因子来判断OSF与自噬的关系。本研究结果显示,与空白组比较,模型组口腔黏膜组织发生明显病变,胶原纤维大量沉积;自噬小体数量减少,上皮钙黏素、LC3-Ⅱ蛋白和LC3-ⅡmRNA 表达降低,p62 蛋白及其mRNA 表达升高,提示在OSF 大鼠口腔黏膜组织中自噬水平下降,自噬抑制可能在OSF 发生中具有一定作用,其具体机制有待进一步探究。
从中医辨证来看,OSF 多为嗜食辛辣刺激之品,湿热邪毒郁积局部,日久邪气由表及里,且自身正气不足,致局部气机不畅,血液运行受阻,气血瘀滞于口腔黏膜,加之邪毒蕴结不散,化痰,毒、虚、瘀、痰互结而发病[23-24]。针对OSF 病机的加味丹玄口康由丹参、玄参、当归、红花、生地、白花蛇舌草、夏枯草、生黄芪、薄荷、白芍等组成,其中丹参、当归、红花有活血祛瘀、通经止痛功效,白花蛇舌草、夏枯草有助于解毒散瘀,生黄芪、白芍可益气扶正,全方具备扶正活血祛痰解毒功效,对OSF 具有较好的干预效果[25-27]。且研究表明,丹参、当归、红花中的多种活性成分如丹酚酸A、当归多糖等在不同疾病中均可通过促进自噬发挥保护作用,抑制疾病进展[28-31]。在本研究中,对OSF 大鼠给予加味丹玄口康干预,结果显示,与模型组比较,加味丹玄口康组口腔黏膜上皮层增厚,胶原纤维沉积明显减少,自噬小体数量增多,上皮钙黏素、LC3-Ⅱ蛋白和LC3-ⅡmRNA 表达升高,p62 蛋白及其mRNA表达降低,提示加味丹玄口康可改善OSF,可能通过升高自噬水平发挥抑制大鼠OSF 的作用。
综上所述,OSF 大鼠口腔黏膜组织的自噬水平存在一定程度下降,加味丹玄口康可有效改善OSF,可能与升高自噬水平有关。然而本研究尚存在局限性,未完全明晰自噬在OSF 进展的不同时期所发挥的具体作用机制,以及加味丹玄口康影响自噬水平的具体调节机制未知,未来还需进行更多研究探讨。

