红和绿香椿芽贮藏过程中花青素和木质素含量及相关基因表达分析
赵 倩,朱顺华,蔡 霞,文晓鹏,谭国飞,孟平红*
(1 贵州大学 生命科学学院/农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,贵阳 550025;2 贵州省农业科学院园艺研究所/贵州省园艺工程技术研究中心,贵阳 550006;3 吉林农业大学 农学院,长春 130118)
香椿(ToonasinensisL.),是中国特有的木本蔬菜之一[1-2],富含多种营养与活性物质,具有抗氧化、抗癌、抗炎、降血糖等保健功效[3-4]。根据香椿嫩芽的颜色,可将香椿分为红香椿和绿香椿两大类[5]。新鲜香椿芽含水量高,采后新陈代谢旺盛,在室温下不耐贮藏,采后贮藏过程中紫红色逐渐变为深绿色[6],且极易发生萎焉、腐烂、褐变及木质化等现象,货架期短,严重影响了香椿的商品和经济价值[7]。
低温贮藏是果蔬贮藏常用的贮藏方式,在一定温度范围内,可抑制果蔬的呼吸作用和蒸腾作用,减少乙烯的释放和营养物质的流失,延缓腐烂、衰老和组织褐变,延长贮藏期和货架期[8]。近年来,关于香椿芽低温贮藏的研究已有报道,主要集中在贮藏温度[9]、包装材料[10-13]、喷施外源物质[14-17]对红香椿芽贮藏期间营养物质、微生物多样性及酶活性变化的影响等方面。
花青素和木质素作为香椿芽的重要物质成分,是评价香椿芽品质优劣的重要指标之一。研究香椿芽采后贮藏过程中花青素和木质素含量对其品质调控具有积极意义。然而,国内外对香椿芽采后花青素和木质素含量变化的研究较少。本研究以4月上旬采自贵州省织金县板桥镇红光村相同树龄(4年)的红和绿香椿芽为试验材料,观察香椿芽采后低温贮藏过程中色泽变化,并测定香椿芽叶和叶柄花青素和木质素含量,且通过石蜡切片观察其叶和叶柄木质部细胞的变化。另外,根据课题组建立的香椿芽转录组数据库,检索和鉴定与香椿芽花青素和木质素合成途径相关基因,并利用qRT-PCR对红和绿香椿芽叶和叶柄花青素与木质素合成相关基因的表达水平进行分析,旨在为进一步指导香椿芽贮藏保鲜及其品质调控研究提供理论依据。
1 材料和方法
1.1 材料采集和固定
2022年4月上旬,采摘种植于贵州省织金县板桥镇红光村(105.71°E, 26.79°N)相同树龄(4年)、生长状况一致、无机械损伤的红和绿香椿芽。采摘后分别装入聚乙烯包装袋中进行4 ℃低温黑暗贮藏。分别于贮藏0 d(采摘当天)、1 d、2 d、3 d的同一时间(早上7:00)取样。取样时选取不同贮藏期的红和绿香椿芽各3个,进行3次生物学重复,分别将红和绿香椿芽的叶片和叶柄用锡箔纸包好,一部分快速放入液氮中速冻,并保存于-80 ℃冰箱,用于红和绿香椿芽叶片和叶柄RNA的提取和花青素含量的测定,一部分置于烘箱80 ℃烘干至恒重,用于木质素含量的测定。同时,分别取红和绿香椿芽不同贮藏期叶片及叶柄用FAA(Formalin-Aceto-Alcohol)固定液(70%酒精90 mL,福尔马林5 mL,冰醋酸5 mL)[18]进行固定,用于组织切片,观察叶脉和叶柄的组织结构。
1.2 香椿芽色泽及叶片、叶柄组织结构观察
先仔细观察不同贮藏时期香椿芽的色泽变化,然后制作石蜡切片和进行组织化学染色。用FAA固定液分别将不同贮藏期红、绿香椿芽同一部位的叶片和叶柄固定24 h,经乙醇梯度脱水,使用石蜡浸透与包埋。
利用石蜡切片机将样品切成4 μm厚的切片,用番红—固绿染色液染色,乙醇梯度脱色脱水后封片,最后在光学显微镜下(NIKON ECLIPSE E100,尼康仪器上海有限公司)观察叶脉及叶柄组织结构,并进行拍照。
1.3 香椿芽叶片和叶柄花青素和木质素含量测定
1.3.1 花青素含量
花青素的提取及其含量的测定参照王欢等[19]和谭国飞等[20]的方法进行。
具体步骤:使用液氮将采后不同贮藏期红和绿香椿芽叶片和叶柄研磨成粉末后,各称取约0.2 g放入20 mL 95%乙醇中,室温暗光下浸提8 h。浸提液用0.25 μm滤头过滤后,使用紫外分光光度计(Alpha-1860,上海谱元仪器有限公司)测定其在530,620,650 nm波长下的吸光度值D530、D620和D650。
根据公式[D=(D530-D620)-0.1(D650-D620)]并按照0.1个吸光度为1个花青素单位,计算不同贮藏期红和绿香椿芽叶片和叶柄花青素含量。每个样品进行3次生物学重复。
1.3.2 木质素含量
取不同贮藏期的红、绿香椿芽叶片和叶柄干样置于研钵研磨成粉末,过30~50目筛,然后使用Solarbio生物科技有限公司的木质素含量检测试剂盒,提取木质素并计算木质素含量。每个样品进行3次生物学重复
1.4 香椿芽叶片和叶柄花青素和木质素合成相关基因的表达分析
1.4.1 RNA提取及cDNA合成
将-80 ℃冰箱保存的香椿芽样品,分别置于灭菌的研钵中,用液氮将不同贮藏期红和绿香椿芽叶片和叶柄研磨成粉末。各取约0.1 g装入2 mL无酶的离心管中,采用植物 RNA 提取试剂盒(北京华越洋生物科技有限公司,GX型)提取香椿芽的总 RNA。
使用1.5%的琼脂糖凝胶检测香椿芽总RNA的完整性及使用微量分光光度计Nanodrop ND-100 (Nanodrop Technology Inc., DE, USA)检测香椿芽总RNA的浓度。利用HiScriptⅢ 1st Strandc DNA Synthesis Kit (+gDNA wiper)试剂盒(南京诺唯赞生物科技有限公司,该试剂盒中有去除基因组成分),按照说明书将提取的RNA反转录为 cDNA。最后,用灭菌的ddH2O 稀释15倍,保存于-20 ℃冰箱备用。
1.4.2 花青素和木质素合成相关基因的表达分析
根据花青素和木质素合成的代谢通路,从香椿芽转录组数据库中检索获得花青素合成基因苯丙氨酸解氨酶基因(phenylalanine ammonia-lyase,PAL)、肉桂酸-4-羟化酶基因(cinnamate 4-hydroxylase,C4H)、查尔酮合成酶基因(chalcone synthase,CHS)、查尔酮异构酶基因(chalcone isomerase,CHI)、黄烷酮-3-羟化酶基因(flavanone 3-hydroxylase,F3H)、类黄酮3′,5′羟化酶基因(flavonol 3′,5′ hydroxylase,F3′5′H)、二氢黄酮醇还原酶基因(dihydroflavonol 4-reductase,DFR)、花青素合成酶基因(anthocyanidin synthesis,ANS)、花青素-3-O-葡萄糖基转移酶基因(anthocyanidin 3-O-glucosyltransferase,3GT)等9个,以及木质素合成基因4-香豆酸辅酶A连接酶基因(4-coumarate CoA ligase,4CL)、肉桂酰辅酶A还原酶基因(cinnamoyl-CoA reductase,CCR)、肉桂醇脱氢酶基因(cinnamyl alcohol dehydrogenase,CAD)、莽草酸/奎宁酸羟基肉桂酰转移酶基因(shikimate/quinate hydroxycinnamoyl transferase,HCT)、香豆酸-3-羟化酶基因(coumaroyl shikimate/quinate 3′-hydroxylase,C3′H)、咖啡酸-O-甲基转移酶基因(caffeic acidO-methy Itransferase,COMT)、阿魏酸-5-羟化酶基因(ferulate 5-hydroxylase,F5H)、咖啡酰辅酶A-O-甲基转移酶基因(caffeoyl CoAO-methy Itransferase,CCoAOMT)和漆酶基因(Laccase,LAC)等9个。
以香椿Actin基因(TsActin)作为内参基因,设计qRT-PCR引物(引物由南京金斯瑞生物科技有限公司合成,表1)。使用SYBR PremixExTaq 试剂盒(TaKaRa,大连)进行荧光定量实验。反应体系为20 μL,包括10 μL 2×SYBR qPCR Master Mix,2 μL稀释的模板cDNA,上、下游引物各0.5 μL,7 μL灭菌的ddH2O,香椿TsActin基因与目的基因一起扩增。每个样品进行3次生物学重复。PCR反应程序为:95 ℃预变性5 min;95 ℃变性10 s,54 ℃退火30 s,65 ℃延伸10 s,40个循环;最后8 ℃保存。相对定量表达参照2-ΔΔCT法。
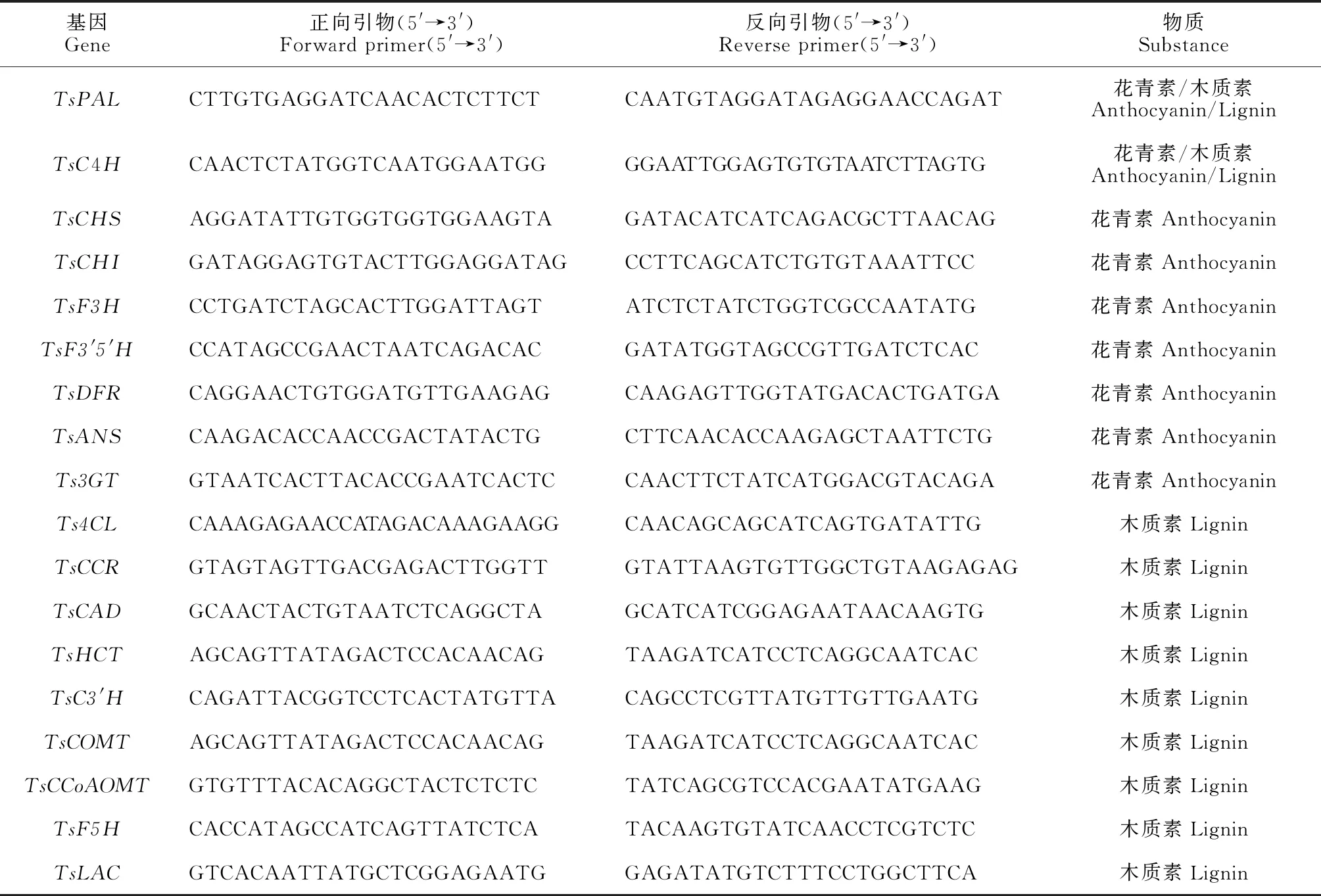
表1 花青素和木质素合成相关基因的qRT-PCR引物
1.5 数据分析
用Microsoft Excel 2007软件作数据统计分析,用IBM Statistics 20.0软件进行显著性分析,显著水平设置为0.05。
2 结果与分析
2.1 香椿芽贮藏过程中色泽和叶脉、叶柄解剖结构的变化
香椿芽采后4 ℃低温黑暗贮藏过程中,红香椿芽贮藏3 d后仍色彩鲜艳,而绿香椿芽采后贮藏1 d叶柄开始出现黑色斑点,随贮藏时间的延长,黑色斑点逐渐增加,且黑色逐渐加深(图1),表明绿香椿芽的贮藏时间短。同时,红、绿香椿芽在采后贮藏期间,叶片紫红色逐渐变浅,而叶柄的颜色变化甚微。
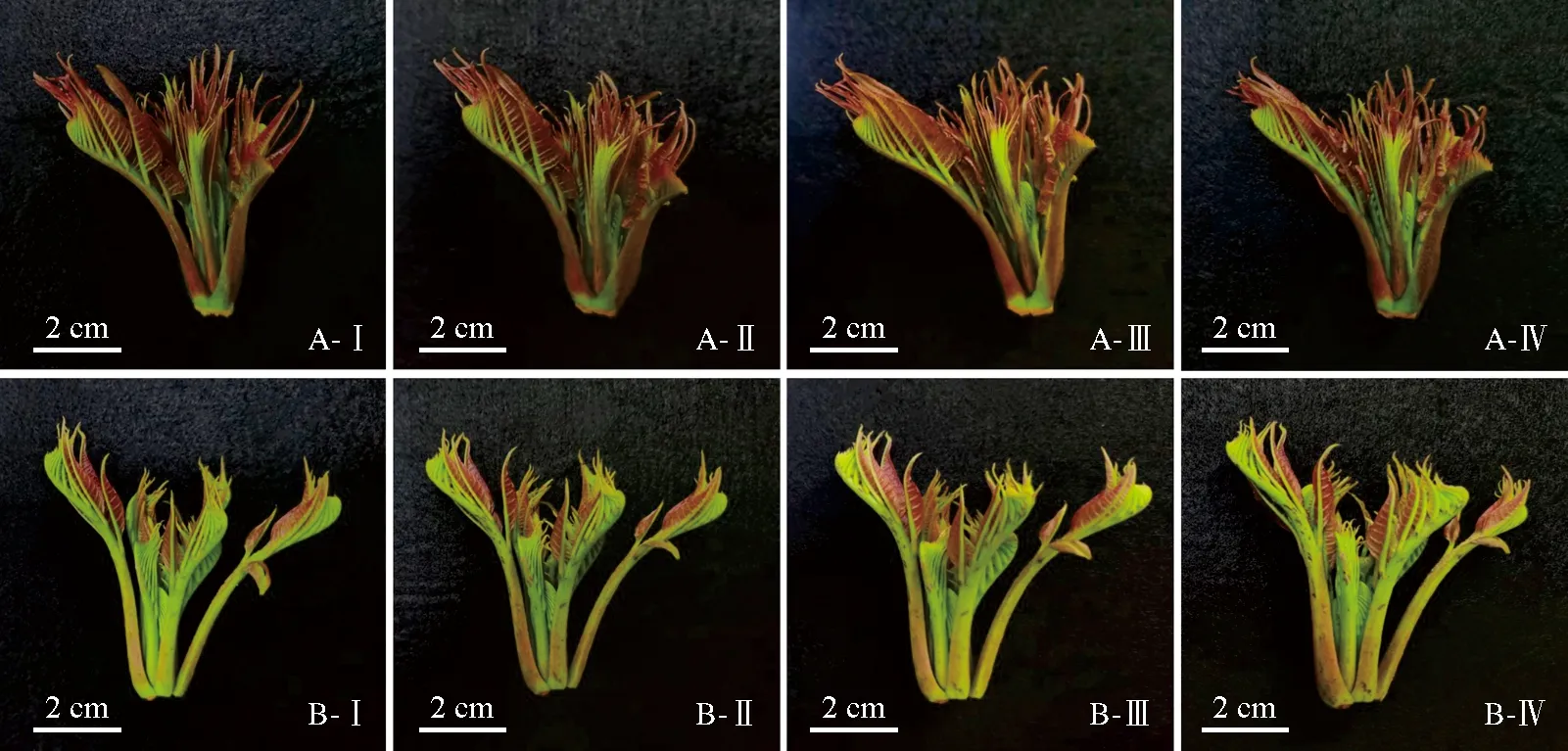
A. 红香椿芽;B. 绿香椿芽;Ⅰ. 0 d; Ⅱ. 1 d; Ⅲ. 2 d; Ⅳ. 3 d。下同。
番红染液可以使细胞壁中的木质素呈现红色,染色时染色程度越深说明木质素含量越高[21]。利用显微镜观察红、绿香椿芽采后4 ℃低温贮藏过程中叶脉和叶柄细胞结构的变化。结果表明,红香椿芽叶脉(图2,A-Ⅰ~A-Ⅳ)和叶柄(图3,A-Ⅰ~A-Ⅳ)木质部细胞比绿香椿芽叶脉(图2,B-Ⅰ~B-Ⅳ)和叶柄(图3,B-Ⅰ~B-Ⅳ)木质部细胞小且细胞数量少;红、绿香椿芽采后贮藏过程中,次生细胞壁逐渐增厚,且细胞染色程度上绿香椿芽叶及叶柄红色较深,表明红、绿香椿芽贮藏过程中均发生了木质化,但绿香椿芽的木质化程度更高。另外,蒸腾作用使组织细胞失水而失去新鲜状态[22],贮藏过程中红香椿芽叶脉和叶柄的木质部细胞逐渐增大;而绿香椿芽叶脉和叶柄木质部细胞先增大(0~1 d)后变小(2~3 d),表明贮藏过程中绿香椿芽的蒸腾作用较强,水分流失严重。

A. 红香椿芽;B. 绿香椿芽;Ⅰ. 0 d; Ⅱ. 1 d; Ⅲ. 2 d; Ⅳ. 3 d; X. 木质部。下同。

图3 4 ℃低温贮藏期间香椿芽叶柄结构
2.2 香椿芽贮藏过程中叶片和叶柄花青素和木质素含量的变化
图4,A显示,在4 ℃低温贮藏期间,红香椿芽叶片和叶柄中花青素含量始终明显高于相应的绿香椿芽,而在同一品种香椿芽内又表现为叶片中花青素含量始终高于叶柄。其中,随贮藏时间的延长,红、绿香椿芽叶片和叶柄花青素含量均逐渐降低,贮藏3 d时红香椿芽叶片和叶柄花青素含量分别比采摘当天降低35.88%、33.33%,绿香椿芽叶片和叶柄花青素含量则比采摘当天分别显著降低了39.13%、37.50%,表明绿香椿芽中花青素降解速率较快。香椿芽木质素含量的高低是评价香椿芽品质的重要因素。从图4,B可知,在低温贮藏期间,2个香椿品种芽内木质素含量差异较大,始终表现为绿香椿芽木质素含量高于红香椿芽,且红、绿香椿芽中叶柄木质素含量高于叶片。

不同小写字母表示各贮藏时期间差异显著(P<0.05)。下同。
其中,随贮藏时间延长,红香椿芽叶片木质素含量逐渐升高,其叶柄木质素含量先上升后下降,而同期的绿香椿芽叶片和叶柄木质素含量均呈先上升后下降的趋势;与贮藏0 d时相比,两个品种香椿芽叶片和叶柄中木质素含量总体均呈升高趋势,在贮藏3 d时红香椿芽叶片和叶柄中木质素含量分别显著升高了77.94%和48.71%,绿香椿芽则分别升高了15.30%和30.46%,表明香椿芽在冷藏过程中,红香椿芽中木质素的积累速率较快。
2.3 香椿芽叶片和叶柄花青素和木质素合成相关基因表达量的变化
在红香椿芽中,随着贮藏时间的延长,花青素合成相关基因TsPAL(叶柄)和TsC4H的表达量均呈先升高后下降趋势,TsCHS、TsF3H和TsANS的表达量均呈逐渐降低的趋势,TsPAL(叶片)和Ts3GT的表达量呈先降低后升高,然后再降低的趋势;而TsCHI、TsF3′5′H和TsDFR的表达量在红香椿芽叶片和叶柄中的变化趋势不一致,如TsCHI在叶片的表达量呈逐渐降低的趋势,在叶柄中则呈现先升高后降低的趋势。
在绿香椿芽中,随着贮藏时间的延长,叶片和叶柄中TsPAL基因的表达量均呈先升高后降低的变化趋势,TsCHI和TsF3H基因的表达量均呈逐渐降低的趋势;而TsC4H、TsCHS、TsF3′5′H、TsDFR、TsANS和Ts3GT基因的表达量在绿香椿芽不同组织中存在差异,但整体均呈现下降趋势(图5)。
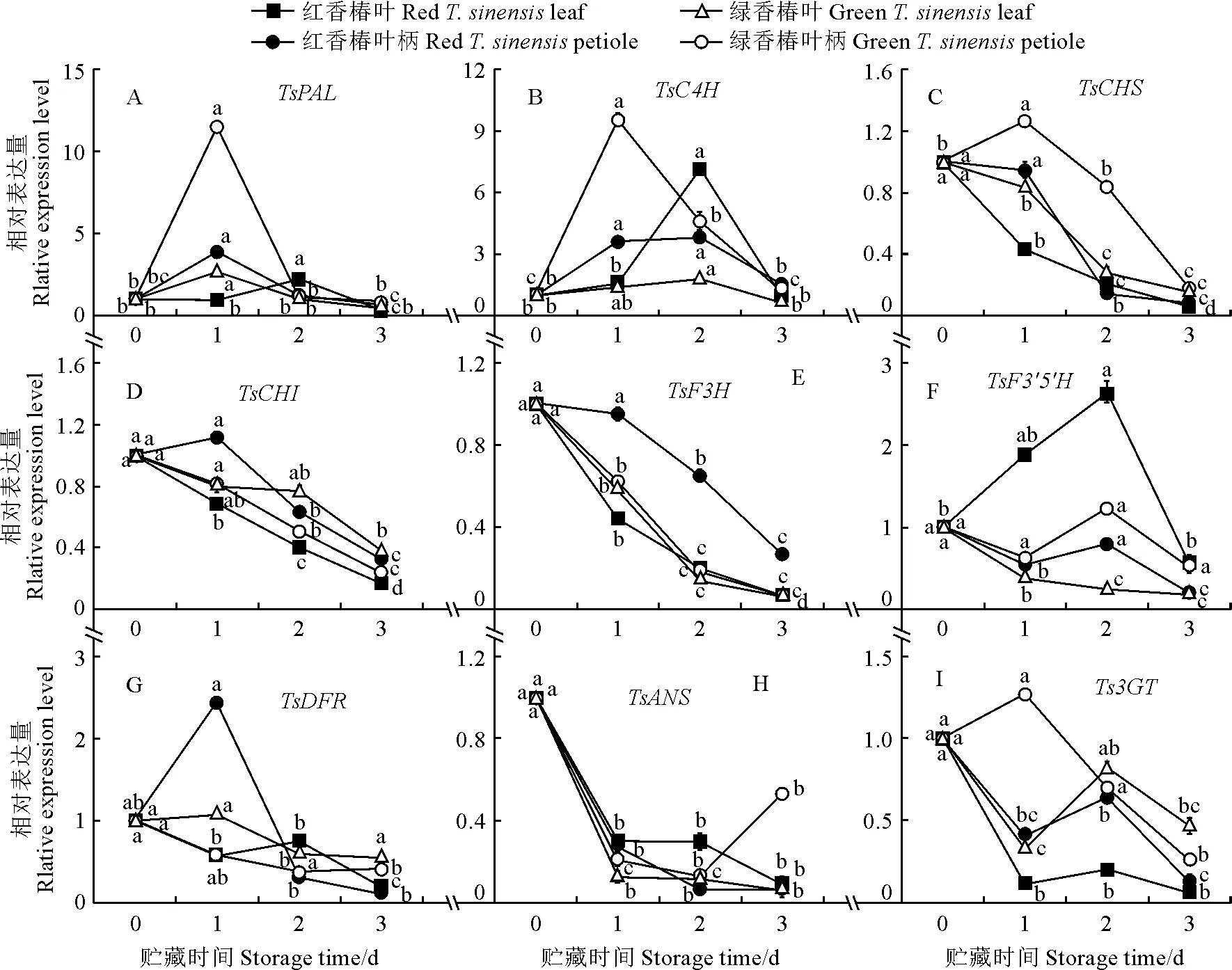
图5 低温贮藏期间香椿芽花青素合成基因的相对表达量
可见,在香椿芽低温贮藏过程中,叶片和叶柄中各花青素合成相关基因的表达量均发生了显著变化,但变化趋势存在差异,除TsPAL和TsC4H基因外,其他花青素合成相关基因的表达量均显著下降。
同时,不同品种香椿芽叶片和叶柄冷藏过程中木质素合成相关基因的表达水平具有显著差异。红香椿芽采后冷藏过程中,TsHCT基因在叶片中的表达量显著升高,而在叶柄中的表达量则降低;TsCAD、TsC3′H、TsCOMT、TsF5H和TsCCoAOMT基因的表达量在红香椿芽叶柄中呈现升高的趋势,而在红香椿芽叶片中的表达量降低。在绿香椿芽叶片冷藏过程中,Ts4CL、TsHCT和TsCCoAOMT基因的表达量升高,其中Ts4CL和TsHCT基因的表达量显著升高;而TsCAD、TsC3′H、TsCOMT和TsLAC基因的表达量显著下降;TsCCR和TsF5H基因的表达量下降,但差异不显著。在绿香椿芽叶柄冷藏过程中,TsCCR、TsHCT、TsF5H、TsCCoAOMT和TsLAC基因的表达量升高,其中TsCCR、TsHCT和TsLAC基因的表达量显著升高,而Ts4CL、TsCAD、TsC3′H和TsCOMT基因的表达量下降,但差异不显著(图6)。

图6 低温贮藏期间香椿芽木质素合成基因的相对表达量
3 讨 论
花青素是存在于果蔬中的一种天然水溶性色素,可以作为评价果蔬新鲜程度和绿色植物衰老的指标[23-24]。本研究中红和绿香椿芽花青素含量在采后4 ℃低温黑暗贮藏过程中随贮藏时间的延长呈逐渐下降的趋势,这与范林林等[25]关于茄子果皮中花青素含量在贮藏过程中变化趋势的报道一致,即果蔬贮藏过程中衰老现象的产生与花青素的降解密切相关。从贮藏性能来看,本研究中绿香椿芽采后低温贮藏1 d开始出现黑色斑点,且黑色斑点随贮藏时间的增加而逐渐增多,而红香椿芽在采后贮藏3 d也未有黑色斑点产生,表明绿香椿芽的贮藏时间短,贮藏保鲜困难。另外,香椿芽不同部位的衰老速度也存在差异,叶柄花青素降解速度比叶片快。
木质素是植物细胞壁的主要成分,也是影响果蔬采后贮藏品质的重要因素[26]。研究表明,‘潍县萝卜’肉质根贮藏过程中木质素含量显著增加,这与萝卜肉质根的糠心程度显著增加高度相关[27]。竹笋在采后4 ℃低温贮藏过程中,木质素含量呈逐渐上升的趋势,硬度增加,品质下降[28-29]。本研究发现,香椿芽在采后4 ℃低温贮藏过程中表现出叶脉和叶柄的次生细胞壁逐渐增厚,木质素含量逐渐增加。另外,本实验中绿香椿芽的木质素含量比红香椿芽高,且红和绿香椿芽叶柄的木质素比叶片高,表明绿香椿芽不耐贮藏以及叶柄的贮藏性能差。同时,香椿芽在低温冷藏过程中红香椿芽中木质素的积累速度较快,可能是由于将红香椿芽采收后放于4 ℃进行冷藏,温度差异变化较大所致。此外,木质素的积累还会引起果锈及褐变现象的产生[30-31]。香椿芽贮藏过程中,绿香椿芽产生黑色斑点的时间比红香椿芽早,表明香椿芽采后黑色斑点的产生与贮藏过程中木质素的积累密切相关。
花青素和木质素均是植物苯丙烷类代谢的产物,研究表明,花青素和木质素相关基因的上调和下调表达可以显著增加或减少花青素和木质素的含量[32-35]。香椿芽采后贮藏过程中,花青素和木质素合成相关基因(除TsPAL和TsC4H)的表达水平与花青素和木质素的含量变化趋势一致,表明香椿芽采后贮藏过程中花青素和木质素含量的差异与合成相关基因的表达水平具有一定的相关性。在香椿芽贮藏过程中,TsPAL和TsC4H的表达水平呈现先升高后下降的趋势,且整体呈下降趋势,这可能是由于TsPAL和TsC4H既可以调控花青素的合成,也可以调控木质素的合成,且在贮藏前期主要调控木质素的合成,而在贮藏后期参与调控花青素的合成。TsPAL和TsC4H基因是否在贮藏前期参与香椿芽木质素合成,在贮藏后期参与花青素的合成还需要进一步探究。
综上所述,在红、绿香椿芽采后4 ℃低温贮藏过程中,叶片、叶柄组织的花青素含量降低,木质素含量升高,而次生细胞壁增厚,发生了不同程度的木质化。同时,红香椿芽的花青素含量比绿香椿芽高,而木质素含量比绿香椿芽低。综合香椿芽色泽、外观、花青素和木质素含量变化特征,表明红香椿芽的贮藏时间较长,且叶柄贮藏保鲜比叶片更困难。另外,叶片、叶柄组织中花青素和木质素合成相关基因的表达量与香椿芽贮藏过程中花青素和木质素含量的变化趋势一致。本研究结果对于指导红和绿香椿芽的贮藏保鲜和食用具有实际意义,也为通过调控花青素和木质素基因表达水平来提高香椿芽采后品质提供了理论依据。

