基于转录组学研究高原低氧对小鼠T、B淋巴细胞信号通路的影响*
许玉珍,王嘉阳,胡 英,龙启福,缪增强,永 胜
(青海大学医学部,青海 西宁 810016)
氧对哺乳动物有氧代谢至关重要[1]。高原地区氧含量的下降会削弱有氧代谢,引起机体循环功能下降,导致组织、器官的营养和能量减少,造成不同程度的氧化损伤,诱导高原肺水肿[2]和高原脑水肿[3]等高原病的发生。因此,研究高原病的发病机制成为近年来高原医学备受关注的课题。有研究表明,低氧会影响免疫细胞的新陈代谢和功能,且与高原病的发生发展有密切关系,且高原低氧(HST)环境可以调节免疫基因的表达、影响机体免疫功能、诱导炎症反应发生等[4]。此外,KIANI等[5]研究发现,在低氧环境下,磷脂酰肌醇-3激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/Akt/mTOR)和核因子κB(NF-κB)共同调控T、B细胞受体活化信号,在固有和适应性免疫系统中发挥重要作用。然而,HST刺激如何调控机体免疫功能的研究仍然有限,因此深入了解低压低氧刺激如何调控机体的免疫应答过程,进而适应低氧胁迫是亟待解决的重要科学问题。
众所周知,脾脏是机体最大的免疫器官,含有大量的淋巴细胞,在细胞免疫和体液免疫应答过程中都发挥着不可或缺的作用。据报道,HST胁迫下,低氧诱导因子-1α(HIF-1α)通过抑制雷帕霉素复合物1(mTORC1)介导的骨髓细胞瘤病毒癌基因同源物(Myc)相关通路调节Tfh与Th1细胞的发育,促进生发中心B细胞的增殖[6]。此外,LI等[7]研究发现,HIF-1α是前B细胞中miR-582的靶点,敲除miR-582后,激活mTORC2,增强HIF-1α的表达和Akt磷酸化,促进前B细胞增殖,调节早期B细胞的分化发育。进一步研究发现,新型冠状病毒感染患者B细胞中出现低氧有关的转录变化,引起B细胞发育异常,包括B细胞减少、抗体类别的转换和亲和力成熟等,诱导炎症反应加剧和自身免疫反应的发生,提示在新型冠状病毒感染中,适当的早期氧疗会改善免疫反应,利于疾病的恢复[8]。上述研究提示低氧与T、B细胞分化发育密切相关,探究T、B细胞响应低氧应激的分子机制为临床免疫疗法提供新思路。
随着测序技术的发展,高通量测序技术成为了解低氧胁迫影响免疫反应及其通路和基因表达的有力工具。RNA测序(RNA-seq)的转录组分析技术可以从大量转录信息中识别差异表达基因(DEGs),分析核心调控通路,成为探究低氧胁迫机体各个组织系统响应免疫应答机制不可或缺的工具[9]。有研究发现,低压低氧环境下大鼠肠道模型中PPAR信号通路、矿物质吸收、甘油三酯代谢、脂肪消化和吸收等消化相关代谢途径在京都基因和基因组数据库(KEGG)通路分析中显著富集,为大鼠在低氧环境下胃肠道调节的潜在分子机制提供新的理论依据[10]。ZHOU等[11]研究发现,低压低氧暴露的幼年鳙鱼心脏模型中丝裂原活化蛋白激酶(MAPK)信号、细胞凋亡和肾上腺素信号等相关代谢途径在KEGG通路分析中得到了高度富集,为幼年鳙鱼在低氧环境下的应激分子机制提供线索。这些研究提示,转录组测序技术在探究低氧胁迫适应的分子机制中发挥着重要作用。
因此,本实验采用转录组测序技术研究HST胁迫对小鼠脾脏T、B细胞的影响,挖掘与T、B细胞受体相关通路和关键基因,明确其在HST条件下T、B细胞的调控机制,为揭示低氧胁迫下免疫细胞调控机制的相关研究提供新思路。
1 材料与方法
1.1实验动物 6~8周龄的SPF级C57BL/6小鼠,购自西安交通大学医学部实验动物中心,动物许可证号:SYXK 2020-005,饲养于温度为18~22 ℃、湿度为45%~55%的实验动物房中,自由饮水、进食,保持环境卫生。待小鼠适应周围环境后,将小鼠随机分成2组,每组5只。对照组即平原常氧组(PSC组),在西安交通大学医学部实验动物中心(海拔400 m)饲养30 d;实验组即HST组,在青海省果洛藏族自治州玛多县人民医院实验动物房(海拔4 200 m)。30 d后无菌采集小鼠脾脏组织置于液氮冻存备用。
1.2主要试剂 逆转录聚合酶链反应(qPCR)试剂盒(TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus,RR820A,Takara,日本);逆转录试剂盒(PrimeScriptTMRT reagent kit with gDNA Eraser,RR047A,Takara,日本);Trizol裂解液(美国Invitrogen公司)。
1.3方法
1.3.1总RNA提取和Illumina测序 从各组小鼠脾脏中提取总RNA(常规Trizol法),将总RNA中纯化的mRNA打断并逆转录成cDNA,经末端修复、PCR扩增等过程制备mRNA-Seq文库进行Illumina测序。
1.3.2RNA-Seq质量评估和序列比对 为了保证数据分析的质量及可靠性,对高通量测序得到的原始数据(raw reads)进行过滤,主要包括去除原始数据中有测序接头(adapter)的reads或测序质量较低的reads,对clean data 进行后续高质量分析。使用 HISAT2软件构建索引,将配对末端 clean reads 与参照基因组比对,采用皮尔逊相关性检测对样本的基因表达水平进行精确分析。
1.3.3DEGs分析 对PSC组和HST组通过DESeq2统计软件,基于负二项式分布模型进行差异基因表达数据分析。用FPKM(Fragments Per Kilobase per Million)对基因长度和深度校正其表达水平。以|log2FC|≥0作为显著差异表达的阈值。
1.3.4基因本体(GO)注释、KEGG分析和基因富集分析 采用clusterProfiler (3.4.4)富集分析,找出DEGs显著富集的GO条目并计算P值。GO(http://www.geneontology.org/)即基因本体数据库,包括生物过程(BP)、细胞组成(CC)和分子功能(MF)3个部分。
KEGG(http://www.kegg.jp/)是分子水平的数据库资源,通过高通量数据库,了解细胞、生物体和生态系统的高级功能和效用。采用 clusterProfiler(3.4.4)软件分析计算KEGG通路中DEGs即P<0.05视为显著富集。基因集富集分析GSEA(http://www.broadinstitute.org/gsea/index.jsp):从基因集富集分析的角度出发,针对有重要生物学意义但差异表达较小的基因进行功能富集分析,作为KEGG数据集的补充工具。
1.3.5实时荧光定量聚合酶链反应(RT-qPCR)验证 将RNA逆转录为DNA,cDNA合成是按照制造商的说明使用PrimeScriptTMRT试剂盒进行。以β-actin作为内参,检测PD-1、CTLA4、CD45、CD4、CD8a、CD8b1、CD3e、ICOS、CD28、CD40L、PIR-B、CD22、CD72、Igα、Igβ、FcgRIIB、LEU13、CD81、CD19、CD21、SHP1、GRB2、SOS、Ras、Raf、MEK1/2、p38、NFAT、PI3K、Akt、GSK-3β、NIK、IKKα、NF-κB、IκB、TNF-α、IFN-γ的mRNA表达量,引物序列详见表1。

表1 RT-qPCR引物信息

2 结 果
2.1PSC组和HST组脾脏DEGs 30 d的HST处理后,以|log2FC|≥0和P-校正<0.05为筛选条件,共鉴定出4 213个DEGs,其中1 947个基因表达上调,2 266个基因表达下调(图1)。为了研究PSC和HST下脾脏转录组数据之间的样本异质性,对各组样品进行Pearson相关系数分析(图2),结果表明各样本间基因表达量的相关系数R2>0.95,提示生物学重复样本间基因表达情况较为一致,实验数据可靠,且小鼠脾脏组织在不同海拔高度下对低氧诱导反应有差异。

图1 DEGs柱

图2 Pearson相关性系数分析
2.2DEGs的GO富集分析 通过GO富集分析对DEGs进行BP、CC、MF富集(图3)。主要参与B细胞激活、适应性免疫应答、淋巴细胞激活的正向调节信号通路等GO生物过程;并在免疫球蛋白复合体和免疫球蛋白复合体循环等细胞组分的构成方面起作用;参与抗原结合和免疫球蛋白受体结合等分子功能。提示免疫系统在HST胁迫下发生了重要变化。
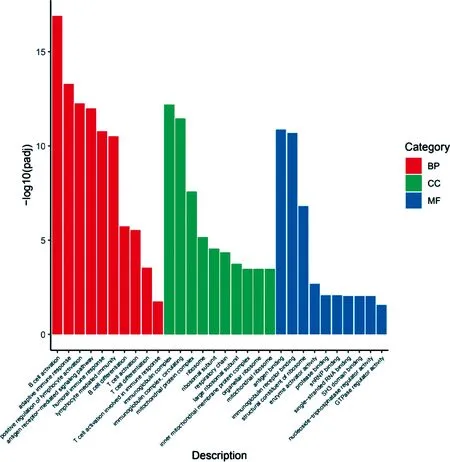
图3 DEGs的GO注释图
2.3DEGs的KEGG富集分析 在HST胁迫下得到DEGs进行KEGG富集分析发现,主要参与T、B细胞受体,PI3K-Akt,MAPK,NF-κB等多个免疫炎症相关信号通路调控,见图4。

图4 DEGs的KEGG通路富集
2.4RT-qPCR验证结果 对T、B细胞受体信号通路中的DEGs及相关炎症因子进行了mRNA表达量的检测,结果发现,T细胞表面膜分子:PD-1、CTLA4、CD45、CD4、CD8a、CD8b1、CD3e、ICOS、CD28、CD40L在PSC组与HST组之间均表现出显著上调差异表达;B细胞表面膜分子:PIR-B、CD22、CD72、Igα、Igβ、FcgRIIB、LEU13、CD81、CD19、CD21均表现出显著差异变化;T、B细胞受体信号通路共有基因:PI3K-Akt途径中PI3K、Akt、GSK-3β、NIK、IKKα基因,p38 MAPK和NF-κB途径中SHP1、GRB2、SOS、Ras、Raf、MEK1/2、p38、NF-κB、IκB基因均出现差异表达。此外,相比于PSC组,HST组的INF-γ和TNF-α等炎性细胞因子出现显著上调差异表达。因此,上述结果提示,在HST胁迫下通过影响T、B细胞受体信号通路介导炎症反应发生。见图5。

注:A.T细胞表面膜分子;B.B细胞表面膜分子;C.T、B细胞受体信号通路共有基因。与PSC组相比,aP<0.000 1,bP<0.05,cP<0.001,dP<0.01。
3 讨 论
经过30 d HST暴露后,发现HST组相较于PSC组小鼠脾脏组织多个基因发生了显著差异表达。有研究发现,缺氧抑制白细胞介素-2诱导的T细胞增殖过程,同时抑制抗原诱导的细胞毒性T细胞中促炎性细胞因子的产生[12]。据报道,低氧暴露会引起机体对伤害性刺激做出防御性反应,在免疫应答过程中,免疫细胞被激活、分裂和分化,通过诱导炎症消除危险信号以保护机体免受伤害[13]。本研究通过比较暴露于不同海拔的小鼠脾脏组织转录组谱,探讨低氧对小鼠T、B细胞信号通路的影响机制。
为了解HST胁迫对小鼠脾脏T细胞膜受体激活机制,本实验对T细胞膜受体的10个基因进行RT-qPCR实验验证,结果发现基因均出现了显著性上调变化(图5),提示TCR识别活化信号后,经CD3和共受体CD4或CD8传递T细胞活化的第一信号,启动T细胞激活,其次CD28、ICOS、CD40L共刺激分子相互作用下提供第二信号诱导T细胞完全活化,共抑制分子PD-1和CTLA4基因表达也显著上调,提示机体同时启动免疫抑制信号,下调或中止了免疫应答。
此外,HST胁迫对小鼠脾脏B细胞膜受体的激活与T细胞相似,也需要双信号活化。BURROWS等[14]研究发现小鼠B细胞中HIF-1α激活后,BCR编辑减少和未成熟B细胞的发育停止,导致外周B细胞数量减少,HIF-1α的动态调节对正常的B细胞发育至关重要。本研究结果发现,B细胞膜受体中的Igα、Igβ、CD19、CD21、CD81基因显著下调,提示激活BCR后,与Igα/β胞内区相关联的酪氨酸激酶LYN活化,使Igα/β、CD19/CD21/CD81胞内段的ITAM酪氨酸残基被磷酸化后发生负调节,随后募集并活化SYK,进而启动B细胞内信号转导的级联反应。
T、B细胞受体信号通路参与免疫应答、炎症反应及细胞生长、凋亡等生物事件的发生。为了进一步明确HST胁迫对小鼠脾脏T、B细胞内信号通路影响的机制,对T、B细胞受体信号通路中的DEGs进行了分析,提示低氧激活T、B细胞,启动信号级联反应将活化信号转入T、B细胞内,一方面活化信号激活PI3K后,催化PIP2的3位羟基磷酸化生成PIP3为第二信使,招募PDK1和Akt到质膜上,磷酸化Akt蛋白的第308号苏氨酸,导致Akt活化,进一步激活下游GSK-3β和IKKα。Akt磷酸化GSK3β后,导致β-catenin在胞浆内大量聚集,进入细胞核激活T、B细胞分裂、生长调控及炎症相关基因(如IFN-γ、TNF-α等);IKKα被Akt磷酸化激活后,IKKα进一步磷酸化能够抑制NF-κB途径的转录因子IκB。以上结果提示,HST胁迫引起PI3K-Akt信号轴激活,导致免疫调节和炎症因子的产生(如IFN-γ、TNF-α等)。有研究表明,PI3K-Akt是各种细胞表面受体激活的脂质激酶家族,PI3K-Akt可以控制T、B细胞从淋巴结的进出,以及炎症组织中T、B细胞的招募和扩增[15]。据报道,HST暴露的大鼠脑组织中HIF、血管内皮生长因子(VEGF)、PI3K和Akt的磷酸化显著增强,激活大鼠脑组织中PI3K-Akt信号通路,参与脑组织炎症损伤和凋亡[16]。有研究发现,PI3K-Akt和HIF-1α通路是介导小鼠卵巢癌的关键致癌通路,其中,盐诱导激酶2(SIK2)可以激活PI3K-Akt、HIF-1α和线粒体动力相关蛋白1(Drp1)磷酸化引起线粒体裂变,导致免疫平衡失调,进而诱发癌症[17]。此外,有研究报道,IFN-γ刺激促炎巨噬细胞的活化,抑制肿瘤组织中的血管生成,诱导调节性T细胞凋亡,进而克服肿瘤的进展[18]。同时,慢性炎症与TNF-α的过度激活密切相关,并最终可能导致自身免疫性疾病[19]。结合以上研究结果,HST胁迫通过激活T、B细胞受体信号通路内PI3K-Akt信号途径,促进炎性细胞因子的成熟和分泌,从而发挥炎症和免疫效应。
另一方面活化信号转入T、B细胞内,通过抑制性共受体(PIR-B、CD22、CD72)向免疫受体酪氨酸抑制基序(ITIM)招募磷酶来负调节BCR信号传导,抑制SHP1基因表达,进一步磷酸化SOS和Ras,导致MEK1/2、p38、NFKB基因显著下调,抑制p38 MAPK和NF-κB信号通路,对免疫应答产生抑制作用,从而在清除抗原的同时保持机体的免疫平衡。如,ZHU等[20]研究发现,通过抑制缺血缺氧性脑损伤(HIBI)模型大鼠的p38 MAPK信号通路,减少海马组织中的神经元凋亡,从而提高HIBI大鼠的学习记忆能力和运动功能。KAUPPINEN等[21]研究还发现,NF-κB信号传导在固有免疫防御中起着重要作用,通过激活沉默信息调节因子(SIRT1)可抑制NF-κB信号传导,发挥抗炎、抗氧化和抗损伤,维持内环境的稳态。此外,有报道称,异丙酚通过抑制p38 MAPK和NF-κB信号通路来减少炎症因子的释放并缓解肠道水肿,从而减轻和治疗大鼠的肠道缺血/再灌注损伤[22]。牛磺酸通过下调p38 MAPK和NF-κB信号通路,抑制炎症反应和氧化应激,从而缓解肺损伤,恢复呼吸功能并降低炎症因子水平[23]。结合上述研究提示,30 d HST暴露小鼠通过抑制p38 MAPK和NF-κB信号途径,引起T、B细胞受体信号通路有效地执行宿主防御响应的分子机制[24-25]。
T、B细胞受体信号通路是复杂的细胞内网络。因此,本研究基于转录组测序结果对T、B细胞受体信号通路相关基因进行分析和RT-qPCR的验证。本实验发现,T、B细胞受体信号通路中显著性DEGs在PI3K-Akt、p38 MAPK和NF-κB通路中。结果提示,HST胁迫通过激活PI3K-Akt通路,抑制p38 MAPK和NF-κB通路,诱导脾脏组织T、B细胞受体信号通路发生改变,致使机体内部免疫调节和炎症反应的发生。因此,这一结果将为研究HST对小鼠T、B淋巴细胞的调控机制提供新的见解,也为高原医学在医学免疫学领域的发展提供新的理论依据。

