曲安奈德与CO2 点阵激光对增生性瘢痕患者疗效的影响
郑玉红,王付勇,韩冬
(开封市中心医院,河南开封 475000)
增生性瘢痕(Hypertrophic scar,HS)为外科常见并发症,多见于胸骨、肩三角肌、下颌及耳廓等部位,与正常瘢痕相比,HS 可呈不规则波浪形或绳索状排列,可能与瘢痕深部胶原纤维增厚有关[1]。目前临床上对于HS 的发病机制尚未完全阐明,认为HS出现可能与慢性炎性反应、成纤维组织及血管过度生成等因素有关[2-3]。为有效抑制瘢痕过度增生,本研究从治疗HS 形成的原因入手,选择曲安奈德联合二氧化碳(CO2)点阵激光治疗HS,通过抑制瘢痕周围组织内成纤维过度生成及炎性反应而控制病情进展,现将结果报告如下。
1 资料与方法
1.1 一般资料 选取2020 年9 月—2022 年9 月本院收治的68 例HS 患者作为研究对象按随机数字表法将患者分为观察组(给予曲安奈德联合CO2点阵激光治疗)与对照组(给予曲安奈德治疗)各34例。观察组中,男性17 例、女性17 例,年龄24~57岁,平均(40.25±1.85)岁;病程3~16 个月,平均(8.45±1.42)个月;瘢痕面积5~72 cm2,平均(52.85±5.65)cm2;对照组中,男性16 例、女性18 例,年龄25~57 岁,平均(40.19±1.74)岁;病程4~16 个月,平均(8.38±1.37)个月;瘢痕面积6~71 cm2,平均(52.78±5.72)cm2。2 组性别、年龄、病程、瘢痕面积等一般资料比较,差异均无统计学意义(均P>0.05)。
1.1.1 纳入标准 ①符合《现代瘢痕学》[4]中关于HS 的诊断标准;②年龄>18 岁;③HS 周围皮肤无感染、湿疹;④HS 存在时间≥3 个月。
1.1.2 排除标准 ①近期使用过抑制瘢痕增生药物;②处于妊娠或哺乳阶段;③认知功能障碍。
1.2 方法 对照组给予曲安奈德治疗。选择醋酸曲安奈德注射液,并与2.0%利多卡因按照1∶1 混匀,以0.20 mL/cm2在瘢痕组织内注射,直至瘢痕稍微隆起呈苍白色后停止,每周1 次,共治疗6 次。
观察组给予曲安奈德联合CO2点阵激光治疗。曲安奈德治疗步骤同对照组;CO2点阵激光:采用UItraPulseEncore 超脉冲CO2点阵激光仪(美国Lumenis公司),参数设定:能量密度100~1 000 mJ/cm2,光斑直径大小5 mm,点阵覆盖率0.5%~25.0%,焦距100 mm,深度2.0 mm,每周1 次,共治疗6 次。于曲安奈德注射完毕后30~60 min 再继续进行CO2点阵激光治疗。
1.3 观察指标 ①临床疗效:治愈为治疗后瘢痕皮损处平整,无疼痛、瘙痒等症状,随访6 个月无复发;显效为瘢痕面积>3/4 软化变平,无疼痛、瘙痒等伴随症状;好转为瘢痕面积>1/2 软化变平,伴有轻微疼痛、瘙痒;无效:瘢痕处无变化,甚至加重。②瘢痕血流灌注量和瘢痕厚度:于治疗前和治疗后6 个月采用美国MOOR LDⅠ2 型激光多普勒血流成像仪测定同一部位瘢痕组织内血流灌注量;同时采用德国西门子ACUSON NX2 彩色超声诊断仪测定瘢痕厚度。③温哥华瘢痕量表(Vancouver scar scale,VSS)[5]:于治疗前和治疗后6 个月采用VSS 量表评估瘢痕色泽(3 分)、厚度(4 分)、柔软度(5 分)、血管分布(3 分),总分值为0~15 分,得分越高表示症状越严重。④实验室指标:于治疗前和治疗6 个月采集患者静脉血3 mL,离心半径为10 cm,3 000 r/min 离心10 min 取上清液,采用酶联免疫吸附测定(ELISA)法测定干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、IL-6、转化生长因子-β1(TGF-β1)、血管内皮生长因子(VEGF)和表皮生长因子(EGF)水平。⑤不良反应和复发率:记录2 组患者治疗期间有无出现瘢痕红肿、色素沉着、毛囊炎和皮肤萎缩等不良反应,并记录2 组治疗后6 个月的复发率。
1.4 统计学方法 采用SPSS 22.0 统计软件进行数据分析。符合正态分布的计量资料用均数±标准差(±s)表示,行独立样本t 检验;分类变量例(%)表示,行χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效比较 观察组总有效率明显高于对照组(χ2=5.314,P=0.021)。见表1。
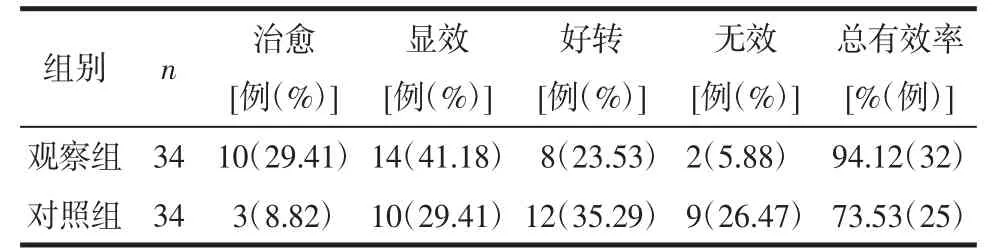
表1 2 组总有效率比较
2.2 瘢痕血流灌注量、瘢痕厚度比较 治疗前2 组瘢痕血流灌注量、瘢痕厚度比较,差异均无统计学意义(均P>0.05);治疗后,观察组瘢痕血流灌注量、瘢痕厚度、VSS 评分均明显低于对照组(均P<0.001)。见表2。
表2 2 组瘢痕血流灌注量、瘢痕厚度比较(±s)

表2 2 组瘢痕血流灌注量、瘢痕厚度比较(±s)
注:与本组治疗前比较,aP>0.05;与对照组比较,bP<0.001。
组别n 瘢痕血流灌注量(PU)瘢痕厚度(cm)治疗前治疗后治疗前治疗后对照组 34观察组 34 85.25±12.65 71.25±10.02ab 0.35±0.14 0.12±0.04ab 84.98±12.71 78.61±10.78a 0.41±0.17 0.27±0.09a t P 0.0882.9161.5898.881 0.930.0050.117<0.001
2.3 VSS 评分 治疗前,2 组瘢痕色泽、厚度、柔软度、血管分布评分及总评分比较,差异均无统计学意义(均P>0.05);治疗后,观察组瘢痕色泽、厚度、柔软度、血管分布评分及总评分均明显低于对照组(均P<0.001)。见表3。
表3 2 组VSS 评分比较(分,±s)

表3 2 组VSS 评分比较(分,±s)
注:与本组治疗前比较,aP>0.05;与对照组比较,bP<0.001。
组别n 色泽厚度柔软度血管分布总分治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组 34观察组 342.03±0.52 0.97±0.17ab 2.38±0.74 0.97±0.17ab 2.76±0.55 1.03±0.17ab 1.76±0.43 0.76±0.43ab 8.94±1.15 3.74±0.56ab 1.97±0.45 1.35±0.48a 2.29±0.80 1.53±0.51a 2.79±0.48 1.74±0.45a 1.79±0.41 1.05±0.24a 8.85±0.92 5.67±0.87a t P 0.494-4.3330.473-6.092-0.234-8.583-0.288-3.4830.348-10.828 0.623<0.0010.638<0.0010.815<0.0010.7740.0010.729<0.001
2.4 炎性因子比较 治疗前,2 组IFN-γ、TNF-α、IL-2 和IL-6 比较,差异均无统计学意义(均P>0.05);治疗后,观察组IFN-γ、TNF-α、IL-2 和IL-6均明显低于对照组(均P<0.05)。见表4。
表4 2 组炎性因子比较(ng/L,±s)
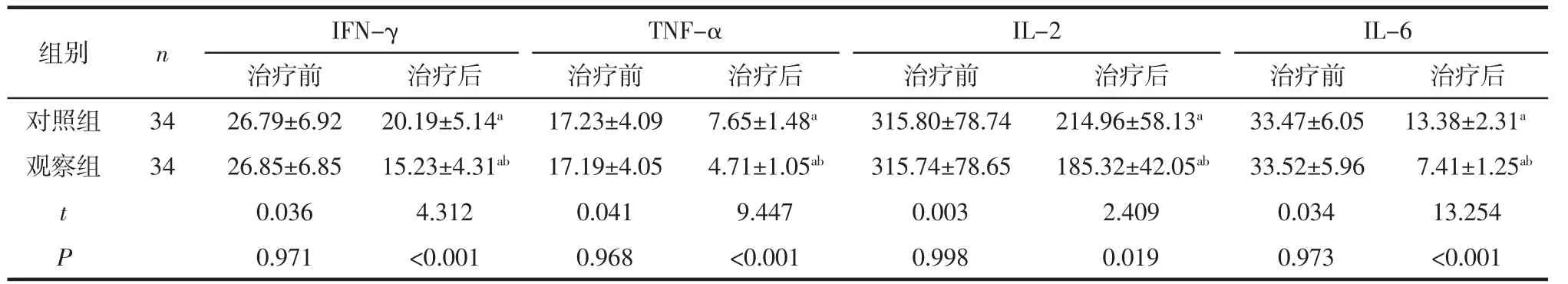
表4 2 组炎性因子比较(ng/L,±s)
注:与本组治疗前比较,aP>0.05;与对照组比较,bP<0.05。
组别n IFN-γTNF-αIL-2IL-6治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组34观察组3426.85±6.8515.23±4.31ab 17.19±4.054.71±1.05ab315.74±78.65185.32±42.05ab33.52±5.967.41±1.25ab 26.79±6.9220.19±5.14a17.23±4.097.65±1.48a315.80±78.74214.96±58.13a33.47±6.0513.38±2.31a t P 0.0364.3120.0419.4470.0032.4090.03413.254 0.971<0.0010.968<0.0010.9980.0190.973<0.001
2.5 血清TGF-β1、VEGF 和EGF 水平比较 治疗前2 组TGF-β1、VEGF 和EGF 水平比较,差异均无统计学意义(均P>0.05),治疗后观察组TGF-β1、VEGF和EGF 水平均明显低于对照组(均P<0.05)。见表5。
表5 2 组TGF-β1、VEGF 和EGF 水平比较(ng/L,±s)

表5 2 组TGF-β1、VEGF 和EGF 水平比较(ng/L,±s)
注:与本治疗组前比较,aP>0.05;与对照组比较,bP<0.05。
组别n TGF-β1VEGFEGF治疗前治疗后治疗前治疗后治疗前治疗后对照组34观察组34445.65±102.32218.45±45.96a235.45±84.69189.32±50.25a235.45±85.69179.15±47.14a 445.73±105.14342.32±49.85ab235.36±84.74219.78±62.85ab235.50±85.74211.25±68.78ab t P 0.00310.6530.0042.2070.0022.245 0.997<0.0010.9970.0310.9980.028
2.6 不良反应和复发率比较 观察组不良反应发生率与对照组比较,差异无统计学意义(P>0.05);观察组复发率明显低于对照组[5.88%(2/34)比26.47(9/34),P<0.05]。见表6。

表6 2 组不良反应和复发率比较
3 讨论
HS 为临床常见良性肿瘤性疾病,通常发生在暴力创伤、皮肤烧烫伤或手术创伤后,即创面修复时可产生大量胶原蛋白和成纤维细胞,当胶原蛋白基因过度激活,成纤维细胞生长失控,则会导致真皮纤维化,并形成瘢痕[6]。其中HS 属病理性瘢痕类型,随瘢痕持续性增加可引发瘙痒、疼痛、痉挛等一系列临床表现[7]。经流行病学调查,皮肤烧烫伤患者发生HS 高达91.00%[8]。故临床上应引起重视。既往临床上对于HS 常采用冷冻、压迫和外科手术等方法治疗,但疗效差异较大,且较难控制HS 的发展。近年来,随着临床对HS 的不断研究,提出瘢痕内注射曲安奈德疗法,针对其作用机制分析表明,该药物能通过抑制瘢痕周围组织内成纤维细胞过度形成和胶原蛋白在瘢痕内沉积而缓解瘢痕持续性增生所引发的瘙痒、疼痛等临床症状,但曲安奈德属糖皮质激素类药物,大剂量使用可能会引发皮肤萎缩、色素沉着和毛囊炎等不良反应,而小剂量可能无法达到理想治疗效果[9-10]。
研究显示,仅采用一种方法治疗HS 较难控制其病理性发展趋势,并且容易复发,而综合性治疗有望取得显著疗效,以及更好地控制瘢痕持续性增生[11]。基于此点,本研究在曲安奈德治疗的基础上给予CO2点阵激光,即实施曲安奈德联合CO2点阵激光治疗的观察组,总有效率94.12%,显著高于给予曲安奈德单纯治疗的对照组(73.53%);与林琳等[12]研究结果“联合组总有效率高于曲安奈德组(96.97%比75.00%)”基本一致,由此可见曲安奈德联合CO2点阵激光治疗效果显著。其中,CO2点阵激光是利用发射高能激光脉冲作用于深层皮肤组织中的水分子而启动皮肤重新修复程序,即通过刺激深层皮肤组织中的水分子,使其气化并转化为硫化氢,促使生理胶原蛋白重排、纤维重新分布,进而对全层皮肤进行重塑及再生修复[13-14];也能通过抑制成纤维细胞过度生长或促进已形成的成纤维细胞凋亡而减少胶原蛋白合成,达到消除瘢痕目的[15]。故观察组瘢痕厚度与VSS 评分中的色泽、厚度、柔软度、血管分布维度评分及总评分均低于对照组,进一步佐证了上述方法联合治疗的有效性。
临床研究表明,瘢痕持续性增生可伴随新生血管生成,通过为病变区域提供充足血供及营养而进一步促进瘢痕组织的增大[16]。VEGF 为血管内皮细胞增殖调控因子,有促进血管形成、组织再生及创面修复的作用[17]。尽管血管形成能为创面愈合提供有利条件,但过多的血管生成极易造成瘢痕形成;TGF-β1 属促纤维细胞因子,当皮肤受损,组织修复因子可在TGF-β1 趋化作用下聚集于创伤位置,通过促进成纤维细胞分裂、增殖,使胶原蛋白大量产生,并加快纤维连接蛋白及层黏连蛋白合成速度,但过度分泌可打破细胞外基质形成和降解能力平衡,通过使细胞外基质沉积,导致HS 发生[18]。EGF是由巨噬细胞、血小板或单核细胞分泌的小分子蛋白,在细胞生长、增殖及发育过程中有重要作用,即在皮肤受损时,能通过与细胞表面某些受体结合,活化受体分子内蛋白激酶,并通过增强结缔组织的收缩能力,使创面愈合,但EGF 的高表达极易使细胞增殖作用失衡,导致创面愈合过度而形成瘢痕。本研究结果表明,2 组患者治疗前TGF-β1、VEGF和EGF 水平均处于异常表达状态,治疗后上述指标均较治疗前明显下降,尤其是观察组,可能是曲安奈德与CO2点阵激光联合治疗能进一步增强对成纤维细胞和新生血管的抑制,通过降低胶原蛋白生成,提高治疗HS 的效果。
研究表明,HS 的发生可能与炎性因子、炎性反应持续作用数周,导致局部组织进行性损伤或修复有关[19]。其中HS 持续炎性反应主要集中于真皮网状层,同时也是导致暴力创伤、皮肤烧烫伤愈后形成瘢痕的重要原因。本研究观察到HS 患者血清IFN-γ、TNF-α、IL-2 和IL-6 水平增加,而这些炎性因子又能通过与相应受体结合促进上述TGF-β1表达,并通过产生大量胶原在创面沉积,使瘢痕进行性增长。经曲安奈德联合CO2点阵激光治疗后,观察组患者IFN-γ、TNF-α、IL-2 和IL-6 水平较治疗前明显下降,且其下降幅度较对照组明显,提示以上2 种方法联合治疗效果更为明显,可能是通过抑制胶原纤维合成而减轻炎性反应。综上所述,曲安奈德联合CO2点阵激光治疗HS 有较为理想的效果,不仅能改善瘢痕血流灌注,并且能降低炎性因子及TGF-β1、VEGF 的表达水平。

