低盐锻炼对苗期番茄生长及抗氧化酶活性的影响
刘 抗,阿依夏·恩特马克,贾 凯,宁繁华,许红军
(1.新疆农业大学园艺学院,新疆 乌鲁木齐 830052;2.新疆东鲁水控农业发展有限公司,新疆 乌鲁木齐 844100)
番茄(LycopersiconesculentumMill.)是茄科番茄属植物,具有适应性强、栽培容易、产量高、营养丰富、口味独特、用途广泛等优点,是我国设施蔬菜中常见的果菜品种之一[1-2]。目前新疆鲜食番茄种植面积达到9.2万hm2,每年可生产910万t鲜果[3]。
新疆位于北纬34°25'—48°10',该区域光照充足,气候温和,年活动积温量高,昼夜温差较大,年平均日温差为14~16 ℃[4],拥有良好的光热条件,适宜番茄的生长,且适合设施番茄的种植,但是特殊的地理、气候条件使得当地土壤容易产生盐渍化问题。土壤盐渍化造成的渗透胁迫[5]、氧化胁迫[6]、离子毒害[7]等严重影响着作物的生长发育,成为产量和品质的重要限制因素。研究表明给予植物一定的非致死的胁迫处理,如干旱[8]、渍水[9]、高温[10]、冷冻[10-11]、盐[12]、碱[13]胁迫等,植物体会产生一些有效的变化来应对随之而来的更恶劣的逆境,与未经胁迫处理的植物相比其抗逆性增强。这种现象像是植物具有了对胁迫的“记忆力”或者“印记”,不仅能提高当代植物的抗逆性,有些甚至产生遗传效力[14]。
低盐锻炼能够有效提高植物的耐盐性。王瑞苓等[15]使用200 mmol/L NaCl浸种后,发现低盐锻炼可以提高华山松的株高和干鲜质量;宿梅飞等[16]使用50~100 mmol/L NaCl对樱桃番茄进行低盐锻炼,发现可有效增加超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性;李振庆[17]使用100 mmol/L NaCl对棉花幼苗进行低盐锻炼,使其过氧化氢(H2O2)、丙二醛(MDA)含量显著下降。但已有研究主要集中在水稻、柑橘、辣椒等,针对低盐锻炼能否提高番茄抗盐能力的报道较少。本研究通过使用不同低浓度盐溶液对番茄幼苗进行低盐锻炼,分析低盐锻炼对盐胁迫下番茄幼苗表型指标、生长量以及抗氧化酶活性的影响,以期筛选苗期低盐锻炼适宜浓度,为提高番茄苗期的耐盐性提供理论基础和实践参考。
1 材料和方法
1.1 试验材料
供试番茄品种为“KT636”,基质为草炭与蛭石(体积比3∶1),均购于当地农资市场。
1.2 试验方法
当番茄幼苗长至2叶1心时,参照苗期常规管理,分别浇灌含有0、25、50、75、100 mmol/L NaCl的1/2霍格兰德溶液,进行低盐锻炼。7 d后将幼苗均移入含有100 mmol/L NaCl的霍格兰德营养液中进行水培,模拟重度盐胁迫,分别标记为NS-100、T25-100、T50-100、T75-100、T100-100,以1/2霍格兰德营养液正常培养的幼苗为对照,具体见表1。高盐胁迫处理5 d后在各处理中挑选大小、长势一致的5株幼苗测定株高、茎粗、地上部干/鲜质量、地下部干/鲜质量、叶片干/鲜质量,选择相同部位的新鲜叶片测定酶活性。

表1 不同处理NaCl用量设计 mmol/L
1.3 测定指标及方法
1.3.1 生长指标测定
用卷尺测量番茄植株基部至生长点的距离,记为株高(mm);用游标卡尺测量从下往上第2片真叶与第3片真叶之间的节间,记为茎粗(mm);用直尺测量第2片真叶的叶长、叶宽,叶面积=叶长×叶宽×叶面积指数[18]。
用天平测完鲜质量(地上部鲜质量、地下部鲜质量、叶片新鲜质量)后将样品放入风干机中,风干后测定相应干质量(g)。植株干质量=地上部干质量+地下部干质量+叶片干质量。
1.3.2 酶活性测定
SOD活性采用氮蓝四唑(NBT)显色法测定;CAT活性参照陈建勋等[19]的方法测定,略有改动;POD活性参照王鲁阳[20]的方法测定,略有改动;抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)活性按照施建涛[21]的方法测定。
1.4 数据分析
采用Excel 2017和SPSS 19.0软件进行数据统计和方差分析。
2 结果与分析
2.1 低盐锻炼对番茄幼苗形态指标的影响
由表2可知,在100 mmol/L的NaCl盐胁迫下,一定浓度的低盐锻炼处理可缓解盐胁迫的抑制作用。与对照组相比,未经低盐锻炼的NS-100组番茄幼苗的株高显著降低了11.2%,低盐锻炼组中T25-100、T50-100组的株高均高于NS-100处理,但与对照组均无显著差异,而T75-100组、T100-100组的株高均显著低于对照组。这表明25、50 mmol/L的低盐锻炼可缓解盐胁迫对番茄幼苗株高的抑制作用,但是75、100 mmol/L的低盐锻炼则未起到锻炼作用,反而抑制了番茄幼苗的生长。
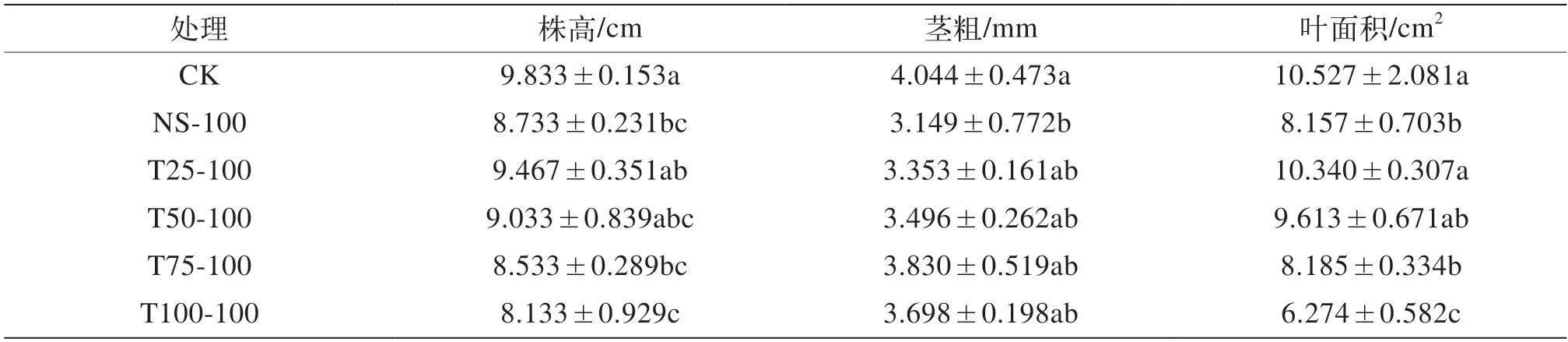
表2 低盐锻炼对盐胁迫下番茄苗期株高、茎粗与叶面积的影响
未经低盐锻炼的NS-100组番茄幼苗的茎粗较对照组显著降低了22.1%,而各低盐锻炼处理的茎粗均高于NS-100组且低于对照组,但与对照组均无显著差异。其中,T75-100组较对照组下降得最少,下降了5.3%,T25-100、T50-100、T100-100组分别下降了17.1%、13.5%、8.5%,这表明25、50、75、100 mmol/L的低盐锻炼均可缓解盐胁迫对番茄幼苗茎粗的抑制作用,其中75 mmol/L的低盐锻炼效果最好(表2)。
未经低盐锻炼的NS-100组番茄幼苗的叶面积较对照组显著减小22.5%,而低盐锻炼组中T25-100、T50-100组与对照组均无显著差异,且均大于NS-100处理,T75-100组显著小于对照组且与NS-100组无显著差异,T100-100组则显著小于对照组和NS-100组。这表明25、50 mmol/L的低盐锻炼均可缓解盐胁迫对番茄幼苗叶面积的抑制作用,而100 mmol/L的盐锻炼则未起到锻炼作用,反而显著抑制了植株叶片的生长(表2)。
2.2 低盐锻炼对番茄幼苗干物质量的影响
由表3可知,在100 mmol/L的NaCl盐胁迫下,未经低盐锻炼的NS-100组番茄幼苗的地上部干质量、地下部干质量、叶片干质量、植株干质量均较对照组降低,分别下降了37.3%、43.6%、11.1%、37.1%,且除叶片干质量外均与对照组差异显著。与未经低盐锻炼的NS-100组相比,T25-100在地上部干质量、地下部干质量、植株干质量方面均有显著提升,而T100-100组在地上部干质量、地下部干质量与植株干质量方面均显著下降,T50-100、T75-100组则与NS-100组间差异均不显著。这表明25 mmol/L的低盐锻炼可缓解盐胁迫对番茄幼苗干物质积累的抑制作用,但是100 mmol/L低盐锻炼则未起到锻炼作用,反而显著影响了植株地上部分的生长。

表3 低盐锻炼对盐胁迫下番茄苗期干物质量的影响
2.3 低盐锻炼对番茄幼苗抗氧化酶活性的影响
由图1可知,在100 mmol/L的NaCl盐胁迫下,与对照组相比,未经低盐锻炼的NS-100组番茄幼苗的SOD活性显著增加了51.1%;在低盐锻炼组中,T25-100组SOD活性最高,较对照组显著上升58.3%,T50-100、T75-100组分别显著上升44.1%、37.2%,而T100-100组则下降了2.1%,但与对照组差异不显著。T25-100、T50-100、T75-100组与NS-100组差异均不显著,说明25、50、75 mmol/L低盐处理均未起到锻炼作用,而100 mmol/L反而降低了番茄幼苗的SOD活性。

图1 各处理SOD活性比较
由图2可知,与对照组相比,未经低盐锻炼的N S-100组番茄幼苗的P O D活性显著升高了86.7%;在低盐锻炼组中T50-100组POD活性最高,较对照组显著增加247.5%,T25-100、T75-100、T100-100组则较对照组分别显著增加188.6%、55.1%、51.7%;与未经低盐锻炼的NS-100组相比,T25-100、T50-100组的POD酶活性均显著上升,说明25、50 mmol/L低盐处理均起到了锻炼作用。

图2 各处理POD活性比较
由图3可知,与对照组相比,未经低盐锻炼的NS-100组番茄幼苗的APX活性显著升高了78.6%;在低盐锻炼组中T25-100组APX活性最高,较对照组显著增加126.9%,其次是T75-100组,较对照组显著增加36.8%,T50-100、T100-100组与对照组间均无显著差异。与未经低盐锻炼的NS-100组相比,T25-100组APX活性显著提升,这表明25 mmol/L低盐处理可提高盐胁迫时番茄幼苗的APX活性。
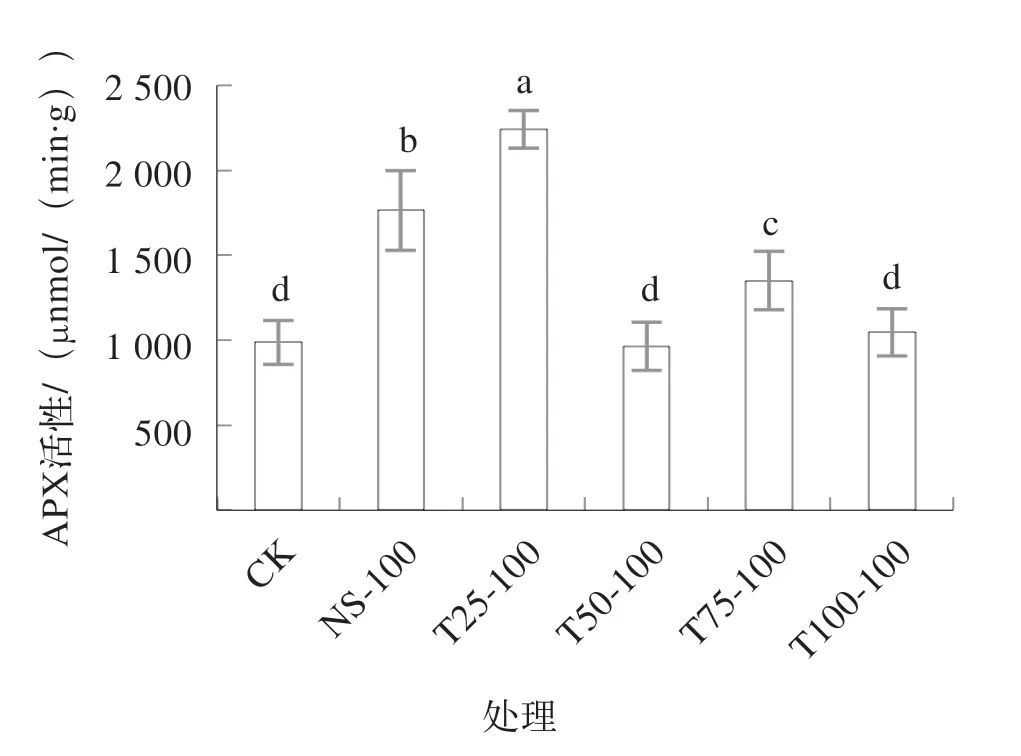
图3 各处理APX活性比较
由图4可知,与对照组相比,未经低盐锻炼的NS-100组番茄幼苗的CAT活性显著升高了170.3%;在低盐锻炼组中T25-100组CAT活性最高,较对照组显著增加211.7%,T50-100、T75-100、T100-100组也较对照组均显著增加,分别提升了50.2%、74.3%、103.8%。与未经低盐锻炼的NS-100组相比,T25-100组CAT活性有所上升,但二者间差异不显著,说明25 mmol/L低盐锻炼并未起到锻炼作用,T50-100、T75-100、T100-100处理CAT活性均显著降低,不仅没有起到锻炼作用,还抑制了番茄幼苗的抗氧化活性。

图4 各处理CAT活性比较
由图5可知,与对照组相比,未经低盐锻炼的N S-100组番茄幼苗的G R活性显著升高了70.9%;低盐锻炼组中T50-100组的GR活性最高,较对照组显著增加194.9%,T25-100、T75-100、T100-100组也均较对照组显著增加,分别提升了188.7%、64.2%、90.1%。与未经低盐锻炼的NS-100组相比,T25-100、T50-100、T100-100处理GR活性均显著上升,说明25、50、100 mmol/L低盐处理均起到了锻炼作用,75 mmol/L 低盐处理锻炼作用不大。

图5 各处理GR活性比较
3 讨论与结论
番茄盐害表型与形态特征由外部的盐胁迫环境与内部基因互作产生,可以直观反映出盐胁迫对植株的伤害[22]。盐胁迫条件下番茄植株体内有些生理生化指标的变化是对盐胁迫的一种适应性反应,可用于进行耐盐性的间接鉴定[23]。番茄在不同发育期的耐盐机制不同,其中在种子发芽期和幼苗生长期对盐胁迫最敏感[24]。秦立金[25]通过采用5种不同浓度Na2SO4浸种樱桃番茄种子,结果番茄幼苗的株高、最大叶面积均随盐胁迫浓度的增加呈现先上升后下降的趋势,这与本试验中25 mmol/L低盐锻炼提高番茄幼苗的株高、茎粗、叶面积的结果相似。闫妮[26]的研究表明,在Na2SO4盐胁迫下番茄幼苗干质量明显受到抑制,但低盐胁迫有利于番茄幼苗的生长。这与本试验中25、50 mmol/L低盐锻炼均可缓解盐胁迫对番茄幼苗植株干质量的抑制作用的结果一致。刘翔等[27]的试验结果也证实了番茄株高、茎粗的变化趋势与其耐盐性变化趋势相似,能够反映出植株耐盐性的强弱。
盐渍化造成的伤害和活性氧对植株的损伤有关。由于盐渍环境抑制了植物正常的光合磷酸化和呼吸作用,从而引起和促进活性氧的产生。刘俊英[28]研究发现,在盐胁迫下加入外源脯氨酸后,番茄幼苗叶片中的SOD、POD、CAT、PAX活性均呈下降趋势,与本研究中25 mmol/L的低盐锻炼可缓解盐胁迫对番茄幼苗SOD、POD、CAT、PAX、GR活性的抑制作用的结果一致。其中的作用机制可能是植物具有“记忆力”,前期的低盐锻炼激活了POD等抗氧化酶的基因表达,抗氧化酶相关基因在低盐锻炼时得以表达,并在之后持续转录表达,一旦再次受到盐胁迫就会快速响应[29-30]。
本试验结果表明,番茄幼苗在100 mmol/L盐胁迫下的株高、茎粗、叶面积、地上部干质量、地下部干质量、植株干质量均较对照降低,POD、CAT、GR活性则均显著上升。与未经低盐锻炼的幼苗相比,经过25、50、75、100 mmol/L低盐锻炼的处理在株高、茎粗、叶片干质量方面并没有显著变化;25 mmol/L低盐锻炼可以显著提高盐胁迫下番茄幼苗的叶面积、地上部干质量、地下部干质量和植株干质量以及POD、APX、GR的活性。综上所述,25 mmol/L低盐锻炼可在一定程度上提高番茄幼苗的耐盐性。

