Cu2+、Pb2+对青海湖裸鲤的急性毒性效应及相关基因表达的影响
李梓瑄,金文杰,李长忠
(青海大学生态环境工程学院,西宁 810016)
青海湖是我国内陆最大的半咸水湖。其独特的地理位置和生物多样性使周边环境处于特殊类型的生态系统中,对青海湖的研究具有重要的生态保护价值和科学意义。青海湖裸鲤(Gymnocyprisprzewalskii)属鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae)裸鲤属(Gymnocypris),是青海湖中的特有鱼种,对青海湖生态系统的动态平衡起着至关重要的作用[1]。
一些重金属会对鱼体产生不良影响,而且作为机体生存必需的微量元素参与多种生理功能,在鱼类正常生命活动中发挥不可或缺的作用。Cu2+可参与造血、黑色素合成、骨骼发育和机体免疫过程,维持铁的正常代谢[2]。在毒性作用方面,Cu2+可以催化羟基自由基的形成,使脂肪和蛋白质发生氧化,蛋白盐溶性降低[3]。而作为机体生命活动的非必需元素,Pb2+在鱼体内不参与任何生理过程,且会毒害鱼体各组织和器官,主要表现在对机体血液、生殖、抗氧化免疫等相关生理过程造成的不利影响[4]。Pb2+会与血红蛋白发生相互作用,通过提高血红蛋白的自氧化程度,诱导细胞组织氧化损伤的发生[5]。
在传统毒理学中常以半致死浓度(LC50)和致死浓度(LC100)来确定后续实验重金属胁迫浓度,并探究该浓度对于鱼类的影响,然而重金属浓度在达到LC50前,鱼体内分子伴侣、金属螯合、免疫应答等相关基因早已被激活;在达到LC50和LC100前,水生生态系统的安全和水生生物的生长已受到严重的影响。在低浓度重金属(低于各个国家水质标准)条件下,鱼体内相关基因调节机制早已启动并产生应答,低浓度重金属对鱼类影响的研究可以更加真实地反映出水体重金属污染对鱼类的危害。对青海湖底泥沉积物中的重金属含量及生态风险进行调查后发现,砷(As,13.21 mg/kg)和镉(Cd,0.21 mg/kg)的浓度超出自然本底值1.13倍和1.53倍,存在较高的潜在生态风险,污染程度依次为Cd>Pb>As>Cu>Zn>Ni>Cr。通过对重金属相关性进行分析,发现沉积物中锌(Zn)、铜(Cu)、铅(Pb)、钴(Co)、镍(Ni)、镉(Cd)和铬(Cr)均来自自然源[6]。在遇到水流扰动、水体的pH、电导率、溶解氧等环境条件发生变化时,沉积在底泥中的重金属又会被释放出来,再次进入水相中,造成二次污染。
因此本研究选择在青海湖区域内水体、底泥、土壤及动植物体内最常见的重金属Pb和Cu[6-11],胁迫青海湖裸鲤1龄幼鱼。以期通过对青海湖裸鲤关键基因的筛选及其在低浓度重金属离子胁迫后应答反应方面的研究,为渔业水体的安全监测提供检测指标,并为青海湖裸鲤的保护和人工繁育提供保障。
1 材料与方法
1.1 材料
研究中1龄青海湖裸鲤取自青海湖裸鲤救护中心恒温养殖车间,体长为(12.12±1.34)cm,体重为(17.18±2.23)g。实验前将青海湖裸鲤暂养于青海大学生态环境工程学院实验室方形鱼缸(1 206 mm×838 mm×910 mm)中。鱼缸提前用高锰酸钾(KMnO4)消毒浸泡2 d,清洗干净后注入自来水(pH=6.8)曝气3 d。暂养期间水中的溶解氧为(7.5±0.4)mg/L,温度为(16.0±0.3)℃,pH为7.0±0.2。暂养期间正常投喂,每2 d换水一次,持续曝气,实时监测水体中的各项指标。暂养期间未出现死亡,实验前一天停止投喂及换水。暂养7 d后开始实验。
1.2 方法
1.2.1 Cu2+、Pb2+对青海湖裸鲤的急性毒性效应
采取静态暴露方式进行实验[12],实验周期为96 h。根据国家渔业水质标准(GB 11607-89)中规定Cu2+≤ 0.01 mg/L、Pb2+≤ 0.05 mg/L,选取高于标准值10、20、50、100和200倍,Cu2+、Pb2+单一毒性实验中各设置5个浓度梯度,Cu2+(0.1、0.2、0.5、1.0和2.0 mg/L),Pb2+(0.5、1.0、2.5、5.0和10.0 mg/L),在各浓度下分别设置三组平行及一个空白对照组。在方形鱼缸中使用CuSO4·5H2O和Pb(NO3)2配置好各浓度的重金属离子溶液之后,每个缸中放置20尾鱼,持续监测水中理化指标。实验开始,实时记录24、48和96 h时青海湖裸鲤的生存状况,并计算各重金属离子的LC50和安全浓度。
根据上述单一毒性实验得到的安全浓度,以一个安全浓度为一个毒性单位,选取毒性比为1∶1,Cu2+与Pb2+安全浓度×1,×2,×3,×4及×5复合毒性下对青海湖裸鲤进行同上的方法胁迫。得出Cu2++ Pb2+复合毒性对青海湖裸鲤的影响。
1.2.2 低浓度Pb2+、Cu2+胁迫后青海湖裸鲤免疫相关基因的表达
实验开始,将暂养中的鱼随机放置在9个低浓度重金属胁迫组,分别为Cu2+=0.000 4 mg/L(C1),Cu2+=0.002 mg/L(C2),Cu2+=0.01 mg/L(C3),Pb2+=0.002 mg/L(P1),Pb2+=0.01 mg/L(P2),Pb2+=0.05 mg/L(P3),Cu2++Pb2+=0.000 4 mg/L + 0.002 mg/L(CP1),Cu2++ Pb2+=0.002 mg/L + 0.01 mg/L(CP2),Cu2++Pb2+=0.01 mg/L + 0.05 mg/L(CP3)的小型水族箱中,每个处理条件各设置三组平行,每个缸中15尾鱼。在以上条件下胁迫0、6、12、24和48 h后取样,每个平行取3尾鱼。经MS-222麻醉后,取鳃、肾脏、肝脏经液氮速冻后转移到-80 ℃冰箱中保存作为后续免疫相关基因的测定样本。
实验采用总RNA提取试剂盒(DP424,天根)提取1龄青海湖裸鲤各组织的总RNA,PrimeScriptTM Ⅱ1st strand cDNA synthesis Kit试剂盒反转录合成cDNA。对比不同物种各基因的序列,在该基因的保守区,使用Premier 5.0设计引物,送由北京擎科生物科技有限公司合成。序列如表1所示。
以β-actin为内参,用荧光定量PCR仪(Light Cycler 96 SW1.1,罗氏)测定不同胁迫条件下各基因的相对表达量。使用TB Green®PremixExTaqTMⅡ(Tli RNaseH Plus)试剂盒完成qPCR定量实验。PCR反应体系为20 μL,SYBR 10 μL,上下游引物各1 μL,cDNA模板1 μL和ddH2O 7 μL。反应程序为95 ℃预变性3 min;94 ℃变性1 min,60 ℃退火60 s,72 ℃延伸40 s,循环35次。
1.3 数据处理
1.3.1 Cu2+、Pb2+对青海湖裸鲤的毒性效应
使用Excel对数据进行计算分析,得出在不同时间(24、48和96 h)下单一与复合毒性研究中各重金属离子浓度对数和青海湖裸鲤死亡率之间的关系及回归方程,计算得到各时间点下的LC50及安全浓度。根据水生毒理复合效应相加指数法[13],评估Cu2+和Pb2+的复合毒性。利用公式(1)求出重金属离子毒性相加作用(S):
S=Am/A1+Bm/B1
(1)
式中Am、Bm分别为重金属离子复合毒性条件下试验动物的LC50,A1、B1为单一重金属离子毒性条件下试验动物的LC50。
由S求得相加指数(AI):
当S>1时,AI=1-S;当S≤1时,AI=1/S-1。
(2)
AI用来判断重金属离子复合毒性作用:当AI>0时,毒性作用为协同作用;当AI<0时,毒性作用为拮抗作用;当AI=0时,毒性作用为加和作用。
1.3.2 低浓度Pb2+、Cu2+胁迫后青海湖裸鲤免疫相关基因的表达
2 结果
2.1 Cu2+、Pb2+对青海湖裸鲤的急性毒性效应
2.1.1 Cu2+、Pb2+单一与复合急性作用下青海湖裸鲤的行为反应
各试验浓度下,Cu2+和Pb2+对青海湖裸鲤的行为产生了较为明显的影响。与空白对照组相比,青海湖裸鲤游动能力及其他生命体征正常,青海湖裸鲤在重金属离子胁迫初期变得兴奋,在缸中四处游动,约6 h后开始出现异常行为特征。随着重金属离子浓度的升高青海湖裸鲤表现的越来越兴奋,在1、2 mg/L的Cu2+和5、10 mg/L的Pb2+胁迫下大多青海湖裸鲤会不断浮头,试图跳出水面。随着毒性作用时间的延长,在0.1、0.2、0.5 mg/L的Cu2+和0.5、1、2.5 mg/L的Pb2+胁迫下青海湖裸鲤逐渐适应,不再兴奋,而在1、2 mg/L的Cu2+和5、10 mg/L的Pb2+胁迫下仍有少数青海湖裸鲤试图跃出水面。大约24 h后在1、2 mg/L的Cu2+和5、10 mg/L的Pb2+胁迫下青海湖裸鲤出现身体失衡,侧游、翻转等情况。未死亡的青海湖裸鲤游动速率明显变慢,相对静止,呼吸速率也明显放缓,体表粘液分泌旺盛,部分青海湖裸鲤失去生命体征后腹部朝上漂浮在水面上。
在复合毒性实验中,对青海湖裸鲤产生的毒性作用比单一毒性作用下更强烈。相同时间内复合毒性条件下青海湖裸鲤死亡率大于单一毒性下青海湖裸鲤的死亡率,青海湖裸鲤全数死亡的时间也比单一毒性作用下的短。
2.1.2 Cu2+、Pb2+单独作用下对青海湖裸鲤的急性毒性
Cu2+对青海湖裸鲤的急性毒性实验结果如表2所示。空白对照组中青海湖裸鲤均未出现死亡。随着Cu2+浓度及接触染毒时间的延长,对青海湖裸鲤鱼体产生的不良反应加剧,出现死亡的时间提早。

表2 Cu2+对青海湖裸鲤毒性作用Tab.2 Toxic effects of Cu2+ on G.przewalskii
Pb2+对青海湖裸鲤的急性毒性实验结果如表3所示。
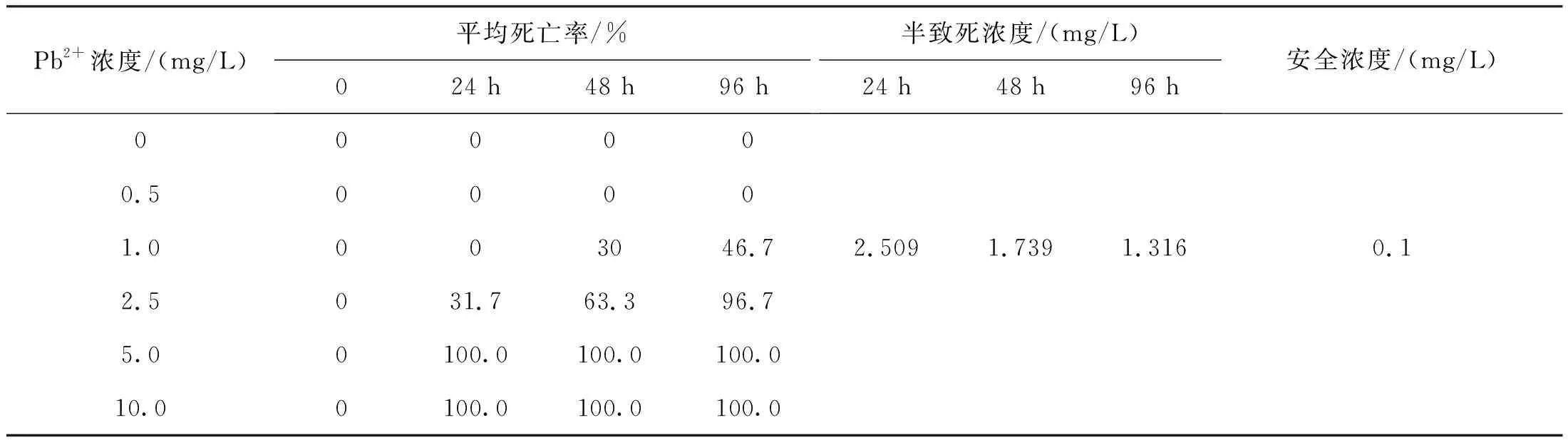
表3 Pb2+对青海湖裸鲤毒性作用Tab.3 Toxic effects of Pb2+ on G.przewalskii
2.1.3 Cu2+、Pb2+复合作用下对青海湖裸鲤的急性毒性
以上述Cu2+、Pb2+单一存在下的安全浓度为一个毒性单位,在毒性单位1~5倍下,进行Cu2++ Pb2+复合毒性作用后对青海湖裸鲤的急性毒性实验结果如表4所示。
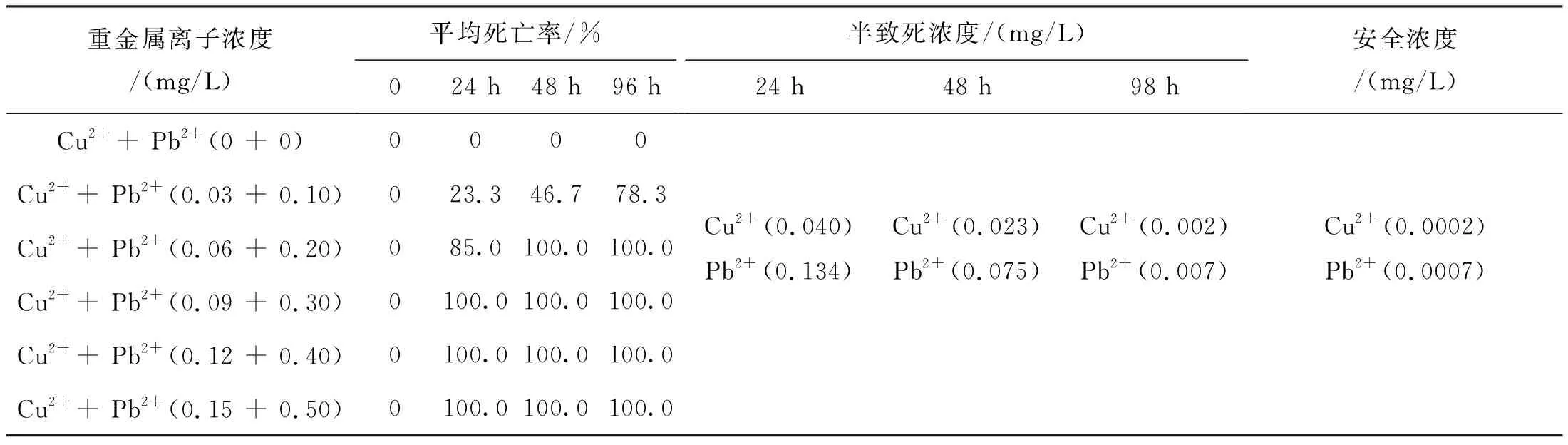
表4 Cu2+ + Pb2+对青海湖裸鲤毒性作用Tab.4 Toxic effects of Cu2+ + Pb2+ on G.przewalskii
由表5可知,Cu2++ Pb2+复合毒性作用下,各时间下AI均小于0,Cu2++ Pb2+对青海湖裸鲤的毒性作用为拮抗作用。
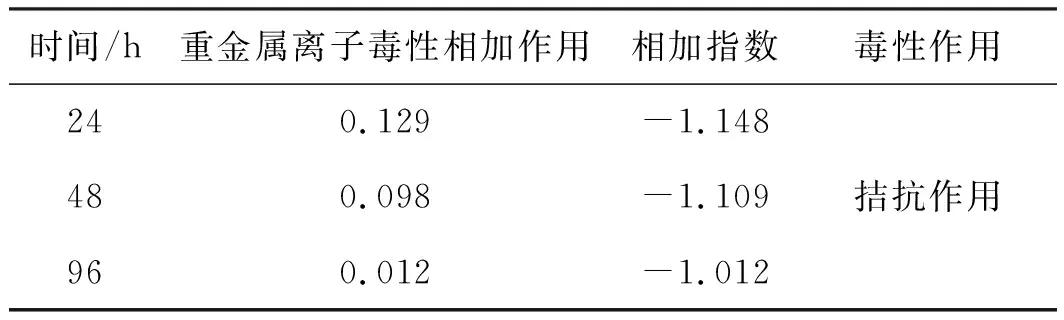
表5 Cu2+和Pb2+共存对青海湖裸鲤复合毒性作用结果Tab.5 Results of the combined toxicity effects of Cu2+ and Pb2+ coexistence on G.przewalskii
2.2 低浓度Pb2+、Cu2+胁迫后青海湖裸鲤免疫相关基因的表达
如图1A所示,与空白对照组相比,6 h时,Nrf2相对表达量在浓度CP3胁迫下有最大值,且是空白对照组表达量的3.8倍。Cu2+胁迫下,随着浓度的升高Nrf2相对表达量呈上调趋势,Pb2+及Cu2++ Pb2+胁迫下,随浓度升高Nrf2表达量均呈现先下调后上调的变化趋势。总体上,Cu2++ Pb2+胁迫下Nrf2相对表达量更高;12 h时,在C3胁迫下达到峰值,是空白对照组的3.5倍。48 h时,Cu2+、Pb2+及Cu2++ Pb2+胁迫下,随着浓度的升高Nrf2相对表达量下调。总体来看,随着时间的延长,Nrf2相对表达量在不同重金属胁迫下呈下调趋势。如图1B所示,与空白对照组相比,在Cu2+、Cu2++ Pb2+胁迫6 h后,随浓度升高肾脏Nrf2相对表达量呈下调趋势;12 h时,Pb2+、Cu2++ Pb2+胁迫下肾脏Nrf2相对表达量均下调;24 h时,Cu2+、Pb2+及Cu2++ Pb2+胁迫下,肾脏Nrf2相对表达量均下调;48 h时,Cu2+、Pb2+胁迫下肾脏Nrf2相对表达量均先上调后下调,在Cu2++ Pb2+胁迫下肾脏Nrf2相对表达量随浓度升高呈下调趋势。如图1C所示,与空白对照组相比,6 h时,在Cu2+、Cu2++ Pb2+胁迫下肝脏Nrf2相对表达量,随着浓度的升高而上调,在C3胁迫下达到最大值,是空白对照组的1.9倍;12 h时,在Cu2++ Pb2+胁迫下肝脏Nrf2相对表达量随着浓度的升高而上调,且在CP3胁迫下有最大值,是空白对照组的1.6倍;24 h时,肝脏Nrf2相对表达量在C2胁迫下达到最大值;48 h时,在各组条件下肝脏Nrf2相对表达量均下调,在浓度为CP3胁迫下有最小值,是空白对照组的0.4倍。
如图2A所示,与空白对照组相比,6 h时,鳃Keap1相对表达量在P3胁迫下有最大值,是空白对照组的2.3倍,在不同浓度Cu2+胁迫下,鳃Keap1相对表达量下调;12 h时,在Cu2+、Pb2+胁迫下鳃Keap1相对表达量均下调,在Cu2++ Pb2+胁迫下随浓度升高鳃中的Keap1相对表达量上调,在CP3胁迫下有最大值,是空白对照组的2.9倍;24 h时,鳃中的Keap1相对表达量几乎均出现下调;48 h时,各条件下鳃Keap1相对表达量均差异不显著。如图2B所示,与空白对照组相比,6 h时,在Cu2+胁迫下肾脏Keap1相对表达量下调。在Cu2++ Pb2+胁迫下随浓度升高肾脏Keap1相对表达量降低;12 h和24 h时,各条件下肾脏Keap1相对表达量均下调且差异不显著。如图2C所示,6 h时,在Cu2+、Pb2+胁迫下,肝脏Keap1相对表达量随浓度升高而上调,但均低于空白对照中的表达量;12 h时,肝脏Keap1相对表达量在Cu2+、Pb2+胁迫下随浓度升高而下调,在Cu2++ Pb2+胁迫下上调,在CP3胁迫下达到最大值,是空白对照组的1.9倍;24 h时,在Cu2++ Pb2+胁迫下随浓度升高肝脏Keap1相对表达量上调,在CP3复合条件下达到最大值,是空白对照组的2.9倍;48 h时,在不同条件下Keap1相对表达量无显著变化。
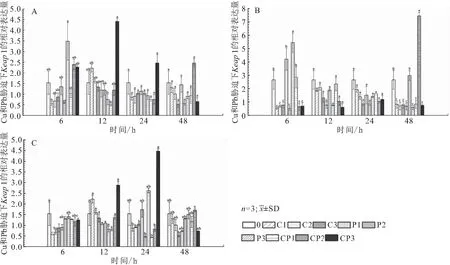
图2 低浓度铜铅胁迫下对1龄青海湖裸鲤鳃(A)、肾脏(B)和肝脏(C)中Keap1 mRNA相对表达量的影响Fig.2 he effect of low concentration of copper and lead stress on the expression of Keap1 mRNAin gill(A),kidney(B)and liver(C)of 1 aged G.przewalskii
如图3A所示,与空白对照组相比,6 h时,在Cu2+、Pb2+及Cu2++ Pb2+胁迫下鳃MT相对表达量均下调;12 h时,在CP2胁迫下其表达量达到最大值,是空白对照组的1.6倍,其余各浓度下鳃MT相对表达量均下调;24 h和48 h时,各重金属离子胁迫下鳃MT相对表达量均呈下调趋势。如图3B所示,与空白对照组相比,肾脏MT相对表达量在P3胁迫下6 h时达到最大值,是空白对照组的3.2倍;12 h时,在Cu2+、Pb2+胁迫下肾脏MT相对表达量先上调后下调,Cu2++ Pb2+胁迫下均随着浓度的升高肾脏MT相对表达量下调;24 h时,在Cu2+、Pb2+胁迫下肾脏MT相对表达量均变化不显著,在CP3条件下MT相对表达量显著升高,达到峰值为空白对照组的4.5倍;48 h时,在Cu2+胁迫下,随浓度升高肾脏MT相对表达量下调,在Pb2+、Cu2++ Pb2+胁迫下,随着浓度的升高肾脏MT相对表达量先上调后下调。如图3C所示,与空白对照组相比,6、12、24及48 h时,在Cu2+、Pb2+与Cu2++ Pb2+胁迫下,肝脏中MT相对表达量均下调。
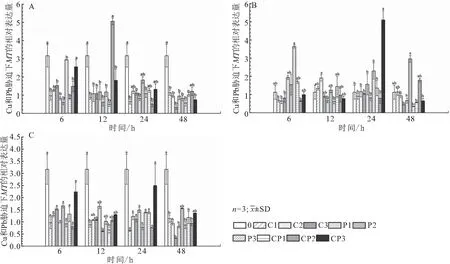
图3 低浓度铜铅胁迫下对1龄青海湖裸鲤鳃(A)、肾脏(B)和肝脏(C)中MT mRNA相对表达量的影响Fig.3 The effect of low concentration of copper and lead stress on the expression of MT mRNAin gill(A),kidney(B)and liver(C)of 1 aged G.przewalskii
如图4A所示,与空白对照组相比,6 h时,鳃TNF-α相对表达量在Cu2+胁迫下随着浓度的升高上调,在Pb2+、Cu2++ Pb2+胁迫下先下调后上调;12 h时,在Cu2+、Cu2++ Pb2+胁迫下,随着浓度的升高鳃TNF-α相对表达量上调,在Pb2+条件下随着浓度的升高鳃TNF-α相对表达量下调;24 h时Cu2+、Pb2+及Cu2++ Pb2+胁迫下鳃TNF-α相对表达量均随着浓度的升高先上调后下调;48 h时,与24 h的变化相反且其值在P3胁迫下达到最大值,是空白对照组的2.8倍。如图4B所示,与空白对照组相比,6、12及24 h时,在Cu2+、Pb2+、Cu2++ Pb2+胁迫下肾脏TNF-α相对表达量均下调;48 h时,各条件下随着浓度的升高肾脏TNF-α相对表达量呈现先是上调后下调的趋势,在P1胁迫下其表达量有最小值,为空白对照组的0.1倍。如图4C所示,与空白对照组相比,6 h时,各条件下肝脏TNF-α相对表达量无显著变化;12 h时,Cu2+胁迫下随着浓度的升高肝脏TNF-α相对表达量升高,在C3条件下达到最大值,为空白对照组的2.1倍。在Pb2+、Cu2++ Pb2+胁迫下,随着浓度的升高肝脏TNF-α相对表达量先上调后下调;24 h时,各条件下肝脏TNF-α相对表达量均无显著差异;48 h时,在Cu2+胁迫下肝脏TNF-α相对表达量无显著差异,在浓度P3下其表达量有最大值为空白对照组的3倍。

图4 低浓度铜铅胁迫下对1龄青海湖裸鲤鳃(A)、肾脏(B)和肝脏(C)中TNF-α mRNA相对表达量的影响Fig.4 The effect of low concentration of copper and lead stress on the expression of TNF-α mRNAin gill(A),kidney(B)and liver(C)of 1 aged G.przewalskii
如图5A所示,与空白对照组相比,6 h时,鳃Hsp90相对表达量在P3胁迫下有最大值,为空白对照组的11.2倍;12和24 h时,在各胁迫条件下鳃Hsp90相对表达量均无显著差异;48 h时,在Cu2+胁迫下随着浓度的升高鳃Hsp90相对表达量先上调后下调,在Pb2+、Cu2++ Pb2+胁迫下随着浓度的升高鳃Hsp90相对表达量上调。48 h时,在P3胁迫下有最大值,其表达量为空白对照组的6.5倍。如图5B所示,与空白对照组相比,6 h时,肾脏Hsp90相对表达量在P3胁迫下有最大值,为空白对照组的3.8倍;12 h时,各条件下肾脏Hsp90相对表达量均下调;24 h时,肾脏Hsp90相对表达量在P1胁迫下有最大值,为空白对照组的4.1倍;48 h时,在Cu2+、Pb2+及Cu2++ Pb2+胁迫下,随着浓度的升高肾脏Hsp90相对表达量下调。如图5C所示,与空白对照组相比,6 h时,肝脏Hsp90相对表达量在P3胁迫下有最大值,为空白对照组的2.9倍;12 h时,肝脏Hsp90相对表达量在P1胁迫下有最大值,为空白对照组的2.6倍;24和48 h时,各条件下肝脏Hsp90相对表达量无显著差异。
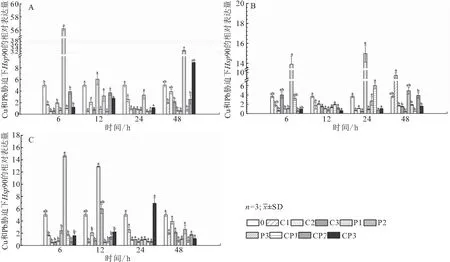
图5 低浓度铜铅胁迫下对1龄青海湖裸鲤鳃(A)、肾脏(B)和肝脏(C)中Hsp90 mRNA相对表达量的影响Fig.5 The effect of low concentration of copper and lead stress on the expression of Hsp90 mRNAin gill(A),kidney(B)and liver(C)of 1 aged G.przewalskii
如图6A所示,与空白对照组相比,6 h时,在Cu2+、Pb2+、Cu2++ Pb2+胁迫下,随着浓度的升高鳃Hsp70相对表达量上调,在P3胁迫下有最大值,为空白对照组的4.5倍;12 h时,在CP2胁迫下鳃Hsp70相对表达量达到最大值,是空白对照组的3倍;24 h时,各条件下鳃Hsp70相对表达量均下调;48 h时,鳃Hsp70相对表达量在CP2胁迫下达到最大值,是空白对照组的2倍。如图6B所示,与空白对照组相比,6 h时,在Cu2+、Pb2+、Cu2++ Pb2+条件下肾脏Hsp70相对表达量均无显著差异,肾脏Hsp70相对表达量在P3胁迫下有最大值,为空白对照组的3.3倍;12 h时,在Cu2+、Cu2++ Pb2+胁迫下,随浓度的升高肾脏Hsp70相对表达量下调,在C1胁迫下肾脏Hsp70相对表达量有最大值,为空白对照组的22.1倍,24、48 h时,各胁迫下肾脏Hsp70相对表达量均无显著差异。如图6C所示,与空白对照组相比,6 h时,肝脏Hsp70相对表达量在P2条件下有最大值,为空白对照组的4.1倍;12 h时,肝脏Hsp70相对表达量也在上述胁迫下有最大值,为空白对照组的2.6倍;24、48 h时,各胁迫条件下肝脏Hsp70相对表达量均无显著差异。

图6 低浓度铜铅胁迫下对1龄青海湖裸鲤鳃(A)、肾脏(B)和肝脏(C)中Hsp70 mRNA相对表达量的影响Fig.6 The effect of low concentration of copper and lead stress on the expression of Hsp70 mRNA in gill(A),kidney(B)and liver(C)of 1 aged G.przewalskii
如图7所示,与空白对照组相比,在6、12、24和48 h时,各胁迫条件下鳃、肾脏及肝脏中的iNOS相对表达量均显著下调。
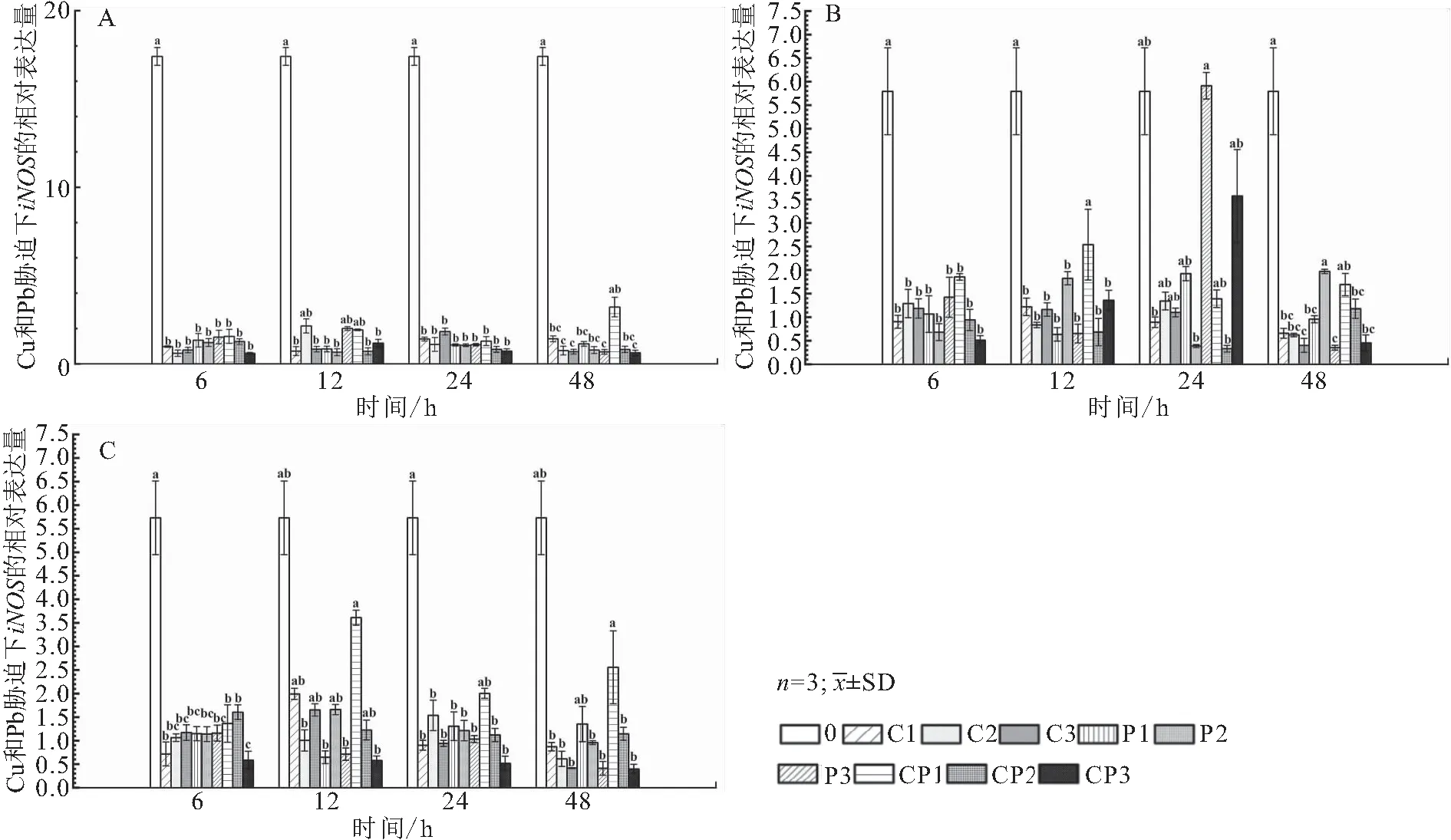
图7 低浓度铜铅胁迫下对1龄青海湖裸鲤鳃(A)、肾脏(B)和肝脏(C)中iNOS mRNA相对表达量的影响Fig.7 The effect of low concentration of copper and lead stress on the expression of iNOS mRNAin gill(A),kidney(B)and liver(C)of 1 aged G.przewalskii
如图8A所示,与空白对照组相比,6 h时,在Cu2+胁迫下,随着浓度的升高鳃COX-2相对表达量先下调后上调,在Pb2+、Cu2++ Pb2+胁迫下,均随着浓度的升高鳃COX-2相对表达量下调;12 h时,在CP3胁迫下鳃COX-2相对表达量有最大值,为空白对照组的2.1倍;24 h时,在Cu2+、Pb2+及Cu2++ Pb2+胁迫下,随着浓度的升高鳃COX-2相对表达量先上调而后下调,在CP2胁迫下鳃COX-2相对表达量有最大值,为空白对照组的1.3倍;48 h时,鳃COX-2相对表达量在C1胁迫下有最大值,为空白对照组的2.3倍。如图8B所示,与空白对照组相比,6 h时,肾脏COX-2相对表达量在C1胁迫下有最大值,为空白对照组的14.2倍;12、24和48 h时,各条件下肾脏COX-2相对表达量均无显著差异。如图8C所示,与空白对照组相比,6 h时,各条件下肝脏COX-2相对表达量均无显著差异;12 h时,肝脏COX-2相对表达量在P2胁迫下有最大值,为空白对照组的1.7倍;24 h时,各条件下肝脏COX-2相对表达量均无显著差异;48 h时,在Pb2+胁迫下,随着浓度的升高肝脏COX-2相对表达量上调,在Cu2+、Cu2++ Pb2+胁迫下,随着浓度的升高肝脏COX-2相对表达量下调。在各个时间点,Cu2++ Pb2+胁迫下,随着浓度的升高肝脏COX-2相对表达量均下调。
3 讨论
3.1 Cu2+、Pb2+对青海湖裸鲤的毒性效应
鱼类容易受到水体环境变化的影响,当水体中重金属的含量较高时,就会对鱼体产生癌变或畸变等毒性作用,重金属离子浓度达到一定程度会突破鱼类的承受能力甚至引发死亡。Cu2+和Pb2+对鱼类毒性作用的大小,主要取决于游离的重金属离子浓度和处理时间,浓度越高处理时间越长毒性作用越强烈[15-16]。毒物之间的复合作用有三种类型:协同作用、拮抗作用和加和作用[17]。
关于重金属对水体生物毒性作用由于重金属种类浓度和试验动物以及水生生物生活环境和生存周期的不同,使得试验结果存在一定差异性。研究表明,Cu2+对中华倒刺鲃(Spinibarbussinensis)[18]96、120、144和168 h时的LC50分别为0.500、0.401、0.356和0.352 mg/L,安全浓度为0.05 mg/L;对日本黄姑鱼(Argyrosomusjaponicus)[19]在24、48、72和96 h时相应LC50分别为3.178、2.924、2.755和2.63 mg/L,安全浓度为26.3 mg/L;对中国花鲈(Lateolabraxmaculatus)[20]幼鱼24、48、72和96 h的LC50分别为1.85、1.66、1.48和0.86 mg/L,安全浓度为8.6 mg/L。水体中Pb2+对鲫(Carassiusauratus)、草鱼(Ctenopharyngodonidellus)、南方鲇(Silurusmeridionalis)、团头鲂(Megalobramaamblycephala)、中华倒刺鲃和胭脂鱼(Myxocyprinusasiaticus)的96 h LC50分别为3.73、11.59、6.59、3.27、0.33和3.00 mg/L[21]。与本研究中得到结果相比,Cu2+对1龄青海湖裸鲤的24、48和96 h的LC50分别为0.528、0.422和0.295 mg/L;Pb2+对1龄青海湖裸鲤的24、48和96 h的LC50分别为2.509、1.793和1.316 mg/L,青海湖裸鲤的LC50与安全浓度更低,对重金属离子更加敏感。这可能是由于青海湖裸鲤的栖息地水域几乎没有污染,周围不存在重金属离子的来源,在面对不同重金属的胁迫时青海湖裸鲤的耐受性就更差。
重金属复合发生拮抗作用时,细胞膜的通透性被减弱,鱼体渗透作用减弱,从而造成的毒性作用弱于单一存在时的毒性[22]。研究表明,Cu2+和Pb2+共存时对金鱼(C.auratusLinnaeus)24 h、48 h和72 h时计算得到的AI均大于0,Cu2++ Pb2+表现出极强的协同作用[23]。Cu2+和Pb2+不论是在毒性比为1∶1还是质量浓度为1∶1条件下,对鱼类均产生毒性协同作用[24]。但在对刚孵化的黑头软口鲦(Pimephalespromelas)进行Cu2++ Pb2+处理后,却发现两者具有拮抗作用[25-26]。本研究中得到Cu2++ Pb2+对青海湖裸鲤复合胁迫后具有拮抗作用,复合毒性作用比单一毒性作用下更强烈。可见重金属离子之间的相互作用形式也并非一成不变,明确复合毒性作用下青海湖裸鲤的生存情况,及两种重金属离子的作用方式,比较重金属单一与复合存在下,对青海湖裸鲤的毒性效应有何不同,可为了解青海湖裸鲤对不同重金属的敏感度提供理论依据,为更好地保护青海湖裸鲤栖息水域提供数据支撑。
3.2 低浓度Pb2+、Cu2+胁迫后青海湖裸鲤免疫相关基因的表达
Nrf2-Keap1系统在机体应激反应方面发挥重要作用[27],Keap1是Nrf2主要的胞内负调控调节因子[28]。MT参与大量与金属离子相关的生理过程(从解毒到维持稳态、再到储存和传递重金属)[29]。Hsps是一类高度保守应激蛋白和外部伴侣蛋白。另外发现在重金属存在条件下鱼类肝脏中免疫调节相关生物标志物TNF-α表达水平升高。iNOS是炎症过程的早期反应基因。许多环境胁迫因子都具有激活iNOS活性并使其生成NO的潜力[30]。除了iNOS以外,在免疫系统中COX-2也是早期炎症反应中的应答基因,常被用作炎症标志物。
不同重金属在低浓度胁迫下,对各个基因的表达均产生了不同的影响。这可能是各组织的功能差异导致的,鱼类的渗透离子调节主要通过渗透调节器官鳃、肾完成[31]。肝脏是鱼类最重要的解毒器官,可将体内新陈代谢的有毒废物转化为无毒、毒性较轻或易被降解的物质,通过胆汁或尿液排出体外,进而保障机体正常行使生理功能[32]。本研究结果显示引发炎症反应的相关因子TNF-α,iNOS及COX-2主要在肝脏中表达,可见低浓度重金属离子引起的炎症反应主要在肝脏,会对肝脏的解毒功能造成不利的影响。在重金属存在条件下鱼类肝脏中免疫调节相关生物标志物的相对表达水平会升高。鳃及肾脏中各基因均在不同浓度重金属离子条件下表现出不同于空白对照组的表达水平,说明各基因对于低浓度Cu2+、Pb2+存在应答反应。研究发现,机体在低浓度重金属离子暴露下可能会产生与高浓度重金属离子胁迫完全不同的生物学效应[33]。长期低剂量重金属Cu2+、Pb2+、Zn2+和Cd2+对水生生物泥蚶(Tegillarcagranosa)的研究表明,低剂量重金属长期胁迫虽不能导致机体死亡,但能影响其生长发育,并对机体抗氧化系统相关基因表达和种群的正常繁衍生息造成一定的影响[34]。在本研究中,低浓度Cu2+、Pb2+单一与复合条件下,各基因的变化情况均不相同,表明各基因在面对低浓度重金属胁迫时存在复杂的应答机制。
相较Cu而言,Pb属于毒性重金属,并具有高毒性[35],但两者以一定剂量存在于鱼体内时均会诱导炎症反应和抗氧化应激[36]。研究表明,在重金属胁迫后斑马鱼体内抗氧化系统相关基因表达量随着重金属离子浓度升高而上调,表明重金属存在下能上调抗氧化系统相关基因的表达。重金属可能通过Nrf2-Keap1信号通路激活下游抗氧化系统[37]。MT作为金属结合蛋白,在细胞层面,发挥着对机体重金属水平稳态稳定与消除毒性以及自由游离基清除等功能[38]。MT通过螯合作用降低金属毒性,参与氧化应激过程中相关酶类的合成,维持机体和细胞的稳态。Pb2+、Cd2+对锦鲤(Cyprinuscarpiohaematopterus)的毒理学研究表明,重金属暴露能诱导鱼体组织和血液产生大量MT表达,伴随两种重金属积累量的提高,Pb2+-MT和Cd2+-MT水平也迅速达到最高,并且通过血液循环运送到各个组织来应对外界重金属的毒害,所以MT对重金属在鱼体内的积累和排出过程起关键作用[39]。DEANE等[40]研究转录层面重金属(Cd2+、Cu2+和Ni2+)诱导黑鲷(Sparusmacrocephlus)热激同源蛋白(HSC70)和HSP70的表达水平,发现HSP70对水体中重金属相关危害物质有强烈响应。另外,陈晔等[41]发现Cd2+可以显著诱导褐菖鲉(Sebastiscusmarmoratus)肝脏HSP70的表达,且HSP60,HSP90和HSC70的表达量也有增加。总之,HSP就是作为一种保护性蛋白,当受到外界环境胁迫时,就会大量合成,阻止受损蛋白互作,促进有益互作,使机体维持正常的生理活动。本研究表明,在低浓度重金属Cu2+、Pb2+胁迫下青海湖裸鲤免疫调节相关生物标志物TNF-α相对表达水平显著变化。也就是说参与炎症反应的炎症反应因子在重金属损伤机体引发炎症反应时,TNF-α的表达会改变,激发细胞炎症反应。COX-2在正常组织内表达量较低,当机体受到重金属离子引发的炎症等刺激时,其表达水平可升高至空白对照组的数倍,导致炎症对组织造成损伤。iNOS通过产生NO起到防御功能,一般情况下iNOS不表达,常在受到刺激TNF-α等诱导下表达[42]。本研究表明,重金属暴露期间青海湖裸鲤组织中iNOS相对表达水平是降低的,尽管在暴露期间与暴露后没有显著差异。低浓度金属暴露下iNOS的生理反应一般遵循损伤修复模型,该结果表明了低浓度重金属暴露过程中机体也会发生炎症过程。iNOS具有双面作用,一方面可以作为防御毒害作用的因子,另一方面又生成NO,形成过氧亚硝酸盐造成细胞毒性。研究发现重金属镉诱导鱼类iNOS活性升高,生成大量NO[43]。iNOS诱导NO的生成,而NO是炎症和免疫调节的介质,研究发现在低浓度重金属Cu胁迫下,青海湖裸鲤肾脏中COX-2 mRNA水平没有显著变化,但是在肝脏中显著增强,表明COX-2可能在肝脏中受到Cu转录后水平上的调节。
由此可见,重金属离子对抗氧化免疫相关基因的表达会造成影响,但是如何影响及最终表现比较复杂,不能一概而论简单地归纳为诱导激活或抑制的变化规律。重金属对鱼类基因表达的影响反映出较大的差异性,不同种重金属或同种重金属不同剂量、不同作用时间,重金属单一与复合处理鱼类,都对机体抗氧化免疫、重金属解毒、热休克反应及炎症防御等方面的基因表达产生不同的影响,也反映出这些相关基因表达对环境应激源响应的综合性和复杂性。
4 结论
单一胁迫下,Cu2+和Pb2+的安全浓度分别为0.03 和0.1 mg/L;复合胁迫下,Cu2+和Pb2+的安全浓度分别为0.000 2和0.000 7 mg/L。Cu2++ Pb2+对青海湖裸鲤具有拮抗作用。低浓度Cu2+和Pb2+处理对青海湖裸鲤抗氧化免疫、重金属解毒、热休克反应及炎症防御等方面的基因表达产生不同影响,各基因均对重金属离子作出响应。

