例谈高考化学试题中的元素周期表(律)
杨冬清 许丽娟
(1.北京电子科技职业学院 2.人大附中北京经济技术开发区学校)
元素周期表重点讨论的是族序数“位”与原子核外电子“构”的关系.元素周期律是对元素性质呈现周期性变化实质的揭示.通过学习元素周期律,学生能加深对元素化合物性质的理解和记忆.更重要的是,对元素化合物知识进行拓展和归类,明确同一周期元素及其化合物性质的递变性和同一主族元素及其化合物性质的相似性、递变性,使元素化合物知识得以迁移与拓展.元素周期表是元素周期律的具体表现,元素周期律是元素周期表的编排依据.
在高考化学中,元素周期表(律)是必考内容,题干多以陌生的内容、推断题及性质比较的形式呈现,学生灵活运用所学知识的压力较大.本文通过对部分真题的分析,引导学生找到解答问题的方法.
1 真题分析
1.1 基本概念
A.Sr位于元素周期表中第六周期、第ⅡA 族
B.可用质谱法区分87Sr和86Sr
C.87Sr和86Sr含有的中子数分别为49和48
D.同一地域产出的同种土壤生物中87Sr/86Sr值相同
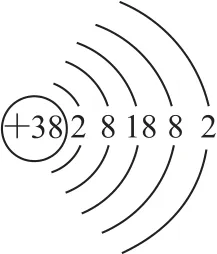
图1
【备考启示】本题主要考查了元素周期表的基本知识、核外电子的排布规律、核素的基本表达、质谱法的用途等.学生要建立自信,敢于用自己所学内容分析试题,用预测-验证-分析-结论的思路,既可以从正向分析也可以从反向分析.
1.2 元素周期表(律)
A.非金属性:X>Q
B.单质的熔点:X>Y
C.简单氢化物的沸点:Z>Q
D.最高价含氧酸的酸性:Z>Y
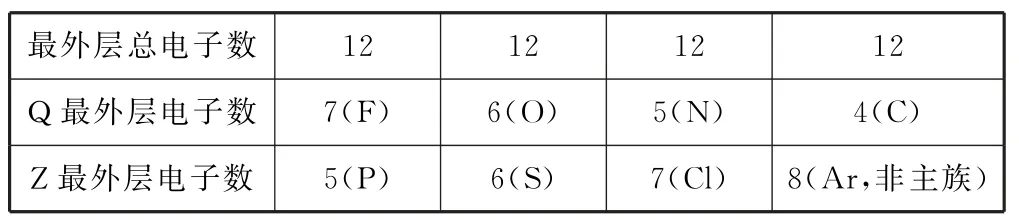
表1
从表1可以看出,Q 和Z各有3种情况.X 为Al元素,Q 可能为F、O、N,所以非金属性,Q>X,选项A 错误.X 为Al元素,Al为金属晶体,Y 为Si元素,Si为原子晶体,熔点极高,选项B错误.Z可能是P、S、Cl元素,氢化物分别是PH3、H2S、HCl,而Q 的氢化物分别是HF、H2O、NH3,Q 的氢化物都存在氢键,增强了分子之间的作用力,氢化物的稳定性Q>Z,选项C错误.Y 和Z同周期,且Y 在Z的左边,半径越小,非金属性越强,rZ<rY,非金属性Z>Y,Z 最高价氧化物的水化物对应的酸性强,答案为D.
【备考启示】元素周期表推断题要求学生从题干信息中挖掘关键信息,利用化学知识和数学关系确定未知元素的位置,再利用元素周期表确定元素性质.
A.酸性:HClO4>H2SO3>H2SiO3
B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3
D.非金属性:F>O>N
【备考启示】本题通过比较非金属原子、金属原子半径的大小,确定非金属性、金属性的强弱.在元素周期表中,比较主族元素的半径大小相对简单,同主族元素原子的核外电子层数越多,半径越大.短周期中的同周期元素相比较,因为同周期原子的核外电子层数相同,半径大小取决于质子数和电子数的吸引力、核外电子之间的斥力,前者作用较强,导致同周期元素从左到右,原子半径变小.因此可以利用元素周期表和元素周期律共同解答相关问题.
2 思维建模
从宏观角度去认识化学有助于学生理解相关知识,图2是从宏观角度解题的思路.
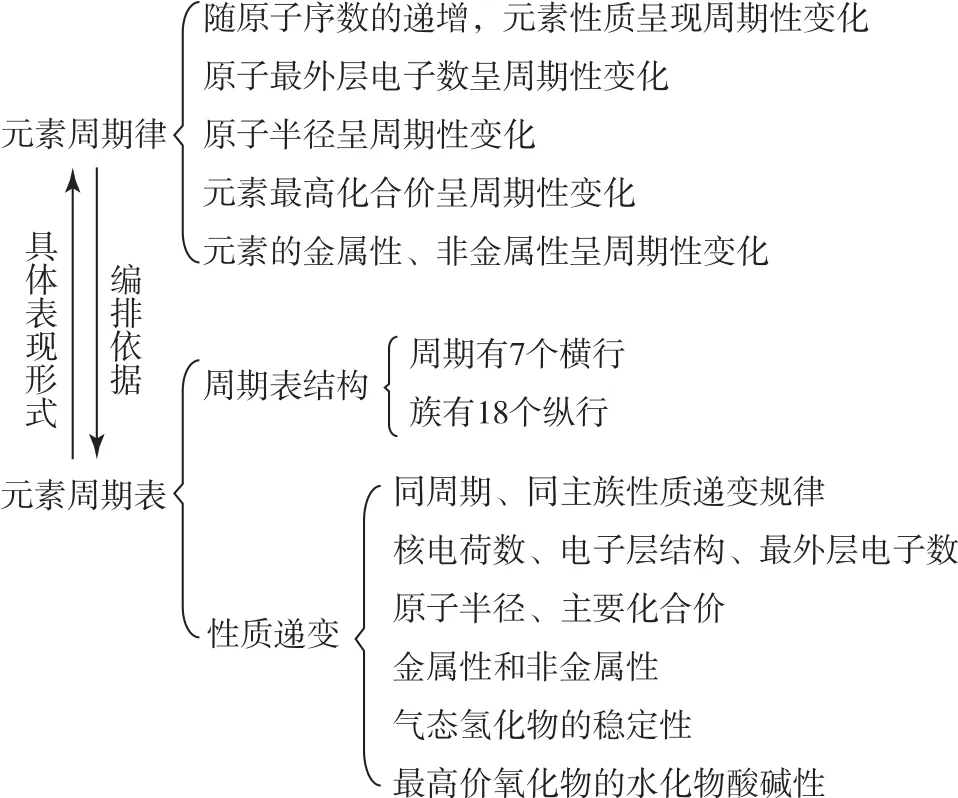
图2
3 思考与启示
在复习备考中,要能正确理解和书写短周期元素在元素周期表中的位置.通过书写原子核外电子排布规律,理解和掌握元素周期表中的变化规律.涉及元素周期表的推断题较难,学生要充分挖掘题干信息,以化学知识为载体,建立数学关系,确定未知元素在元素周期表中的位置.对于元素性质的判断,要会依据原子半径大小,判断性质递变的强弱.
(完)

