溃疡病的发生对半滑舌鳎体表黏膜菌群结构的影响
王祯辉 付建东 薛淑霞
摘 要:潰疡病是危害养殖半滑舌鳎的一种流行性疾病,黏膜菌群在维持鱼体健康中发挥了重要的作用。为了分析溃疡病的发生对半滑舌鳎体表黏膜菌群结构的影响,利用高通量测序技术对体表黏膜菌群16S rRNA基因的V4高变异区进行测序,分析了健康(MH)、患溃疡病早期(体表散布小的溃疡点)(PMD)和晚期(体表有明显溃疡灶)(MD)的半滑舌鳎体表黏膜菌群结构。结果表明:在MH、PMD和MD样本中分别鉴定到了4 036、1 758、1 763个OUTs(Operational Taxonomic Units)。在属分类水平上,MH样品中Pseudoalteromonas、unidentified_Chloroplast、Blautia和Bifidobacterium丰度较高,而在PMD和MD样品中,其优势菌群是Pseudomonas和Vibrio。物种注释表明,MH样品中的细菌菌群结构比PMD和MD样品中的细菌群落更具多样化。细菌分离结果显示,在PMD和MD样品中发现了更多潜在的致病菌。综上,在养殖半滑舌鳎溃疡病的发生过程中,鱼体表皮黏膜细菌菌群的丰度、多样性及均一性水平均显著下降。研究结果为阐明半滑舌鳎溃疡病的发生机制提供了新思路。
关键词:半滑舌鳎;溃疡病;黏膜菌群
中图分类号:S941 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2023.S.013
Analysis of Mucus Bacterial Communities Associated to Skin Ulcer Disease of Chinese Tongue Soles(Cynoglossus semilaevis)
WANG Zhenhui1, FU Jiandong1, XUE Shuxia2
(1. Tianjin Haifa Zhenpin Industrial Development Company Limited, Tianjin 300450, China; 2. College of Life Sciences, Tianjin Normal University, Tianjin 300387, China)
Abstract: Skin ulcer disease is an epidemic disease affecting cultured Chinese tongue sole, and the mucus bacteria plays an important role in maintaining fish health. In order to analyze the relationship of skin mucus bacterial communities and the occurrence of skin ulcer disease, the skin mucus bacterial communities with three typical statuses including healthy (MH), early stage of the disease (having pustules on the skin) (PMD), and late stage of the diseases (having obvious ulcers on the skin) (MD) were analyzed by sequencing the V4 hypervariable region of the 16S rRNA gene using pyrosequencing technique. The result showed that 4 036, 1 758 and 1 763 operational taxomonic units (OTUs) were identified in MH, PMD and MD samples, respectively. The genus taxonomic analysis showed that Pseudoalteromonas, unidentified_Chloroplast, Blautia and Bifidobacterium were more abundant in MH sample whereas in PMD and MD samples were Pseudomonas and Vibrio. In addition, tags annotation showed that the bacterial community in the MH sample was much more diverse than that in PMD and MD samples. The bacterial isolation results showed that more potential pathogenic bacteria were also found in PMD and MD samples. In conclusion, the abundance, diversity and evenness levels of the mucus bacterial communities of the fish are significantly decreased during the development of ulcer disease in cultured Chinese tongue soles. The results of the study provides new ideas to elucidate the mechanism of ulcer disease in Chinese tongue soles.
Key words: cynoglossus semilaevis; skin ulcer disease; mucus bacterial communities
半滑舌鳎(Cynoglossus semilaevis)主要分布于我国黄渤海近海海域,是我国重要的海水养殖鱼类[1]。高密度集约化的养殖模式导致半滑舌鳎病害频发,养殖成活率降低,经济损失严重,制约了半滑舌鳎养殖业的健康可持续发展[2]。根据已有的研究结果[3-5],结合笔者对天津地区养殖半滑舌鳎疾病调查情况,溃疡病被认为是目前危害半滑舌鳎养殖重要的细菌性疾病。溃疡病发病初期,表皮会形成一些小的脓包,然后脓包会进一步发展成较大面积的溃疡灶,造成鱼体死亡。
鱼类针对病原体拥有较多的防御机制,其中体表黏膜组织为重要的第一道物理防御屏障[6-7]。研究表明,鱼类黏膜组织中定植着大量的细菌,一个平衡稳定的细菌群落对维持鱼体健康起了重要的作用[8-9]。然而,鱼类黏膜菌群结构可能会被多种因素干扰而失去平衡,包括网捕、使用抗生素[10]、盐度[11]、遗传[12]等。目前针对半滑舌鳎黏膜组织中细菌群落结构的研究较少,对于半滑舌鳎黏膜组织中细菌群落结构与溃疡病发生之间的关系还不明晰。
本研究利用高通量测序技术分析了健康的、患病初期和患病期的半滑舌鳎体表黏膜菌群结构,阐明了半滑舌鳎黏膜组织中细菌组成与溃疡病发生之間的关系。
1 材料与方法
1.1 试验材料
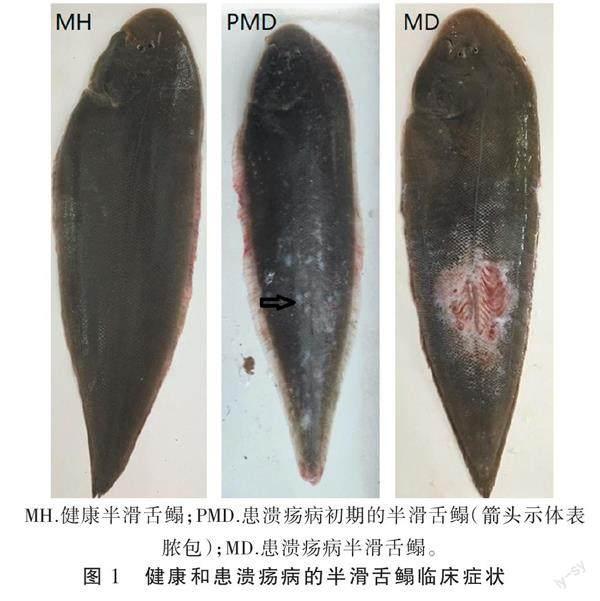
半滑舌鳎取自天津市海发珍品实业发展有限公司,从养殖池中随机取5尾没有明显疾病症状的半滑舌鳎,平均体质量(243±13) g,设为MH组;5尾体表有脓包的鱼体,平均体质量(225±17) g,设为PMD组;5尾体表有明显溃疡灶的鱼体,平均体质量(236±24) g,设为MD组(图1)。将每组鱼放到解剖盘中,用无菌水冲洗其体表。用灭菌的手术刀从鱼体有鳞一侧刮取粘液,放入离心管,-80 ℃保存。使用DNA提取试剂盒(Omega Bio-Tek,美国)进行DNA提取。将DNA稀释到1 ng·μL-1。
1.2 16S rDNA文库的构建及高通量测序
文库构建参考Xue等[13]的方法进行。PCR扩增16S rDNA的高变异区,引物为515F-806R[14],扩增反应体系为Phusion高保真PCR Master Mix(New England Biolabs)。利用TruSeq DNA PCR-free Sample Preparation Kit(Illumina,美国)建立测序文库。构建好的文库利用Qubit@ 2.0 Fluorometer (Thermo Scientific)和 Agilent Bioanalyzer 2100进行质量评估,评估合格的文库在IlluminaHiSeq 2500平台进行测序。测序由诺禾致源生物科技有限公司完成。
1.3 数据分析
利用FLASH[15]等软件对测序数据进行去冗余。使用UCHIME算法[16]将获得的序列与参考数据库进行比对,去除嵌合体序列,最终获得有效序列。利用Uparse[17]对获得的有效序列进行聚类分析(97%一致性),生成OTUs。使用MUSCLE软件进行多序列比对分析。分别在界、门、纲、目、科和属等分类层次上进行注释。通过Qiime软件[18]计算Observed species、 Chao1、Shannon、Simpson、ACE和Goods coverage指数数值,分析样本中细菌的多样性和复杂性。
1.4 半滑舌鳎细菌的分离鉴定
针对MH、PMD和MD组的鱼体,用2216E平板(天和微生物试剂公司,中国杭州)分别从鱼体体表的脓包(PMD)、溃疡灶(MD),以及肝脏和肾脏中分离细菌。在28 ℃培养24 h后,将优势单个菌落接种到新的平板上,进行16S rDNA扩增[13]。PCR产物进行纯化、测序,通过BLAST与GenBank数据库进行比对分析。
2 结果与分析
2.1 OTUs分析
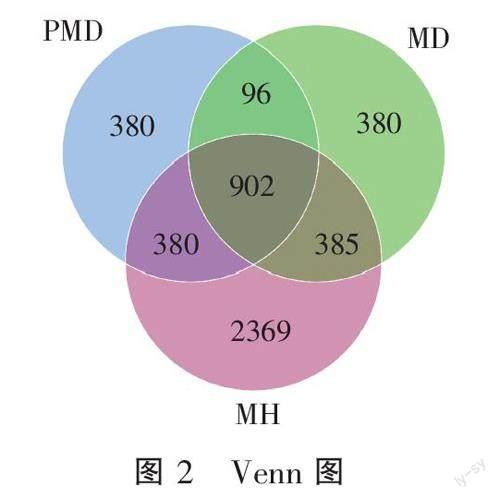
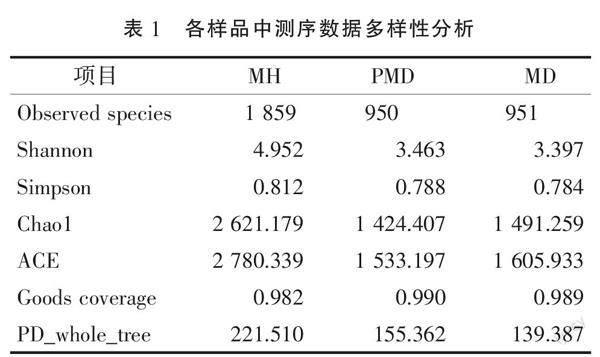
在样品MH、PMD和MD中分别鉴定到了4 036、1 758、1 763个OTUs。Venn分析显示,3个样品中共有902个OTUs,而MH样品中有2 369个特有的OTUs(图2)。这表明健康半滑舌鳎鱼体体表的细菌多样性和丰富度显著高于患病鱼体。从Shannon、Simpson、Chao 1、ACE、Goods coverage、observed species和PD_whole_tree数据分析中也可以看出,健康鱼体体表菌群的多样性水平更高(表1)。
2.2 OTUs注释分析
所有的OTUs按界、门、纲、目、科和属的分类层次进行注释。在纲分类层面上,MD和PMD样品中,Gammaproteobacteria分别占细菌总数的92.9%、92.0%;而在MH样本中,Gammaproteobacteria占比72.6%,其次是Clostridia(3.6%)、Alphaproteobacteria (5.3%)、Chloroplast(1.5%)、unidentified_Actinobacteria
(1.7%)、Bacilli(1.8%)和Betaproteobacteria(1.4%)(图3-A)。在目分类层面上,MH、PMD和MD样本中,丰度差异最大的是Alteromonadales(MH为42.0%、PMD为 34.7%、MD为 20.9%), 其次为Pseudomonadales (MH为11.5%、PMD为32.5%、MD为41.4%),Vibrionales(MH为10.1%、PMD为16.4%、MD为17.3%),Clostridiales(MH为3.5%、PMD为0.73%、MD为0.76%),unidentified_Chloroplast
(MH为1.5%、PMD为0.027%、MD为 0.034%),Rhodobacterales (MH为2.2%、PMD为0.59%、MD为0.54%),Lactobacillales(MH为1.3%、PMD为0.13%、MD为0.17%)(图3-B)。在科分类水平上,Pseudomonadaceae和Lachnospiraceae的丰度在3个组中呈现出明显的差异。Pseudomonadaceae在MH样本中的占比为9.9%,而在PMD和MD样本中的占比分别为29.3%、38.4%。相反,Lachnospiraceae在MH样本中的占比为2.3%,明显高于PMD和MD组(分别为0.29%、0.33%)(图3-C)。在属分类水平,3个样本中的细菌丰度也存在较大的差异,包括Pseudomonas (MH为9.9%、PMD为29.3%、MD为38.4%), Vibrio (MH为9.9%、PMD为16.4%、MD为17.2%), unidentified_Chloroplast(MH为1.5%、PMD为0.03%、MD为0.03%), Blautia(MH为1.1%、PMD为0.06%、MD为0.06%)(图3-D)。
2.3 黏膜菌群多样性和均一性分析
为了进一步分析健康和患溃疡病半滑舌鳎体表菌群的差异,使用稀释曲线和等级丰度曲线来阐释样本中OTUs的分布特征[14,19],稀释曲線是通过计算代表OTUs的随机选择的测序序列数量而绘制(图4)。稀释曲线体现了测序数据的合理性,并间接反映了细菌群落的丰度和多样性水平。MH样品中的20 797条序列代表了超过1 368个观察到的物种,而在PMD和MD样品中,这些序列分别代表了667、662个物种。这表明MH样品中细菌的多样性程度更高。根据每个OUT的丰度对其进行排序,以OTUs的丰度为Y轴,排序的次序为X轴,绘制等级丰度曲线(图5)。曲线越平坦,表明样品中细菌种类的分布越均一。从图5可以看出,与PMD和MD样品相比,MH样品的等级丰度曲线显示出更均衡的细菌物种分布。
2.4 患溃疡病鱼体细菌分离鉴定
从患溃疡病的半滑舌鳎体内共分离获得83株细菌(表2),经初步鉴定,这些细菌大部分为弧菌,其中哈维氏弧菌(Vibrio harveyi)17株,轮虫弧菌(V. rotiferianus)16株,创伤弧菌14株(V. vulnificus)。从健康的半滑舌鳎体内未分离到潜在致病菌。
3 讨论与结论
半滑舌鳎是我国北方地区重要的海水养殖鱼类,皮肤溃疡病的发生给半滑舌鳎养殖业造成了较大的损失。已有研究表明,从患溃疡病的半滑舌鳎体内分离获得了多种细菌性病原[3-5]。本研究也从患病鱼体中分离获得了包括哈维氏弧菌、溶藻弧菌和轮虫弧菌在内的多种病原菌,提示该病是由多种病原感染引起的综合性疾病。本研究所采集的样本包括健康的和自然发病的鱼体(包括发病早期和晚期),可以客观地反映溃疡病的发生对鱼体体表黏膜菌群的影响。
与陆生动物相比,鱼类体表黏膜与水环境直接接触,体表黏膜中存在一个复杂的动态生态系统[20],这个生态系统的稳定对维持鱼体健康发挥了重要的作用。在之前的研究中已经阐明了养殖鱼类溃疡病的发生与养殖水体中细菌菌群之间存在潜在的相关性[13]。因此,笔者推测养殖半滑舌鳎溃疡病发生与鱼类体表黏膜中细菌菌群结构的转变相关。本研究结果显示,半滑舌鳎体表黏膜中细菌菌群的多样性与溃疡病表现出一定的关联性。与患溃疡病的半滑舌鳎相比,健康鱼体的表皮黏膜菌群丰度更高,更具多样化和均一性。这表明健康鱼体表皮黏膜中丰富、多样、均衡的细菌菌群可能会抑制条件致病菌的繁殖。相反,表皮黏膜中失衡的细菌菌群会使致病菌“有机可乘”,导致溃疡病的发生。本研究中,常见的鱼类致病菌,如假单胞菌和弧菌,在患溃疡病的鱼体体表黏膜中丰度显著增加,增加了半滑舌鳎患病的风险。
Gammaproteobacteria是鱼类表皮黏膜和肠道中的优势菌群[21-22]。本研究结果表明,在MH、PMD和MD 3个样本中,Gammaproteobacteria也具有较高的丰度,但是其丰度在3个样本中呈现出显著的差异(MH中72.6%、PMD中92.0%、MD中92.9%)。Gammaproteobacteria包含一些鱼类条件致病菌,如弧菌和假单胞菌。弧菌是海水中的常见细菌,是众所周知的水产养殖动物的致病菌,弧菌的感染和流行会给水产养殖造成灾难性的损失[23]。假单胞菌也是海水养殖鱼类的重要致病病原[24]。本研究结果表明,与健康鱼体相比,患溃疡病半滑舌鳎体表黏膜中弧菌和假单胞菌的丰度显著升高。另外,健康鱼体体表黏膜中Lachnospiraceae丰度要显著高于患病鱼体。Pince等[25]报道,Lachnospiraceae可以通过竞争性排斥保护鱼类体表角质细胞免受病原体的侵染。患溃疡病半滑舌鳎体表黏膜中Lachnospiraceae丰度的降低,减弱了其对半滑舌鳎体表的角质细胞的保护作用,间接增加了病原菌的侵染机会。
微生物生态系统的功能和稳定性受到其丰度和均一度的影响[26-27]。本研究中,健康和患溃疡病半滑舌鳎表皮黏膜中的细菌群落结构存在着明显的差异。健康样本中细菌的OTUs数量、shannon指数、Chao1、ACE数值都显著高于患病样本。另外,稀释度和等级丰度分析表明,健康鱼体体表黏膜中细菌菌群比患溃疡病鱼体更具多样性和均一性。Hillebrand等[28]指出,一个多样、均衡的细菌菌群可以为宿主提供更好的保护。由此,笔者可以推测,半滑舌鳎表皮黏膜中细菌菌群结构的显著变化可能是半滑舌鳎溃疡病发生的一个关键因素。表皮黏膜中细菌菌群的结构变化可以作为监测半滑舌鳎溃疡病发生的指标。
参考文献:
[1] 葛仑华, 江博赟, 孙敬锋, 等. 三种DNA提取方法对半滑舌鳎肠道菌群高通量测序结果的影响[J]. 天津农学院学报, 2022, 29(3): 29-35.
[2] 陳君. 工厂化循环水养殖半滑舌鳎主要细菌性疾病及其控制[D]. 上海: 上海海洋大学, 2012.
[3] 周红霞, 姚俊杰, 房文红, 等. 半滑舌鳎溃疡病原杀鲑气单胞菌的分离鉴定与药敏试验[J]. 海洋渔业, 2017, 39(3): 322-330.
[4] 邵蓬, 武尊, 雍朋政, 等. 半滑舌鳎源美人鱼发光杆菌的分离鉴定及致病性研究[J]. 中国海洋大学学报(自然科学版), 2020, 50(6): 42-49.
[5] 李文悦, 左志晗, 张晶晶, 等. 半滑舌鳎溃疡病病原菌的分离、鉴定及其致病性分析[J]. 水产学报, 2020, 44(4): 672-680.
[6] ?NGELES ESTEBAN M. An overview of the immunological defenses in fish skin[J]. ISRN Immunology, 2012, 2012: 853470.
[7] SANAHUJA I, IBARZ A. Skin mucus proteome of gilthead sea bream: A non-invasive method to screen for welfare indicators[J]. Fish & Shellfish Immunology, 2015, 46(2): 426-435.
[8] MINNITI G, HAGEN L H, PORCELLATO D, et al. The skin-mucus microbial community of farmed Atlantic salmon (Salmo salar)[J]. Frontiers in Microbiology, 2017, 8: 2043.
[9] GMEZ GD, BALC?ZAR J L. A review on the interactions between gut microbiota and innate immunity of fish[J]. FEMS Immunology and Medical Microbiology, 2008, 52(2): 145-154.
[10] CARLSON J M, HYDE E R, PETROSINO J F, et al. The host effects of Gambusia affinis with an antibiotic-disrupted microbiome[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2015, 178: 163-168.
[11] LOKESH J, KIRON V. Transition from freshwater to seawater reshapes the skin-associated microbiota of Atlantic salmon[J]. Scientific Reports, 2016, 6: 19707.
[12] SYLVAIN F ?, DEROME N. Vertically and horizontally transmitted microbial symbionts shape the gut microbiota ontogenesis of a skin-mucus feeding discus fish progeny[J]. Scientific Reports, 2017, 7(1): 5263.
[13] XUE S X, XU W, WEI J L, et al. Impact of environmental bacterial communities on fish health in marine recirculating aquaculture systems[J]. Veterinary Microbiology, 2017, 203: 34-39.
[14] CAPORASO J G, LAUBER C L, WALTERS W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl 1): 4516-4522.
[15] MAGO? T, SALZBERG SL. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963.
[16] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200.
[17] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.
[18] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
[19] ONDOV B D, BERGMAN N H, PHILLIPPY A M. Interactive metagenomic visualization in a Web browser[J]. BMC Bioinformatics, 2011, 12: 385.
[20] NOGA E J. Skin ulcers in fish: Pfiesteria and other etiologies[J]. Toxicologic Pathology, 2000, 28(6): 807-823.
[21] TAPIA-PANIAGUA S T, CEBALLOS-FRANCISCO D, BALEBONA M C, et al. Mucus glycosylation, immunity and bacterial microbiota associated to the skin of experimentally ulcered gilthead seabream (Sparus aurata)[J]. Fish & Shellfish Immunology, 2018, 75: 381-390.
[22] TAPIA-PANIAGUA S, LOBO C, MORENO-VENTAS X, et al. Probiotic supplementation influences the diversity of the intestinal microbiota during early stages of farmed senegalese sole (Solea senegalensis, Kaup 1858)[J]. Marine Biotechnology, 2014, 16(6): 716-728.
[23] LETCHUMANAN V, CHAN K G, PUSPARAJAH P, et al. Insights into bacteriophage application in controlling vibrio species[J]. Frontiers in Microbiology, 2016, 7: 1114.
[24] LPEZ J R, LORENZO L, MARCELINO-POZUELO C, et al. Pseudomonas baetica: pathogenicity for marine fish and development of protocols for rapid diagnosis[J]. FEMS Microbiology Letters, 2017, 364(3): 286.
[25] PIN?E E, VELU S K, CALLEGARI A, et al. Disorder-mediated crowd control in an active matter system[J]. Nature Communications, 2016, 7: 10907.
[26] BELL T, NEWMAN J A, SILVERMAN B W, et al. The contribution of species richness and composition to bacterial services[J]. Nature, 2005, 436(7054): 1157-1160.
[27] WITTEBOLLE L, MARZORATI M, CLEMENT L, et al. Initial community evenness favours functionality under selective stress[J]. Nature, 2009, 458(7238): 623-626.
[28] HILLEBRAND H, BENNETT D M, CADOTTE M W. Consequences of dominance: a review of evenness effects on local and regional ecosystem processes[J]. Ecology, 2008, 89(6): 1510-1520.
收稿日期:2023-04-22
基金項目:天津市海水养殖现代农业产业技术体系创新团队(ITTMRS2022006)
作者简介:王祯辉(1980—),男,河北唐山人,兽牧师,主要从事海水珍品鱼类养殖研究。

