解脂耶氏酵母底盘细胞的工程改造及应用
孙美莉,王凯峰,陆然,纪晓俊
(南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816)
当前,基于性能卓越的微生物底盘细胞,开发高效的绿色生物制造技术,已经成为合成生物学领域的研究热点[1‑2]。作为一种非常规酵母,解脂耶氏酵母(Yarrowia lipolytica)是一种重要的产油微生物,自1942年首次发现至今,在学术研究和工业生产中得到了众多的关注,是目前研究和应用最为广泛的微生物底盘细胞之一[3‑4]。其先后被命名为Candida lipolytica、Endomycopsis lipolytica、Saccharomycopsis lipolytica,最终定名为Yarrowia lipolytica[5]。解脂耶氏酵母一般分布于富含脂质和蛋白质的环境中,目前已被美国食品药品监督管理局(Food and Drug Administration,FDA)认证为一般认可安全的微生物(generally recognized as safe,GRAS)[6‑7]。解脂耶氏酵母因具有独特的生理生化特征,展现出了良好的学术研究与工业应用价值。第一,解脂耶氏酵母是典型的二型性酵母,因此其成为研究菌体二型性的模式生物;第二,它是一种严格的好氧菌,通过呼吸作用促进细胞生长,是一种典型的Crabtree 阴性酵母,具有许多优异的工业应用潜能[5];第三,其胞内具有独特的柠檬酸穿梭途径而能够高效地合成乙酰辅酶A 这一多种化合物生物合成的前体,因此非常适合于脂质、萜烯类等化合物的合成[8‑12];第四,其胞内具有较高的三羧酸循环(tricarboxylic acid cycle,TCA)通量,因此适用于系列有机酸化合物的生物合成[3];第五,其可以分解油脂及烷烃类化合物,在油脂及石油污染的环境修复方面具有重要作用[13]。此外,解脂耶氏酵母可以在较低pH 和较高的渗透压条件下生长,且可利用多种碳源为底物,如糖类、烃类、醇类、脂类、蛋白质等[14]。正因为解脂耶氏酵母具有高效的多底物利用能力,且对多种极端环境具有耐受性,十分契合于生物制造所需的工业应用属性条件,其日渐成为面向绿色生物制造的合成生物学领域研究的热门底盘细胞(图1)[15]。
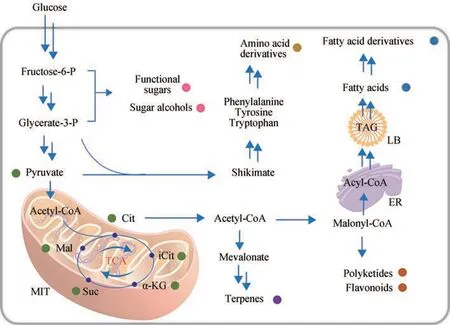
图1 解脂耶氏酵母底盘细胞合成各种化合物的简化示意图(不同颜色的圆点代表不同类别的产品)Cit-柠檬酸;iCit-异柠檬酸;α‑KG-α‑酮戊二酸;Suc-琥珀酸;Mal-苹果酸;TAG-甘油三酯;MIT-线粒体;ER-内质网;LB-脂质体Fig. 1 Schematic representation for various compounds synthesis in Yarrowia lipolytica chassis cell(The same type of products are labeled with dots using the same color)Cit-citrate; ICit-isocitrate; α‑KG-α‑ketoglutaric acid; Suc-succinate; Mal-malic acid;TAG-triacylglyceride; MIT-mitochondria; ER-endoplasmic reticulum; LB-lipid body
随着合成生物学的快速发展,研究者们对解脂耶氏酵母底盘细胞的探索和认识也在不断深入,尤其是对其生理生化代谢的研究不断加深,对该酵母的遗传改造技术和方法不断创新,这促进了对解脂耶氏酵母底盘细胞的改造和升级,进一步拓宽了其应用领域。本文总结了近年来针对解脂耶氏酵母底盘细胞的工程改造及应用,并讨论了解脂耶氏酵母在实际应用中的优势,以及面临的限制和待解决方案。同时,也介绍了各类合成生物学技术在解脂耶氏酵母中的最新进展,包括基因编辑、基因的表达调控、基因组规模代谢模拟等。最后,对解脂耶氏酵母底盘细胞的应用前景和未来发展方向进行了展望。
1 遗传改造技术及工具开发
高效的遗传改造技术及成熟的遗传操作工具将极大地方便细胞工厂的开发。近年来,随着合成生物学技术的快速发展,已积累了很多解脂耶氏酵母可用的基因表达控制元件,包括启动子、终止子和筛选标记。而将各种合成生物学元件及目标基因或途径引入底盘菌株是对其进行合成生物学改造的必要步骤,这依赖于适合底盘菌株的基因表达及整合方法。近年来兴起的CRISPR/Cas介导的基因编辑技术已在解脂耶氏酵母中初步成功应用,有力推进了解脂耶氏酵母底盘细胞的开发和应用。
1.1 基因表达的控制元件
对解脂耶氏酵母底盘细胞的工程改造往往需要构建一个或多个基因表达盒,这些表达盒由启动子、开放阅读框和终止子组成。开放阅读框通常包含目的基因,有时还包含一些人为添加的靶向序列,如细胞器定位信号等。代谢通路的创建往往需要多个表达盒进行多轮迭代转化,因此对于表达盒构建来说,筛选标记也是很关键的基因元件。
1.1.1 启动子
启动子是控制基因表达水平的关键元件,通过合成生物学在解脂耶氏酵母底盘细胞内构建代谢通路,需要选择适用于解脂耶氏酵母的功能性启动子。目前,解脂耶氏酵母中已经分离和/或表征了多个启动子,包括组成型和诱导型启动子。1987 年,科学家首先从解脂耶氏酵母中分离出蛋白胨诱导型启动子pXPR2[16],这也是目前表征比较多的内源启动子。然而,其调控的复杂性和诱导剂的相对昂贵阻碍了pXPR2 的工业应用。随后,科学家分离和表征了驱动翻译延伸因子‑1α 基因的强组成型启动子pTEF,其目前仍是解脂耶氏酵母合成生物学研究中比较偏好使用的启动子之一[17]。
由于解脂耶氏酵母具有积累高水平脂质的能力,科学家们围绕脂质合成代谢途径鉴定出了许多内源性启动子,如可诱导的pPOX2[18]、pG3P、pICL4、pPOT4、pPOX4、pPOX2 和pPOX5[19]。Wong 等[20]表征了12 个内源启动子,包括pTEF和其他11 个与脂肪代谢相关的启动子,并比较了启动子强度:pTEF>pGAP>pACL2>pICL>pIDH2>pFAS1>pDGA1>pFAS2>pZWF1>pPOX4>pACC>pIDP2。随后,利用这些启动子设计了一组模块化克隆载体YaliBricks,以允许在解脂耶氏酵母中快速组装具有特定遗传元件(启动子、内含子序列和终止子)的多基因代谢途径,丰富了解脂耶氏酵母合成生物学工具包。最近,来自美国的一个研究小组从解脂耶氏酵母中鉴定了4个内源启动子,其在该酵母的生长阶段转移到脂质积累阶段时可下调基因表达[21]。这些启动子可进一步用于调控对细胞生长必要而对脂肪酸合成不利的基因的表达,在不改变发酵条件或向培养基中额外添加成分的条件下可实现脂质合成途径的动态调控,是解脂耶氏酵母合成生物学工具箱的重要补充。此外,近些年,科学家们还表征了解脂耶氏酵母中一些其他功能性启动子,包括:赤藓糖醇和赤藓酮糖诱导启动子pEYK1[18],Cu2+诱导型启动子pMT‑1‑pMT‑6 和Cu2+抑制型启动子pCTR1、pCTR2[22],组成型启动子pFBAin[23],和氨离子响应启动子pYAT1[24]。
启动子的表达模式及强度只能通过报告基因来检测,最初通过易于检测和观察的酶活来比较启动子强度,如β‑半乳糖苷酶(β‑galactosidase,LacZ)等,但是酶活检测需要进行酶促反应,不适合高通量筛选。通过检测绿色荧光蛋白(green fluorescent protein,GFP)的表达水平量化启动子强度也是常用的方法,该方法的优点是可以直接检测GFP,而无需进行酶促反应。但是由于酵母细胞的自发荧光会对该方法产生一定的干扰,因此不是最可靠的表征方法[20]。最近,有报道将基于生物发光荧光素酶的报告基因引入解脂耶氏酵母中,以表征内源性启动子。此方法灵敏可靠,但是需要制备无细胞提取物,并补充荧光素和ATP作为底物。各种启动子表征方法见表1。

表1 启动子强度比较及表征方法Table 1 Comparison of strength and characterization of promoters
1.1.2 终止子
和启动子一样,终止子也是重要的基因表达控制元件之一。终止子会影响mRNA 稳定性和半衰期,对于转录完成过程至关重要[27]。通常认为终止子序列是表达盒中必要但相当中性的元件,除了由于在多个表达盒中重复使用而存在发生同源重组的潜在风险之外,终止子并没有引起研究者的太多关注。XPR2和LIP2基因的终止子序列是解脂耶氏酵母中表达盒构建过程最常用的内源终止子[5]。来自酿酒酵母(Saccharomyces cerevisiae)的终止子也已成功用于解脂耶氏酵母,这表明终止子具有跨物种的高度可转移性[28]。有趣的是,一些为酿酒酵母设计的短的合成终止子在解脂耶氏酵母中亦可功能性表达,且发现合成的终止子序列驱动绿色荧光蛋白的表达比使用野生型CYC1终止子获得的结果高60%[29]。此外,与天然终止子序列相比,这些合成终止子具有较小的长度(35~70 bp),这极大地方便了载体的设计和表达盒的构建,且降低了多个表达盒之间发生同源重组的风险。尽管终止子序列在解脂耶氏酵母基因的表达调控中很重要,然而其作用一直被低估,对其研究的广度和深度远不如启动子。未来,研究终止子在解脂耶氏酵母基因表达调控中的作用将是一个有前景的领域,特别是设计并合成短的终止子序列,有望简化基因表达盒的构建难度并有助于提高工程菌株的遗传稳定性。
1.1.3 筛选标记
筛选标记的选择对于菌株改造和筛选也非常重要。在解脂耶氏酵母中,营养缺陷型和抗生素抗性标记均被采用过,而营养缺陷型标记是其最佳选择,其中最常用的是Leu2 和Ura3 缺陷筛选标记[30]。营养缺陷型筛选标记中比较特殊的一个是Ura3d4,它是Ura3 缺陷筛选标记的启动子截短版本,当目标基因存在单个拷贝时无法纠正营养缺陷,只有存在多个拷贝时才能纠正,因此可以用于实现目标基因的多拷贝表达[31]。尽管Leu2 作为筛选标记也被广泛使用,但最近的研究揭示亮氨酸代谢对解脂耶氏酵母脂质合成可能产生影响,引起了人们的担忧[32‑33]。
自20 世纪90 年代以来,Ura3 缺陷筛选标记由于可使用有毒的尿嘧啶前体类似物5‑氟乳清酸(5‑FOA)将筛选标记释放来恢复营养缺陷,以允许其在多轮转化中重复使用,而成为解脂耶氏酵母底盘细胞工程改造的最佳选择[34]。尽管如此,这种被命名为Ura3‑blaster 的方法,对于复杂代谢途径的体内组装和底盘细胞改造仍有较大的限制。基于此,来自噬菌体P1 的Cre‑loxP 重组系统被成功用于在解脂耶氏酵母中进行基因敲除和筛选标记释放,即在载体构建时,在筛选标记两侧添加loxP 位点,随后可通过Cre酶介导的loxP 位点特异性重组实现筛选标记的删除回收[35]。最近,为了简化操作,科学家们开发出了一些新型的解脂耶氏酵母合成生物学工具,其中包含了不同的loxP切除标记,包括EasyClone YALI 工具箱[36]和Golden Gate 工具箱[37]。尽管如此,筛选标记的重复利用依然存在周期长、操作烦琐等问题,因此,有必要进一步优化并探索更为高效的筛选方法,而近年来不断发展的CRISPR/Cas9 基因编辑技术有望为此提供新的手段。
1.2 基因表达及整合方法
1.2.1 基于游离质粒的基因表达
目前为止,解脂耶氏酵母中仍未识别到天然的游离质粒,研究者利用自主复制序列/着丝粒(autonomously replicating sequence/centromeric,ARS/CEN)设计了可以在解脂耶氏酵母中进行自主复制的游离质粒用于基因表达[38]。这种游离质粒类似于微型染色体,其拷贝数较低(1~3 个/细胞),而且在有丝分裂时很容易丢失,遗传稳定性差[39‑40],因此并未得到广泛应用。最近,游离载体被选择用于开发解脂耶氏酵母底盘细胞改造的遗传工具箱,例如YaliBricks系统[20]。通过对解脂耶氏酵母着丝粒区域进行一些改造(如与上游启动子融合),提高了游离质粒的拷贝数和表达水平[41],这为使用游离载体进行基因表达调控提供了新的技术手段。此外,研究者也证实构建适用于解脂耶氏酵母的游离质粒时,ARS 序列中复制起始位点和CEN 之间的间隔序列对于维持质粒稳定性有重要作用。以荧光蛋白和β‑胡萝卜素合成途径进行测试,发现含有间隔序列的质粒转录水平比不含间隔序列的要高1.4~2.2倍,质粒稳定性也有1.7倍的提高[42]。最近,来自山东大学的研究者通过不断截短47 916 bp 的线粒体DNA,鉴别出516 bp 的线粒体DNA 序列作为人工复制起点,也可以实现游离质粒在解脂耶氏酵母中的自主复制[43]。以该516 bp 的线粒体人工复制起点代替ARS/CEN 构建的质粒,在有选择压力和无选择压力时,质粒丢失率分别为10%和20%,比同等条件下ARS/CEN 质粒的45%和近100%的丢失率有更稳定的表现。
为了实现多基因在解脂耶氏酵母底盘细胞的稳健表达,法国研究者还设计和构建了人工染色体(ylAC),使目标基因和染色体组装变得简单和高效。ylAC 由两个端粒和一个包含着丝粒(CEN3‑1)的ARS 组成,确保了细胞分裂过程中的自主复制,且可以在有或没有选择性压力的情况下进行多代稳定遗传。研究者以完整的纤维素二糖和木糖共利用途径为例,以编码5‑氨基乙酰丙酸合成酶的必需基因HEM1作为筛选标记,发现ylAC 能够在多代遗传中保持稳定[44]。该结果是对现有解脂耶氏酵母合成生物学工具箱的有力补充。
1.2.2 基于同源重组的基因组整合
目前,基于整合型载体的整合仍然是解脂耶氏酵母中基因表达的首选[45‑46]。首先,相比较于游离质粒,整合型载体非常稳定,不易丢失。其次,它们可用于进行迭代整合,组合调控相关基因的表达[47]。通过同源重组可以将完整的线性化载体整合到解脂耶氏酵母基因组的特定位置。由于解脂耶氏酵母中非同源末端连接(non‑homologous end joining,NHEJ)修复双链断裂(double strand breaks, DSB)占据主导地位,因此为了增加同源重组效率,需要抑制基于NHEJ 的DSB 修复方式。解脂耶氏酵母中比较常用的方式是将NHEJ修复机制相关的蛋白编码基因KU70进行敲除,结合增加同源区域的长度(每侧0.5~1 kb),以提高同源修复的频率[30,35,48]。最近,本课题组将酿酒酵母中负责同源重组的关键基因元件RAD52导入解脂耶氏酵母中,将缺失可导致褐色菌落表型的基因ADE2作为报告基因,以评估同源重组效率。结果表明,同源臂长为1000 bp 时同源重组效率高达95%,是野生型菌株的6.5 倍,敲除KU70菌株的1.6 倍[49]。目前,解脂耶氏酵母中用于基因表达的质粒主要是以整合质粒为主,中国台湾Yeastern 公司针对解脂耶氏酵母中蛋白的表达,开发了两种商用的整合型载体:胞内表达载体pYLEX1和分泌表达载体pYLSC1[50]。
基因组整合也会发生在重复的基因组序列中,例如rDNA 区域和逆转录转座子Ylt1的长末端重复序列(或称为Zeta区域)[46]。在解脂耶氏酵母基因组中,存在大约200 个rDNA 序列,它们位于每条染色体上并已用于多基因整合。当Zeta 序列作为同源区域进行整合时,整合主要发生在含有Zeta菌株中的Zeta 基因座处,而在不含Zeta 菌株中插入则是随机的[51]。因此利用某些解脂耶氏酵母菌株中缺失Ylt1 的特点,开发了一种特殊位点的整合平台,该平台利用Zeta 序列,通过同源重组在URA3位点上进行靶向整合[52]。
1.2.3 基于非同源末端连接的基因组整合
由于解脂耶氏酵母中双链断裂时NHEJ 修复的主导地位,且NHEJ介导的基因组整合有利于片段在解脂耶氏酵母基因组中的随机插入,因此,目前已有多个研究展示了NHEJ介导的基因组整合在解脂耶氏酵母文库构建方面的潜力,特别是多元模块文库的构建[53‑55]。DNA 片段在不需要同源臂的情况下,可以随机整合到基因组的任何位点,从而获得突变库以筛选更好的表型。NHEJ 介导的基因随机整合已被用于在解脂耶氏酵母中生产α‑法尼烯,经过MVA 路径优化和α‑法尼烯合成路径的迭代整合以及培养条件的优化,α‑法尼烯的产量达到25.55 g/L[56]。
Li 等[57]开发了适用于解脂耶氏酵母的模块化克隆工具包--Golden Gate 模块化克隆系统(YALIcloneNHEJ),通过NHEJ 技术组装多基因路径。通过优化关键因素,包括连接酶的量和反应循环数,组装4 片段、7 片段和10 片段的效率分别达到90%、75%和50%。随后以(-)‑α‑红没药醇的生产为例,产量达到4.4 g/L。
综上,NHEJ 策略除了可以节省载体构建的时间,更重要的是,产生的突变库能提供无限的可能性以筛选高效的目标,在促进路径优化方面有极大的潜能。
1.3 CRISPR系统的开发
1.3.1 CRISPR系统介导的基因编辑
成簇的规律间隔的短回文重复序列(clustered regularly interspaced palindromic repeats,CRISPR)是原核生物基因组内的一段重复序列,细菌能够通过CRISPR 系统将病毒入侵的基因从基因组上切除,是细菌抵抗病毒等外源遗传物质入侵的一种获得性免疫系统[58]。针对各种生物体的CRISPR系统逐渐被开发出来用于DNA 的切除,这种基因编辑技术具有精准、高效、廉价、易于使用的特点[59]。基于CRISPR系统的基因组编辑技术能够在解脂耶氏酵母中实现高效且快速的无标记基因破坏或整合[图2(a)~(c)]。CRISPR/Cas9系统包括Cas9核酸内切酶以及由CRISPR RNA(crRNA)和反式激活crRNA(tracRNA)组成的向导RNA(sgRNA)[59‑60]。sgRNA 识别出包含特定原间隔序列邻近基序(PAM)的靶向序列NGG,引导Cas9蛋白靶向目标区域导致DNA 双键断裂。通常Cas9蛋白会融合核定位信号如SV40 等来提高入核效率。在解脂耶氏酵母中KU70基因编码蛋白在DNA双链断裂后的NHEJ修复过程中起重要作用,将其破坏可以显著提高同源重组(HR)的效率。在敲除KU70的解脂耶氏酵母中用自主复制质粒表达来自化脓性链球菌的CAS9基因和杂合RNA聚合酶Ⅲ启动子(SCR1'‑tRNA)驱动的sgRNA,能够有效地实现单基因敲除,其效率高达92%以上[61]。Holkenbrink等[62]将Cas9整合至解脂耶氏酵母基因组,同时利用自主复制的游离质粒表达sgRNA,使得单基因敲除的效率达到80%以上,双基因敲除的效率从6%到66%不等。此外,在sgRNA两端接连HH/HDV 核酶结构能够实现二型启动子控制sgRNA 的转录[63]。利用二型启动子表达Cas9 和sgRNA 并通过NHEJ修复机制破坏靶向区域,使得单基因、双基因和三基因敲除效率分别达到85.6%、36.7%和19.3%[63]。随后,一种由成对sgRNA指导的双CRISPR/Cas9 切割技术被成功用于6 个基因的编辑,单敲除效率在14.3% 至32.6% 之间[64]。CRISPR/Cpf1是另一种准确、有效的多重基因组编辑技术,不同于Cas9,Cpf1 能够识别TTTN 的PAM 序列,显著降低了解脂耶氏酵母高GC含量基因组上误读PAM 的机会,从而降低基因编辑时的脱靶率[65]。Yang等[66]在解脂耶氏酵母中采用基于CRISPR/Cpf1的双基因和三基因编辑效率分别达到了75%和42%。
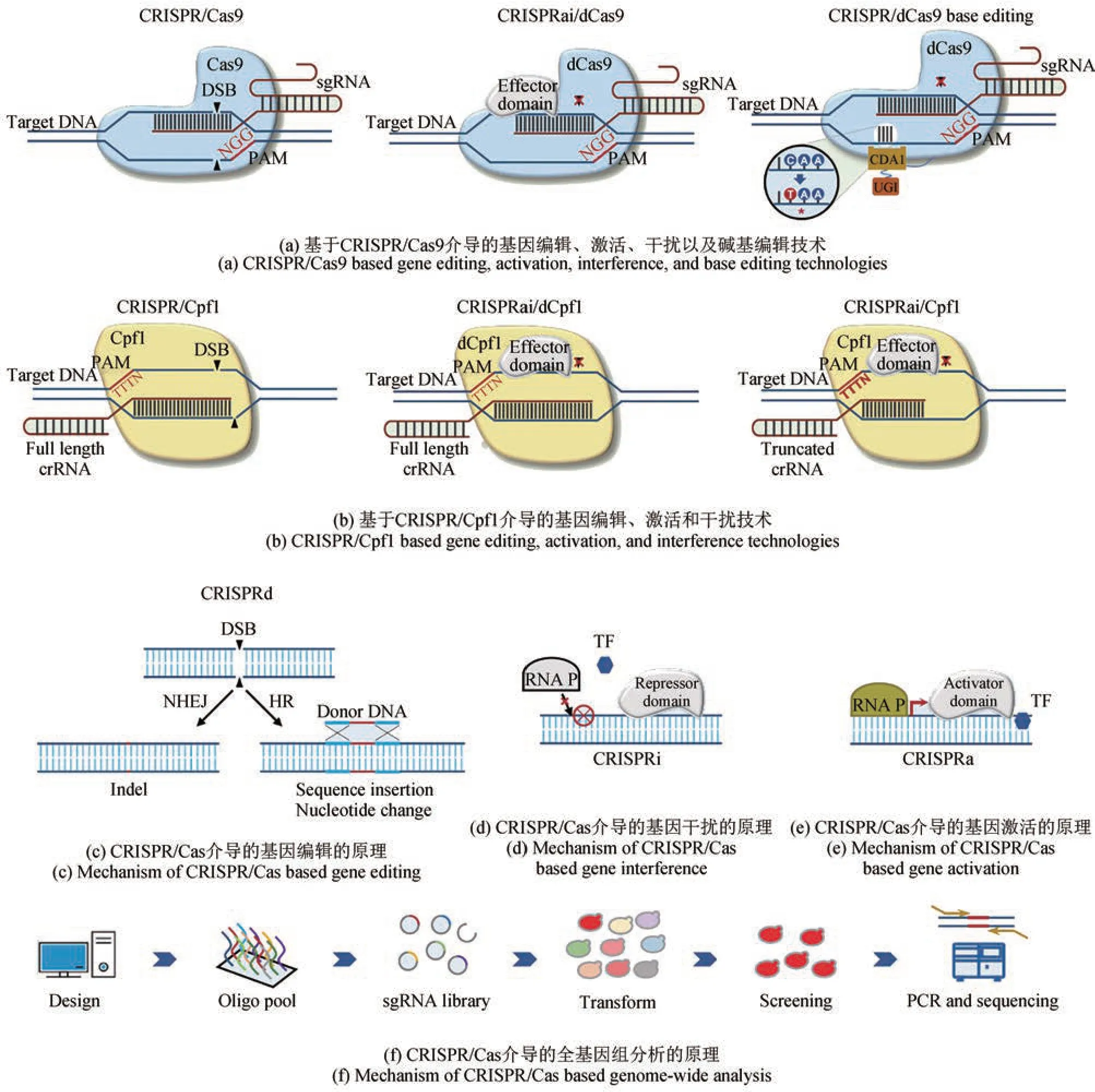
图2 CRISPR/Cas介导的基因编辑技术在解脂耶氏酵母中的应用CRISPRa-CRISPR/Cas介导的基因激活;CRISPRd-CRISPR/Cas介导的基因编辑;CRISPRi-CRISPR/Cas介导的基因干扰;crRNA-CRISPR RNA;DSB-DNA双链断裂;HR-同源重组;NHEJ-非同源末端连接;PAM-原间隔序列临近基序;RNA P-RNA聚合酶;sgRNA-向导RNA;TF-转录因子Fig. 2 CRISPR/Cas based genome‑editingtechnologies applied in Yarrowia lipolyticaCRISPRa-CRISPR/Cas based gene activation; CRISPRd-CRISPR/Cas based gene editing; CRISPRi-CRISPR/Cas based gene interference;crRNA-CRISPR RNA; DSB-DNA double strand breaks; HR-homologyrecombination; NHEJ-non‑homologous endjoining;PAM-protospacer adjacent motif; RNA P-RNA polymerase; sgRNA-single‑guide RNA; TF-transcription factor
1.3.2 CRISPR系统介导的基因抑制
建立CRISPR 系统的最初目的是利用核酸内切酶结合DNA 并切割靶向基因序列,随后的研究表明没有切割活性的核酸内切酶同样可以靶向目标DNA[67]。以失活的Cas9 蛋白(dCas9)或者Cpf1蛋白(dCpf1)构建CRISPR 干扰系统(CRISPRi)靶向不同的区域能够不同程度地抑制目标基因的转录[图2(a)、(b)、(d)]。当失活的核酸内切酶融合转录阻遏物后可实现更高的抑制效率。解脂耶氏酵母中第一个CRISPRi 系统被应用于抑制NHEJ相关的9个基因,其中8个基因被有效抑制[68]。随后采用多重sgRNA 策略以及dCas9 融合Mxi1 抑制因子来抑制KU70和KU80基因,使得HR效率提高接近90%。Zhang 等[69]比较了dCpf1、dCas9 以及融合转录阻遏物的dCas9‑KRAB 和dCpf1‑KRAB 的抑制效率,发现目标位点与抑制效率之间没有明确的关系。当使用多重位点同时抑制时,dCpf1 和dCas9 的抑制效率分别达到85%和92%。这表明调节抑制位点的位置与同时抑制基因的个数可灵活调节抑制程度从而微调基因的表达。
1.3.3 CRISPR系统介导的基因激活
除了CRISPR 介导的基因干扰系统外,dCas9蛋白还可与转录激活剂融合以激活靶基因,称作CRISPR 激活(CRISPRa) 系统[图2(a)、(b)、(e)]。最近,有研究采用融合表达dCas9 和外源的转录激活因子VPR 构建了CRISPRa 系统,成功激活了解脂耶氏酵母内源的β‑葡萄糖苷酶编码基因BGL1和BGL2,研究发现靠近核心启动子区域的sgRNA 可以显著提高激活程度,最终选取最优的靶向位点使得BGL1与BGL2的表达水平分别提高了112 倍和43 倍,通过这一操作,解脂耶氏酵母能够消耗原先不能代谢利用的纤维二糖[70]。研究还发现CRISPR/Cpf1 系统的sgRNA 可通过调节序列长度来控制Cpf1 蛋白的切割活性,而长度为16 nt 的直接重复序列(DR)会抑制Cpf1 的切割活性,但不阻止其与靶DNA 结合。基于此,Ramesh 等[71]建立了双用途CRISPR/Cpf1 系统,可以同时实现基因敲除和基因的抑制或激活。
1.3.4 CRISPR系统介导的碱基编辑
除了CRISPR 介导的基因干扰和激活系统外,将CRISPR/Cas9 系统与活化诱导胞苷脱氨酶(Target‑AID)融合可精确靶向基因组位点并进行碱基编辑[72]。胞苷脱氨酶(Cda)是核碱基脱氨酶之一,负责催化单链DNA 上胞嘧啶(C)向尿嘧啶(U)的转化。与dCas9 融合的Cda 会对非互补DNA 链上的C 残基进行脱氨,该链在形成sgRNA/DNA杂交时未成对并会产生不匹配的U‑G碱基对,再通过不匹配修复系统转换为U‑A碱基对,最终转换为T‑A 碱基对,从而导致C 到T 突变[图2(a)]。尿嘧啶DNA糖基化酶抑制剂(Ugi)是一种抑制人和细菌碱基切除修复的DNA 模拟蛋白,将其过表达可提高C到T的突变效率。由于解脂耶氏酵母偏向利用NHEJ 机制修复DNA 的双键断裂,容易在胞苷脱氨酶脱氨基后通过NHEJ碱基切除修复形成插入或缺失突变,因此降低NHEJ效率有利于提高靶向碱基编辑的准确性。在敲除KU70的解脂耶氏酵母菌株中表达融合了Cda 和Ugi 的dCas9 蛋白以及sgRNA,该系统中的dCas9 负责将Cda 招募到靶向DNA,无需任何供体DNA 即可引发C 到T 的突变[73]。碱基C 到T 突变后可形成TAA 终止子,提前终止基因的转录。在优化碱基编辑器融合蛋白的表达水平后,该Target‑AID系统能实现单、双基因破坏,效率分别为94%和31%。
1.3.5 CRISPR系统介导的全基因组分析
通过使用全基因组规模的sgRNA 将CRISPR/Cas9 靶向全基因组中大部分靶点可构建突变文库用于高通量分析基因的功能。在一定的筛选条件下,结合基因组测序可鉴定出感兴趣的靶点,用于确定符合筛选条件的基因[图2(f)]。然而,有效sgRNA 的设计往往具有挑战性,需要sgRNA 能够有效行使功能并覆盖大部分基因组。Schwartz等[74]开发了一种方法来量化基因组规模文库中每个sgRNA 的切割效率,从而设计出能够有效覆盖解脂耶氏酵母94%基因组的sgRNA文库。进一步,利用该sgRNA 辅助进行全基因组分析,成功应用于鉴定必需基因以及筛选增加脂质积累的靶点。最近,该研究小组采用类似的方法基于该文库成功地在全基因组中筛选出影响解脂耶氏酵母形成菌丝的基因靶标,成功鉴定出5种具有零菌丝表型的突变体,其中RAS2(YALI1_E35305g)被鉴定出编码参与饥饿反应和细胞形态GTP 结合蛋白的基因,将其敲除不影响番茄红素合成并能抑制菌丝的形成[75]。Baisya 等[76]开发了一种基于深度学习的指南设计算法(DeepGuide),能够准确预测化脓性链球菌Cas9和毛螺旋菌Cpf1的sgRNA 在解脂耶氏酵母中的活性,这将有利于指导构建高活性全基因组sgRNA文库。
2 基因表达的调控策略
高效、精准、可控的基因表达是实现细胞工厂生产效能最大化的关键步骤,其中平衡底盘细胞中各个代谢途径,并最大化地导向目标代谢物途径,从而提高目标产物的合成是合成生物学的重要目标之一。代谢途径中酶的表达水平可以通过不同方式控制,下面对解脂耶氏酵母底盘细胞中常用的基因表达调控策略(包括提高基因拷贝数、提高启动子强度和密码子优化)和基于生物传感器的动态调控策略展开讨论。
2.1 提高基因表达的策略
2.1.1 提高基因拷贝数
在解脂耶氏酵母中构建合成高附加值产品的代谢通路过程中往往需要对关键酶进行过表达,提高基因拷贝数来提高关键基因的转录水平是一种可行的策略。例如,在解脂耶氏酵母中,当LacZ 表达盒的拷贝数从5 增加到13 时,多拷贝转化子中β‑半乳糖苷酶的活性呈线性增加[77]。同样,在该酵母中,当两拷贝表达密码子优化的(-)‑α‑红没药醇合酶基因MrBBS后,发现(-)‑α‑红没药醇的产量比单拷贝MrBBS时产量提高了4倍[7]。为了增加目标基因在解脂耶氏酵母中的拷贝数,可将多个表达盒连接成一个片段并结合一个筛选标记通过HR 或NHEJ 的方式整合到基因组的一个位点,亦可将表达盒通过多轮整合的方式结合不同的筛选标记靶向基因组的不同位点,这种通过多轮整合提高基因拷贝数的方式需要消耗多个筛选标记,而基于Cre‑loxP 系统和Ura3‑blaster 的筛选标记回收技术,可仅用一个筛选标记实现基因的多轮迭代整合[7,78‑80]。无论基因是在多个位点整合还是在单个位点整合,它们都需要通过HR 或NHEJ 整合到酵母基因组。目前,已有研究鉴定出一系列对解脂耶氏酵母生长没有影响且整合效率较高的位点,结合HR 或者CRISPR 技术可实现基因的定点整合。而NHEJ整合具有随机性,不同位点的基因表达水平不同,可通过筛选优势的阳性转化子来进一步促进基因的表达。
上述基于筛选标记的整合方式通常单轮整合只能实现一个拷贝数的增加,这是因为这些筛选标记仅需要一个拷贝就足以恢复菌株在相应缺陷型培养基中生长。对尿嘧啶缺陷型筛选标记基因Ura3 进行启动子截短,构建新的缺陷型筛选标记(例如启动子截短的Ura3d4 仅含6bp 的启动子),使得解脂耶氏酵母中必须整合多个拷贝Ura3d4 才能在尿嘧啶缺陷型培养基中生长。研究还表明,Ura3 的启动子被截短到不同长度可实现不同拷贝数水平的多拷贝整合。通过调节Ura3 启动子长度可寻找最佳拷贝数的多拷贝整合菌株从而优化基因的表达水平。高拷贝数的转化子在营养丰富的培养基中并不稳定,如Ura3d4 筛选标记在YPD 培养基中平均拷贝数稳定在大约10 个[31]。Bai 等[54]发现不同启动子长度的Ura3 筛选标记可结合基于NHEJ 的随机整合而构建基因拷贝数不同的解脂耶氏酵母表达文库,基于颜色反应或者产物产量可筛选出最优的表达菌株,这显著加快了菌株改造的进程。Zeta是一种存在于转录转座子Ylt1中的长末端重复序列(LTR),它在解脂耶氏酵母的某些菌株(例如JMY1212)基因组上具有较高的拷贝数,表明其作为多整合位点的潜力[81]。但是Zeta位点只存在于少数被改造过的解脂耶氏酵母菌株中,限制了其在其他株系中的应用。但是,所有的解脂耶氏酵母株系体内均存在大约200多拷贝的核糖体26S rDNA 簇,利用其作为同源臂结合启动子截短的Ura3d4 筛选标记,可实现目标基因在26S rDNA位点的多拷贝整合[77,82]。
2.1.2 提高启动子强度
为了提高启动子的强度和可调性,许多启动子工程策略已经用于改进内源启动子[15]。解脂耶氏酵母中广泛使用的杂合启动子php4d,是由来自pXPR2 的4 个UAS1B 和pLEU2 的核心启动子融合组成,将其用于异源蛋白的表达具有显著的优越性:不受环境条件(pH 或碳/氮源)的影响,并且能够在任何培养基中驱动基因强表达[45,83‑84]。最近,Zhao 等[85]对解脂耶氏酵母的常见启动子成分(UAS、TATA 盒和核心启动子)进行了表征,以探索各种元件之间的协同机制。研究者对这些启动子元素进行重排,构建了不同转录水平的启动子库,随后以异戊醇的异源合成为例,将启动子库用于优化路径表达。与对照菌株相比,用此文库中最强启动子pUAS1B8-LEUm 调控关键基因表达时,异戊醇的产量提高了7.7 倍,而在一个相对弱的启动子pUAS1B4-EXPm 控制下,异戊醇的产量提高了30.3 倍,这表明蛋白质的表达水平并不总是与启动子的强度呈正相关。此外该研究也发现来自酿酒酵母三种不同的UAS 也可用于构建适用于解脂耶氏酵母的杂合启动子,表明启动子元件具有从酿酒酵母到解脂耶氏酵母的可转移性。
通过内含子增强启动子强度也是提高解脂耶氏酵母中基因表达的一种常用策略。在内源启动子pTEF和pFBA插入相应的内含子序列获得pTEFin和pFBAin,其强度分别提高了17 倍和5 倍[23,26]。类似地,Cui 等[53]在php4d、pEXP1 和pTDH1 启动子添加相同的内含子序列,发现其强度均有不同程度的提高。尽管添加内含子序列是增强启动子强度的一种简单的方法,并且这种方法适用于许多真核生物,然而,内含子增强的机制仍不清楚。因此,需要挖掘其调控机制,以更好地设计具有更高活性的启动子元件。
2.1.3 密码子优化
与模式微生物的GC 含量相比(如大肠杆菌中GC 含量50%、酿酒酵母中GC 含量为38%),解脂耶氏酵母基因组中的GC 含量比较高(49.6%~51.7%),具有独特的生理生化特性,与酿酒酵母的氨基酸同源性只有50%~60%[86]。解脂耶氏酵母的RNA 聚合酶Ⅱ启动子和转录因子与酿酒酵母有比较大的差异,故解脂耶氏酵母的基因几乎不能直接在酿酒酵母中表达。在酿酒酵母中,只有5%的基因含有内含子,而解脂耶氏酵母中内含子的含量达到15%[87‑88]。解脂耶氏酵母的密码子偏好性不同于酿酒酵母而类似于曲霉菌。
对于解脂耶氏酵母底盘细胞的工程改造,经常需要表达异源基因,而每个宿主有自己偏好的密码子,因此需要对密码子进行优化以适应不同的底盘细胞。使用优化的密码子不仅影响异源蛋白质的翻译速率,还有利于蛋白质的折叠[89]。密码子优化是提高外源基因在解脂耶氏酵母底盘细胞中表达的一个常用策略。研究者以人干扰素α2b(hIFN 2b)为模型研究低的翻译表达效率与外源蛋白表达之间的关系。根据密码子在解脂耶氏酵母中的使用频率合成了密码子优化的hIFN 2b 基因,结果显示,与野生型基因相比,密码子优化的基因将Ifn 蛋白表达提高了11 倍[90],表明了在解脂耶氏酵母底盘细胞中进行密码子优化以提高基因表达的必要性。来自比利时的研究者通过优化密码子使用和调整GC含量与解脂耶氏酵母相近(约50.5% GC),有效提高在解脂耶氏酵母中异源表达的α‑1,2‑甘露糖苷酶的活性,且异源表达没有抑制细胞的生长,再次确认了优化密码子和GC含量的必要性[91]。
2.2 基因表达的动态调控
近年来,基于对解脂耶氏酵母底盘细胞代谢的深入了解以及成熟的合成生物学工具的开发,人们对其进行了深度改造,最大限度地提高了相关产物的产量。然而,经过工程改造的底盘细胞往往由于代谢失衡而限制了目标产物产量的进一步提高[92]。最近,基于各种转录因子响应特定的细胞内代谢物的动态调控系统,特别是基于原核生物转录因子相对简单的调控机制,已广泛用于构建真核生物的生物传感器以解决这一问题(图3)[93‑94]。
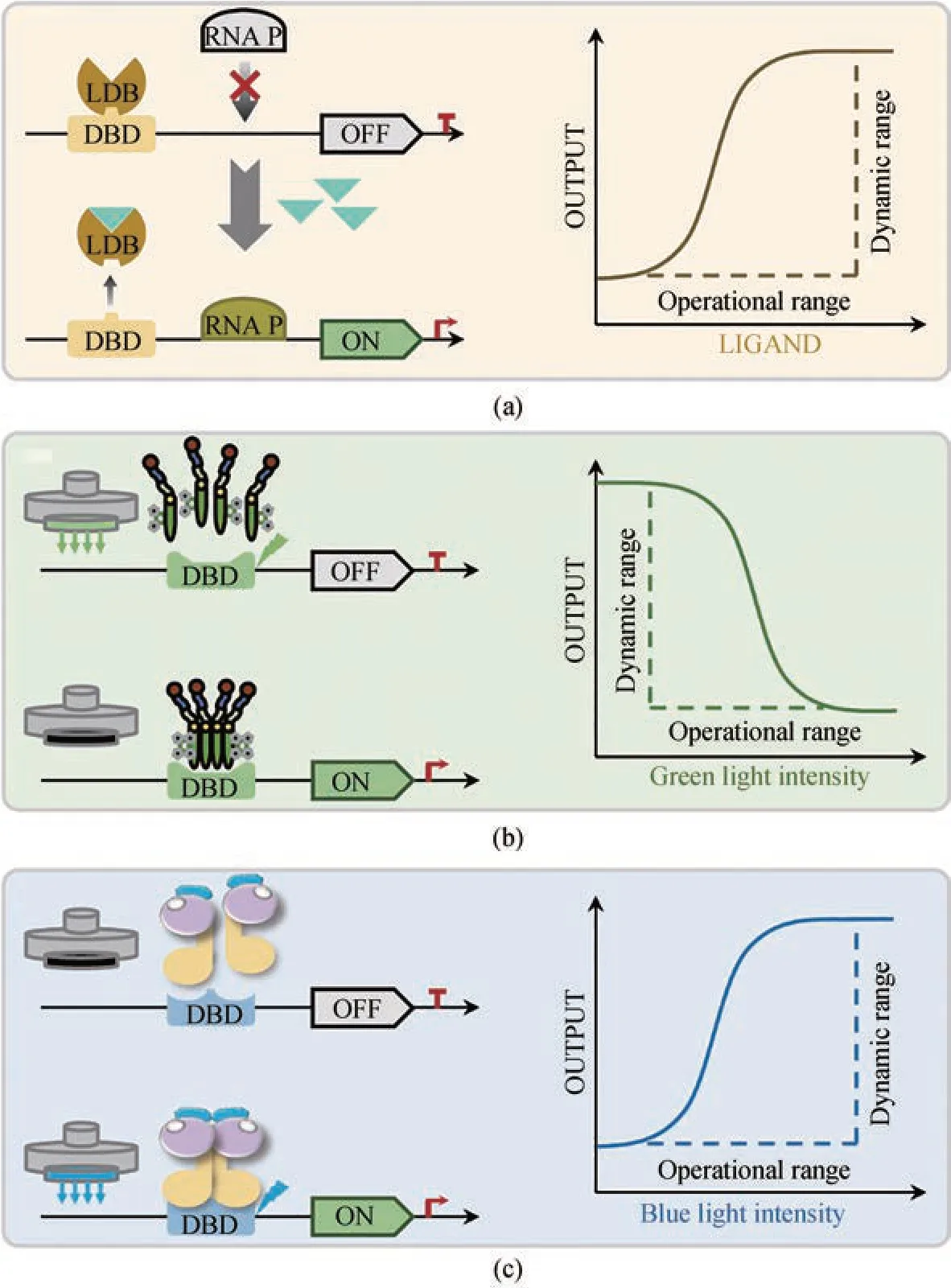
图3 解脂耶氏酵母中用于基因表达动态调控的生物传感器(a)响应代谢物的生物传感器调控原理,包括响应代谢物存在时的启动表达“ON”模式,以及没有响应代谢物存在条件下关闭表达“OFF”模式;(b)基于绿光响应抑制的基因表达动态调控原理,包括绿光光照条件下的关闭表达“OFF”模式,以及黑暗条件下的启动表达“ON”模式;(c)基于蓝光响应激活的基因表达动态调控原理。包括蓝光光照条件下的启动表达“ON”模式,以及黑暗条件下的关闭表达“OFF”模式。DBD-DNA结合域;LDB-配体结合域;RNA P-RNA聚合酶Fig. 3 Dynamic regulation of gene circuits through biosensors in Yarrowia lipolytica(a) Mechanism of the metabolites response biosensor,“ON” mode represents turning on the gene expression in the presence of the response metabolites,and “OFF” mode represents turning off the gene expression in theabsence of the response metabolites; (b) Mechanism of the green light response biosensor,“ON” mode represents turning on the gene expression in the dark condition;and “OFF” mode represents turning off the gene expression under the green light; (c) Mechanism of the blue light response biosensor, “ON” mode represents turning on the gene expression under the blue light, and “OFF” mode represents turning off the gene expression inthe dark condition.DBD-DNA binding domain; LDB-ligand binding domain; RNA P-RNA polymerase
2.2.1 脂肪酰辅酶A生物传感器
脂肪酰辅酶A 是脂质代谢的关键中间体,也是脂肪酸衍生物的直接前体,包括脂肪醇、脂肪酸乙酯、脂肪酸甲酯、烯烃和烷烃等。来自大肠杆菌的转录因子FadR 及其操纵子fadO被用于构建解脂耶氏酵母中的脂肪酰辅酶A 生物传感器[95]。该传感器在结合到其响应物脂肪酸时,可对其调控的基因进行激活调节[图3(a)]。研究者将其用于调控将棕榈酸转化为ω‑羟基棕榈酸的细胞色素P450酶,以解耦细胞生长和产物合成。FadR由强组成型启动子控制,不同数量fadO(0个、1个和3个)插入3 种强组成型启动子(pGPD、pTEF 和pLEU)中以优化脂肪酰辅酶A传感器。发现在这些FadR合成启动子中,pTEFR1(1个fadO插入到pTEF)可以有效地提高ω‑羟基棕榈酸的产量。
2.2.2 柚皮素生物传感器
柚皮素可以从莽草酸途径中间体衍生的丙二酰辅酶A和香豆酰辅酶A合成,是合成其他营养补充剂和药物的黄酮类化合物的关键中间体。来自血清草杆菌的类黄酮感应转录激活因子FdeR 及其操作子FdeO 已经被用于构建解脂耶氏酵母中的柚皮素生物传感器[96]。该传感器由pTEF 表达的FdeR 和杂合FdeO‑TEF 启动子组成,工作范围为0~50 mg/L 柚皮素。将柚皮素敏感的生物传感器用于调控细胞生长的必需基因亮氨酸合成编码基因的合成,然后选择性地富集产生柚皮素的种群,从而使产柚皮素的菌株具有了生长优势。不含传感器的菌株在经过300 代以上的传代后失去了94.5%的柚皮素产量,而含有传感器的菌株在经过324 代传代后仍具有90.9%的柚皮素产量,这种将化学成瘾与负反馈调控相结合来提高代谢稳定性和产量的策略对于排除长期和大规模发酵过程中的代谢异质性具有重要作用。
2.2.3 木糖生物传感器
木糖是木质纤维素中含量最丰富的糖类之一,微生物对木糖的有效利用对于提高生物燃料和生物基化学品的经济性至关重要[97‑98]。许多研究人员试图工程改造解脂耶氏酵母以利用木糖[99]。Wei等[100]利用来自大肠杆菌的木糖响应转录因子(XylR)构建适用于解脂耶氏酵母的木糖可诱导的生物传感器(xylbiosensor),它仅在木糖存在的情况下与其同源结合位点(xylO)结合。添加木糖后,生物传感器能够触发其调控基因的转录激活。此外,研究者将异源木糖利用基因引入到解脂耶氏酵母中,置于生物传感器的控制之下,构建以木糖为底物的工程菌[100],发现含木糖诱导系统的解脂耶氏酵母,基于木糖作为底物和诱导剂的双功能,被用于合成柚皮素,其产量达到(715.3 ±12.8)mg/L,远高于组成型启动子UAS1B8TEF控制下的产量(239.1 ± 5.1)mg/L[101]。
2.2.4 赤藓糖醇生物传感器
基因动态调控系统还可以作为一种高通量工具,用于筛选和表征突变文库中的高产菌株。Qiu等[102]基于流产布鲁氏菌(Brucella abortus)的赤藓糖醇响应转录因子EryD 建立了赤藓糖醇传感器调节系统,首先配置了EryD 传感器‑调节器的最佳架构,其对赤藓糖醇的响应范围为5~250 mmol/L。结合紫外和ARTP诱变及生物传感器菌株筛选,在一周内从包含1152 个解脂耶氏酵母突变库中筛选出性能最佳的菌株,能产生148 g/L 的赤藓糖醇。该生物传感器能够快速提高菌株性能,并为工业应用设计高效的微生物细胞工厂提供很好的参考。
2.2.5 光控生物传感器
除了利用底物或中间代谢物作为传感器的响应物质,研究者在解脂耶氏酵母中还建立了光控生物传感器。利用细菌来源的CarH 作为绿光诱导因子,结合转录激活因子VPRH,构建绿光响应元件的光控表达系统[图3(b)]。该系统可在绿光和黑暗条件下调控前体及产物合成,研究者将该系统用于动态调控对香豆酸和柚皮素的合成,黑暗条件下的对香豆酸产量是绿光诱导下的2.0 倍,柚皮素产量是绿光诱导下的2.6 倍[103]。尽管本研究的产量与其他研究相比尚有一定的差距,但其在解脂耶氏酵母中建立的绿光调控抑制某一特定基因的转录系统具有一定的通用性。最近,华中科技大学的研究者利用来自赤杆菌的光敏反应蛋白EL222 和其响应因子C120,在解脂耶氏酵母中构建了蓝光诱导系统[图3(c)][104]。以GFPMut3 作为报告蛋白,在蓝光诱导8 h 后荧光信号比黑暗条件下高128.5 倍。该传感器进一步被用于调控抗性基因博来霉素(BleoR)抗性蛋白的表达,结果表明在黑暗条件下50~250 g/mL 的博来霉素可完全抑制或延缓解脂耶氏酵母的生长,而在恒定的蓝光诱导下,BleoR 可诱导抗性基因表达并促进细胞生长。光作为诱导因子具有响应速度快、无损、可逆和独特的时空特异性等优势,因此具有规模化应用的潜力。
3 基因组规模代谢模拟
基因组规模代谢模拟(genome‑scale metabolic modelling)是通过构建基因组规模代谢模型(GEM)来研究微生物底盘细胞代谢特性的重要手段,是预测代谢通量分布的有力工具,有助于理解复杂的细胞生理代谢,并指导底盘细胞的设计和生产性能的改善。GEM的构建为合成生物学研究提供了必要的工具,可以显著加快合成生物学研究过程中设计-构建-测试-学习迭代循环的进程[105]。GEM以及各种基于约束的建模方法为深入理解微生物底盘细胞的代谢过程铺平了道路[106]。此外,通过与众多菌株计算优化方法(CSOM)相结合,GEM已经成功用于寻找新的基因操作靶标而服务于各种工业微生物底盘细胞的合成生物学[107]。
为了将该工具应用于解脂耶氏酵母底盘细胞的合成生物学,几种针对解脂耶氏酵母的GEM 陆续被开发出来[108]。早在2012年,就有两个解脂耶氏酵母的GEM(iNL895[109]和iYL619_PCP[110])被报道,然而,对这两种解脂耶氏酵母的GEM 关注更多的是重建和表征解脂耶氏酵母的代谢网络,而不是有关GEM 的应用。2015年和2016年,奥地利和瑞典的两个研究小组重新构建了解脂耶氏酵母的GEM,分别为iMK735[111]和iYali4[112]。这两个新模型比前两个模型更面向应用,其中iMK735被成功用于优化野生解脂耶氏酵母补料分批发酵产油脂[111],而iYali4 则作为一个框架,用于装载转录组、脂质组以及发酵物谱,以揭示解脂耶氏酵母的脂质代谢调控新机制[112]。
以上4 种解脂耶氏酵母的GEM 均是基于不同的基础模型、资源和数据库而独立开发出来的[108]。其中,iNL895 和iYali4 来源于不同版本的酿酒酵母代谢网络模型[113],iYL619_PCP 是基于多个数据库中的生化和基因组信息组装而成,如KEGG 和BiGG[110],而iMK735则是使用高质量的酿酒酵母GEM--iND75 作为基础重建而来[114]。最近,Wei 等[115]和Mishra 等[116]利用更新的解脂耶氏酵母GEM(iYL_2.0 和iYLI647,分别是基于iYL619_PCP 和iMK735 的更新版本) 和现有CSOM探索了相应的工程策略。在这两项探索中,研究者测试了各种CSOM,例如,将OptGeneKnock[117]和APGC[118]用于脂质的高产,将tSOT和辅因子修饰分析用于十二碳二元酸的高产[119]。然而,尽管这些新模型提出了一些有建设性的建议,它们均未能成功地发现新的基因操作靶点,而且没有经过实验验证。2019 年,Kim 等[120]基于模型iMK735,证明了环境代谢调节最小化算法(eMOMA)可以用于预测氮限制条件下解脂耶氏酵母的代谢通量分布,并可用于鉴定提高脂质产量的基因操作靶标。基于eMOMA的设计方法,不仅验证了已知的工程改造靶标,而且成功预测了新颖的和非直觉的靶标。通过敲除新鉴定的基因操作靶标YALI0F30745g,使解脂耶氏酵母的脂质产量增加了45%。
最近,我国科学家[121]构建了解脂耶氏酵母模式菌株W29的GEM--iYli21,并基于该模型整合转录组数据系统解析了碳代谢途径。该模型预测190 种Biolog 碳源利用达到85.7%的准确率。以转录组学数据为约束,利用该模型计算了解脂耶氏酵母在葡萄糖、甘油、十六烷、油酸、三油酰甘油酯、三丁酰甘油酯6种碳源下的代谢流分布。当以葡萄糖和甘油为唯一碳源时,代谢流集中在糖酵解,而当以脂肪酸、烷烃和甘油酯为唯一碳源时,大部分代谢流分布于糖异生和脂肪酸氧化。随后,利用该模型预测了46种底物生产5种常见产物(柠檬酸、赤藓糖醇、3‑脱氢莽草酸、油酸、柠檬烯)的得率,发现己酸在最大理论产率方面相比其他底物具有明显优势。经对比分析,iYli21 与已报道的解脂耶氏酵母其他代谢模型相比,具有表型预测一致性高、代谢反应覆盖全等特点(表2)。该模型将成为研究解脂耶氏酵母代谢机制,理性设计解脂耶氏酵母底盘细胞的有力工具。
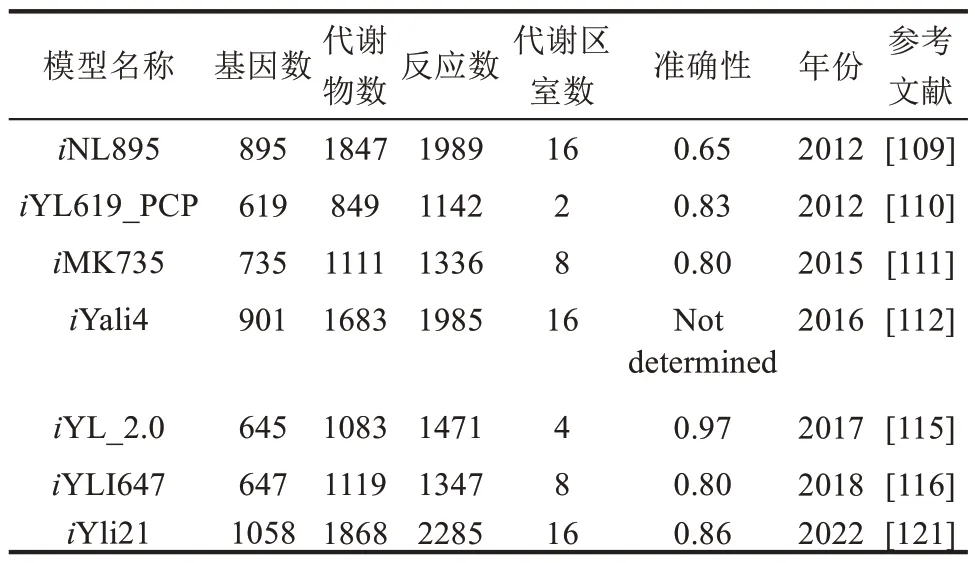
表2 解脂耶氏酵母各种基因组规模代谢网络模型统计Table 2 Summary of the different GEMs available for Yarrowia lipolytica
4 解脂耶氏酵母底盘细胞的应用
解脂耶氏酵母独特的生理生化特征使其在多种化合物的生物合成方面具有独特的优势。合成生物学技术的发展和工具的开发,极大地促进了解脂耶氏酵母底盘细胞工程改造与应用的快速发展。本节主要对近年来利用解脂耶氏酵母底盘细胞生产蛋白质、有机酸、萜烯类、功能糖及糖醇类、脂肪酸及衍生物、聚酮类和黄酮类以及氨基酸衍生物类等化合物的应用实例进行了总结,解脂耶氏酵母底盘细胞合成各种化合物的代谢途径如图1所示。
4.1 蛋白类
异源蛋白由于其较高的学术和商业应用价值,已引起科学家广泛的兴趣。部分丝状真菌由于具有高效的蛋白分泌能力,已被广泛研究用于生产异源重组蛋白,例如曲霉和木霉[122‑123],但是丝状真菌也面临诸多局限性,例如细胞形态不易控制、生长缓慢、发酵周期长和表达蛋白种类少等。解脂耶氏酵母在生产异源蛋白方面具有独特的优势,可使用广泛的底物,具有后翻译转录机制及大量分泌蛋白质的能力,且不受高糖基化问题或代谢物在有氧条件下转向乙醇生产的阻碍,使其可以高效分泌表达复杂的异源蛋白[84,124]。解脂耶氏酵母中碱性胞外蛋白酶基因(XPR2)可在蛋白胨诱导下高水平表达,碱性胞外蛋白酶产量达1~2 g/L,其已经成为蛋白质分泌研究的模型[125]。此外,解脂耶氏酵母其他几种内源蛋白质(脂肪酶、磷酸酶和酸性胞外蛋白酶)也有较高的分泌水平[30]。2006 年,中国台湾Yeastern 公司开发商用YLEX™试剂盒用于异源蛋白的分泌和表达[50]。该试剂盒目前已用多种工业酶蛋白的表达,如脂肪酶、α‑淀粉酶、木聚糖酶A、溶解性多糖单氧酶和葡萄糖氧化酶等[126‑130]。此外,单细胞蛋白中的氨基酸组分齐全,可利用率高,还含维生素、无机盐、脂肪和糖类等,具有很好的营养价值,解脂耶氏酵母由于其独特的生理生化特征,也一直用于生产单细胞蛋白[131‑133]。
重组治疗蛋白的生产是分子医学快速发展的领域之一,目前在多种疾病的治疗中发挥着重要作用。人干扰素α2b(hIFN 2b)是包含两个二硫键的复合细胞因子,作为抗病毒和抗肿瘤药物应用。由于解脂耶氏酵母具有较高效的分泌途径和较低的糖基化水平,hIFN 2b 已经作为模型蛋白在解脂耶氏酵母中生产,通过培养基和培养过程的优化,其产量增加了3500 倍,生物活性提高了25倍[134‑135]。解脂耶氏酵母也被开发作为生产人型末端甘露糖糖基化蛋白的平台,即Man8GlcNAc2或Man5GlcNAc2,并鉴别出高尔基体α‑1,6‑甘露糖基转移酶YlOCH1,发现其对N‑寡糖链的延伸至关重要,可为其他糖蛋白的改造提供指导[91]。相似地,另一研究团队也鉴别了解脂耶氏酵母中YlMPO1在甘露糖基磷酸化中的重要作用[136],可为解脂耶氏酵母中特异性糖基修饰构建人源化糖基化途径提供指导。尽管目前解脂耶氏酵母中重组治疗蛋白的研究还比较基础,但是因解脂耶氏酵母底盘细胞的优势以及重组治疗性蛋白极大的市场(数十亿美元),通过现有合成生物学工具进一步优化菌株,对未来提高治疗性蛋白的生产效率是十分必要的。
4.2 有机酸
包括TCA 循环前体和中间体在内的有机酸的分泌,是解脂耶氏酵母最为显著的生化特征之一。解脂耶氏酵母底盘细胞具有较高的TCA 循环通量及低pH 值耐受性,意味着该底盘细胞具有高水平生产TCA 循环中间体--各种有机酸的潜力。在这些有机酸中,柠檬酸积累的优势尤为明显[137]。基于与酿酒酵母的氨基酸序列比对,Yuzbasheva等[138]鉴别和表征了解脂耶氏酵母中唯一的柠檬酸转运蛋白YlYhm2,该蛋白负责柠檬酸盐在线粒体膜上的转运。YlYhm2 和磷酸腺苷脱氨酶YlAmpd的共表达导致细胞质柠檬酸滴度显著增加,产量和生产强度分别达到97.1 g/L 和0.93 g/(L·h)。该研究团队还报告了线粒体琥珀酸‑富马酸转运蛋白YlSfc1在调控线粒体异柠檬酸逸出中的作用,通过共表达YlSfc1和YlAmpd并失活YlYhm2后,异柠檬酸的积累显著增强,产量达到(136.7 ± 2.5)g/L[139]。
除此之外,解脂耶氏酵母也用于生产琥珀酸、衣康酸、α‑酮戊二酸和丙酮酸。例如,通过转运蛋白工程,即鉴别琥珀酸线粒体转运蛋白加强琥珀酸分泌出线粒体,并通过筛选C4‑二羧酸转运体加强琥珀酸的胞外分泌,同时优化琥珀酸生物合成途径,最终琥珀酸的产量达到101.4 g/L[140]。同样地,通过异源表达线粒体顺乌头酸转运蛋白Mtt,强化顺乌头酸从线粒体转运到细胞质,极大地促进了解脂耶氏酵母中衣康酸的积累,达到22.03 g/L[141]。此外,通过筛选野生菌株,结合随机突变和培养基优化,解脂耶氏酵母分别产生67.4 g/L α‑酮戊二酸和39.1 g/L 丙酮酸[142‑144]。总的来说,这些结果表明解脂耶氏酵母作为底盘细胞生产有机酸具有很大的优势和良好的前景。
4.3 萜烯类
得益于固有的甲羟戊酸(MVA)途径、高通量的乙酰辅酶A 和NADPH 供给以及天然疏水性微环境,解脂耶氏酵母是生产萜烯类的理想底盘细胞[145‑147]。萜烯类化合物是一种来源于植物的次级代谢产物,广泛应用于食品、医药、化妆品和农业领域[148]。所有萜烯类化合物均来自异戊烯焦磷酸盐(IPP)及其异构体二甲基烯丙基焦磷酸(DMAPP),两者都是五碳结构单元。根据异戊二烯的数量,萜类化合物可分为单萜(C10)、倍半萜(C15)、二萜(C20)、三萜(C30)和四萜(C40)[10]。解脂耶氏酵母中萜烯类化合物的合成通常通过过表达MVA 途径的关键酶HmgR(或截短N 端的tHmgR)和下调竞争路径(如角鲨烯和脂质途径)实现。结合异源萜烯合酶的引入,解脂耶氏酵母底盘细胞已被改造用于生产多种萜烯类化合物,如柠檬烯[149‑150]、α‑法尼烯[56]、β‑法尼烯[150]、α‑葎草烯[151]、(-)‑α‑红没药醇[57,152]、赤霉素[153]、角鲨烯[154]、桦木酸[155]、番茄红素[156]、β‑胡萝卜素[157]和虾青素[158]等。
作为产油酵母,解脂耶氏酵母是合成和积累疏水性萜烯类化合物的理想底盘。由于细胞质的亲水环境,疏水化合物在这一环境下高通量的积累具有一定的难度。越来越多的研究表明疏水化合物一般在细胞膜或脂质体中积累[157,159],如大肠杆菌和酿酒酵母就以细胞膜积累这些疏水性物质[159‑160],然而细胞膜储存一方面容易造成膜流动性受损,另一方面其溶解度受到很大的限制。与之对应的,解脂耶氏酵母可利用其独特的细胞器脂质体储存疏水性物质,具有一定的优势,在解脂耶氏酵母的脂质体中积累的番茄红素和β‑胡萝卜素分别能达到4.2 g/L 和6.5 g/L[157,161],显著高于酿酒酵母的同类研究。此外,由于其转录后修复机制以及丰富的细胞内膜,解脂耶氏酵母也被认为是膜蛋白(例如P450 酶)功能表达的优选底盘。P450 酶是萜烯类化合物合成生物学研究中重要的生物元件,例如通过P450 酶修饰萜烯骨架,已经在解脂耶氏酵母中实现了桦木酸[155]、圆柚酮[162]、赤霉素[153]、脱落酸[163]和人参皂苷CK[164]等具有复杂结构萜烯类化合物的合成。
4.4 功能糖及糖醇类
糖醇是一组无环氢化碳水化合物,在生物医学、制药、绿色化学和农业食品等领域具有广泛的应用前景[165]。例如,赤藓糖醇不会影响血液中的胰岛素水平,因此是一种安全的甜味剂,在饮料、食品和药品原料方面都有广泛的应用[166]。2017 年,来自波兰的科学家揭示解脂耶氏酵母中以甘油和葡萄糖为底物合成赤藓糖醇的主要代谢途径[167]。赤藓糖醇主要是通过磷酸戊糖途径生产,其中转酮酶起着最重要的作用,其过表达可提高赤藓糖醇产量2 倍。最近,结合UV 和ARTP联合突变产生解脂耶氏酵母突变库,利用2.2.4 节所述的赤藓糖醇生物传感器,研究者快速表征了含1152 个突变菌株,最终在解脂耶氏酵母底盘细胞中生产高达148 g/L的赤藓糖醇[102]。D‑苏糖醇是赤藓糖醇的非对映异构体,也广泛应用于医药、食品、绿色化学等领域。通过木糖醇脱氢酶(Xdh)从赤藓糖醇合成D‑苏糖醇是目前研究最多的方法。通过在产赤藓糖醇的解脂耶氏酵母中过表达来自树干毕赤酵母(Scheffersomyces stipitis)的XDH基因,D‑苏糖醇的产量达到了112 g/L[168]。
木糖醇是一种用作甜味剂的糖醇,具有良好的抗炎作用,可有效治疗慢性炎症性疾病,在牙科和口腔疾病方面有极大的应用[169]。尽管解脂耶氏酵母中有完整的木糖利用途径,但由于控制该途径的关键酶(Xdh 和Xks)受到严格调控,导致解脂耶氏酵母无法在木糖上生长。Prabhu 等[170]建立并优化了将木糖转化为木糖醇的生物过程,显示了解脂耶氏酵母将木糖转化为木糖醇的巨大潜力,其产量接近理论值(>90%),且产生的木糖醇浓度与最佳木糖醇生产者(热带假丝酵母)相似,表明解脂耶氏酵母具备从廉价原料合成木糖醇的潜力。
2'‑岩藻糖基乳糖(2'‑fucosyllactose,2'‑FL)是人乳中含量最高的乳糖,具有调节肠道菌群、免疫调节及促进神经系统发育和修复等多种活性功能[171]。最近,DuPont 研究团队[172]以解脂耶氏酵母为底盘细胞,导入异源乳糖转运蛋白(Lac12)和将GDP‑甘露糖转化为GDP‑岩藻糖的酶,结合α‑1,2‑岩藻糖基转移酶的表达,在解脂耶氏酵母中实现2'‑FL 的生产,且其产量与传统生产者大肠杆菌相当。此外,工程解脂耶氏酵母菌株也是合成异麦芽酮糖和海藻糖的有力的底盘细胞,产量可分别达到572.1 g/L和219 g/L[173‑174]。
4.5 脂肪酸及衍生物
解脂耶氏酵母作为一种安全的产油酵母,已被研究用于生产各类常规和非常规的脂肪酸及其衍生物。解脂耶氏酵母体内的脂质主要以中性甘油三酯(TAG)为主,且含有少量的甾醇酯。TAG的合成主要以3‑磷酸甘油(G3P)为骨架将各类脂肪酰基辅酶A 在内质网中组装,最终会被储存到脂滴(LB)中。解脂耶氏酵母的天然脂肪酸主要为棕榈酸(C16:0)、棕榈油酸(C16:1Δ9)、硬脂酸(C18:0)、油酸(C18:1Δ9)和亚油酸(C18:2Δ9Δ12),还含有极少的C20~C24偶数链饱和脂肪酸[8]。其体内丰富的乙酰辅酶A 得益于独特的柠檬酸穿梭途径,这为脂肪酸的合成提供了充足的前体[8,175]。从头合成脂肪酸以乙酰辅酶A以及乙酰辅酶A羧化酶催化合成的丙二酰辅酶A为原料。其中乙酰辅酶A充当起始单元,丙二酰辅酶A 充当延伸单元由脂肪酸合成酶(Fas)催化每次通过Claisen‑like 反应延长2 个碳链,终产物为饱和的C16和C18脂肪酰基辅酶A(C16:0和C18:0)。随后C16和C18脂肪酰基辅酶A进入内质网进一步延长去饱和修饰并结合到G3P骨架通过Kennedy途径组装成TAG。
基于内源的脂肪酸和脂质合成代谢,已经开发了一系列工程策略用于提升解脂耶氏酵母的总脂质。经典的工程策略主要包括过表达内源或表达外源基因加强脂肪酸的合成与积累,以及破坏脂肪酸降解途径。具体包括加强脂肪酸合成前体乙酰辅酶A和丙二酰辅酶A的供应,加强脂质合成骨架G3P 的供应,加强脂肪酰辅酶A 到TAG 的积累,以及阻断TAG 和脂肪酰辅酶A 的降解。另外新兴的工程策略主要包括重构NADPH 途径、抵御活性氧、加强脂肪酸的分泌、实验室适应性进化、组学工程以及计算机辅助设计等[9]。这些策略促进了解脂耶氏酵母中脂肪酸及其衍生物的合成,最高的脂质滴度达到了115 g/L[176],最高脂质含量超过细胞干重的90%[32]。在高脂质积累的菌株中过表达脂肪酶并破坏激活游离脂肪酸至脂肪酰辅酶A 途径的酶可有效积累游离脂肪酸,过量的游离脂肪酸会分泌到胞外,首次突破了解脂耶氏酵母胞内脂质生产100%占比的物理限制,最高占细胞干重的120%[177]。这些案例显示出利用解脂耶氏酵母生产脂质产品的可能性。这类脂质产品可衍生为一系列化合物如脂肪醛、烷烃、烯烃、脂肪酸酯等,有潜力作为新一代的生物能源代替化石燃料[178]。
除了解脂耶氏酵母中的天然脂肪酸外,许多具有特殊碳链长度或官能团的非常规脂肪酸广泛应用于化工、材料、营养和制药行业。非常规脂肪酸包括但不限于奇链脂肪酸、共轭脂肪酸、多不饱和脂肪酸、环丙烷脂肪酸、甲基支链脂肪酸、羟基脂肪酸和中链脂肪酸。随着合成生物学的快速发展,许多新的基因工具箱已被建立以工程改造微生物生产非常规的脂肪酸及其衍生物[8]。碳链长度不同的脂肪酸具有显著不同的特性,在能源、材料、医药和营养等领域有着广泛的应用。通过改造脂肪酸合成酶、硫酯酶、β‑氧化途径、延长和去饱和途径、多不饱和脂肪酸合成酶途径和奇链脂肪酸合成途径可调控脂肪酸的碳链长度生产定制链长的脂肪酸及其衍生物[9]。表达异源的硫酯酶以及改造内源Fas 的延伸域能够缩短脂肪酸的链长以生产中链脂肪酸,含量最高达到总脂肪酸的45%[179]。激活的脂肪酸会进入β‑氧化途径被降解,通过调节不同链长特异性的酰基辅酶A 氧化酶基因(POX1-6)可调控碳链长度从而生产中链的甲基酮[180]、聚羟基脂肪酸酯[181]、γ‑癸内酯[182]等。通过改造延长去饱和途径和表达多不饱和脂肪酸合成酶能够生成各类ω‑3 和ω‑6 型的多不饱和脂肪酸,如α‑亚麻酸(ALA)、γ‑亚麻酸(GLA)、花生四烯酸(ARA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等[183‑189]。杜邦公司在解脂耶氏酵母中改造延长去饱和途径、破坏β‑氧化途径以及加强磷脂途径能够合成占总脂肪酸56.6%的EPA,并通过进一步改造成功将其推向商业化[184,190]。通常解脂耶氏酵母中的脂肪酸从头合成是以乙酰辅酶A 为起始单元每次延伸两个碳原子,将起始单元换成C3或者C5的底物可实现奇数链脂肪酸的合成[191]。在解脂耶氏酵母体内构建丙酰辅酶A 从头合成途径能够以葡萄糖为底物从头合成奇数链脂肪酸,最高达到总脂肪酸的5.64%[192]。
4.6 聚酮类和黄酮类
聚酮化合物,作为具有生物活性的天然产物,在细胞防御机制中发挥重要作用。聚酮化合物通常由多功能酶聚酮化合物合酶(PKS)合成。三乙酸内酯是一种典型的Ⅲ型聚酮化合物,以丙二酰辅酶A和乙酰辅酶A为前体。研究者首先尝试通过大肠杆菌[193]和酿酒酵母[194]等模式微生物合成三乙酸内酯,然而最高产量仅为5.2 g/L[194]。由于高水平的内源性前体(如丙二酰辅酶A 和乙酰辅酶A),结合提高的β‑氧化效率和丙酮酸旁路途径,工程解脂耶氏酵母产生的三乙酸内酯比传统宿主高7 倍多,达到(35.9±3.9)g/L[195]。此外,研究者在解脂耶氏酵母体内异源表达非洲菊来源的2‑吡喃酮合酶基因,实现三乙酸内酯的生产,并以其为前体转为一种有价值的抗生素广藿香酮,其转化率可达到96%[196]。最近,研究者使用廉价的碳源乙酸盐代替葡萄糖,以丙酮酸脱氢酶复合途径实现乙酸盐到乙酰辅酶A 的快捷通路,三乙酸内酯产量达到4.76 g/L[197],该研究表明解脂耶氏酵母具有将低成本乙酸生成其他高价值聚酮化合物的潜力。
此外,黄酮作为植物着色剂天然存在,黄酮化合物及其衍生物具有重要的药学功能,代表了一个多样化的生物活性化合物家族[198]。由于其较高的内源前体水平以及疏水脂质体的存在,解脂耶氏酵母也是生产植物源黄酮类化合物的合适底盘细胞。目前,解脂耶氏酵母底盘细胞已经被成功改造用于生产白藜芦醇[199‑200]、柚皮素[96,101,198]和圣草酚[201]等黄酮类化合物。传统上,柚皮素在大肠杆菌、谷氨酸棒杆菌和酿酒酵母中产生,最大滴度分别为191.9 mg/L[202]、35 mg/L[203]和648.63 mg/L[204]。而在解脂耶氏酵母中,通过修饰β‑氧化途径和乙酰辅酶A 合成途径,柚皮素的产量已经达到898 mg/L,这是目前在异源宿主中合成的最高柚皮素水平[199]。圣草酚是以柚皮素为底物,通过黄酮‑3‑羟化酶和细胞色素P450还原酶(CPR)合成。通过将柚皮素途径以及来自不同植物的黄酮‑3‑羟化酶和CPR 整合到解脂耶氏酵母基因组中来生产圣草酚,进一步通过增加CPR 拷贝数以及过程优化将产量提高到134.2 mg/L[201],产量相较于大肠杆菌中达到的114 mg/L 具有优势[205],但是仍然低于酿酒酵母中的产量200 mg/L[206],还需要进一步工程改造优化。
4.7 氨基酸衍生物类
由L‑苯丙氨酸(L‑Phe)可以生物转化合成2‑苯乙醇,2‑苯乙醇是一种高价值芳香族化合物,广泛用于食品、香料和香精行业。2013 年,研究者首先考察了6种不同解脂耶氏酵母菌株合成2‑苯乙醇的能力,发现不同菌株合成2‑苯乙醇的能力有差异(0.01~0.24 g/L),并且生产效率取决于菌株,在添加L‑Phe 的培养基中,2‑苯乙醇的产量达到2 g/L[207]。随后,该研究团队通过全蛋白质组定量质谱分析获得直接或间接参与L‑Phe 转化为2‑苯乙醇的蛋白质图谱,为进一步工程改造提高解脂耶氏酵母产2‑苯乙醇提供指导[208]。最近,另一个研究团队表征了从L‑Phe 转化为2‑苯乙醇的艾氏途径,并逐步重构艾氏途径确定最佳的催化模块,结合细菌来源胞质α‑酮戊二酸途径重构和阻断竞争路径,在摇瓶水平合成了2669.54 mg/L的2‑苯乙醇,L‑Phe 的转化率达到95%[209]。该研究团队还系统表征和删除莽草酸途径的限速步骤,实现了5 种芳香族化学物质在解脂耶氏酵母的从头合成,包括来源于L‑Phe的2‑苯乙醇、来源于L‑酪氨酸的对香豆酸、来源于L‑色氨酸的紫杆菌素、白藜芦醇和脱氧紫芥子苷。其中,2‑苯乙醇、紫杆菌素和脱氧紫芥子苷是酵母中从头合成的最高产量,分别达到(2426.22±48.33)mg/L、(366.30±28.99)mg/L 和(55.12±2.81)mg/L[210]。这些结果表明解脂耶氏酵母是生产各种氨基酸衍生物的极具潜力的宿主。最近,研究者使用GoldenGate 克隆工具包构建产紫杆菌素的解脂耶氏酵母文库,扩展解脂耶氏酵母合成天然产物的工具箱[211]。
犬尿酸是一种L‑色氨酸分解代谢的化合物,具有抗氧化和神经保护作用,这使其成为具有生物医学意义的重要代谢物。已有研究发现解脂耶氏酵母在优化的添加L‑色氨酸的培养基中,可生产犬尿酸,由此确认解脂耶氏酵母中存在犬尿酸的合成代谢路径[212]。随后,研究者通过在培养基中添加不同来源的蜂蜜作为碳源和能源提高犬尿酸的产量,结果表明,使用栗子蜂蜜时,培养液和酵母生物量中犬尿酸含量最高。尽管这一发现的实用性有待进一步研究,但本研究为在解脂耶氏酵母中合成犬尿酸提供了新的数据和资源[213]。此外,组氨酸、半胱氨酸和S‑腺苷甲硫氨酸衍生的麦角硫因是一种天然存在的抗氧化剂,在改善神经退行性疾病和心血管疾病方面有显著的作用,解脂耶氏酵母也是生产麦角硫因的有潜力的底盘细胞。来自丹麦的学者通过在解脂耶氏酵母中整合麦角硫因合成途径以及途径基因多拷贝,在1L 生物反应器中采用磷酸盐限制补料分批发酵,麦角硫因的产量达到1.63 g/L[214]。
5 总结与展望
解脂耶氏酵母因具有独特的生理生化特征,在多种化合物的生物合成方面展现了独特的优势。合成生物学工具的开发,极大地促进了解脂耶氏酵母底盘细胞工程改造与应用的快速发展。随着合成生物学的快速发展,针对解脂耶氏酵母的新调控元件逐渐被开发出来,如新的启动子、终止子元件、新的筛选标记等,这使得其合成生物学工具箱得以进一步完善,并用于改造解脂耶氏酵母底盘细胞,使其能够更高效地合成各种化学品、燃料和天然产物(表3)。近年来,CRISPR/Cas 基因编辑技术在解脂耶氏酵母中建立并不断完善,已得到了初步的应用,显著提升了基因操作的效率,为解脂耶氏酵母底盘细胞的进一步升级改造奠定了基础。
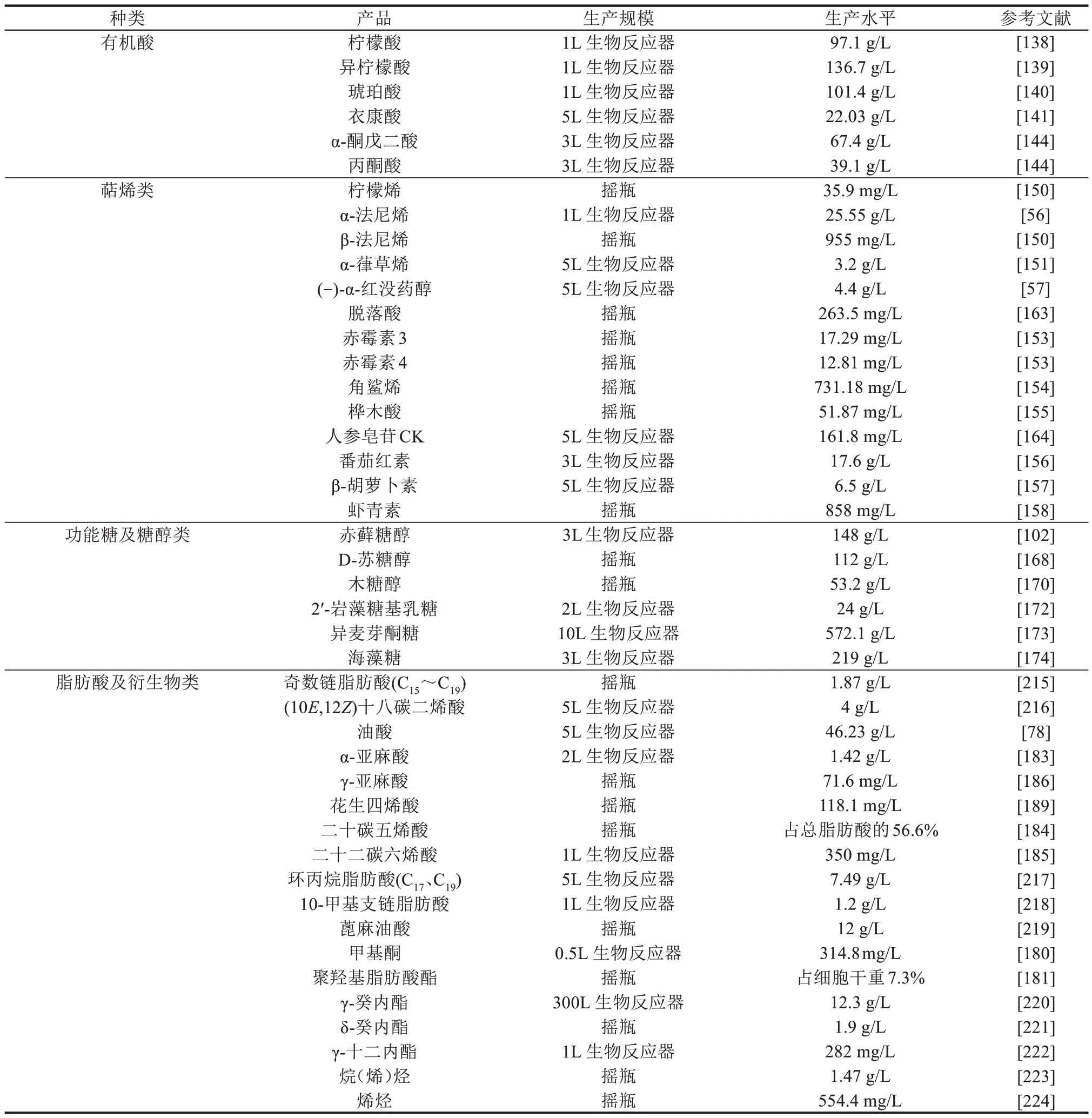
表3 解脂耶氏酵母底盘细胞的应用实例Table 3 Representative application examples of engineered Y. lipolytica chassis cell
然而,与传统模式微生物(如大肠杆菌、酿酒酵母等)相比,解脂耶氏酵母底盘细胞的遗传改造仍然存在工具少、效率低、操作烦琐等问题,在底盘系统化改造、复杂途径组装优化等方面存在较大的挑战。依然需要进一步挖掘新的合成生物学元件,如新的启动子和终止子元件,前期研究工作中虽然已经开发了诸多高效野生型和杂交型启动子,但与模式微生物酿酒酵母相比依然很少,未来工作可集中于构建序列更短、功能更强、转录活性范围更广的启动子,并挖掘更多的可诱导启动子以控制基因表达进行开关操作,同时探究解脂耶氏酵母中启动子和终止子工程的联合开发与应用;在此基础上构建适用于解脂耶氏酵母底盘细胞的稳定性外源高效表达载体,用于快速和高效的基因工程操作。在复杂途径组装与优化方面,可进一步提高外源基因的转化效率,建立高效的DNA 组装方法,全面实施和利用CRISPR/Cas 基因编辑技术,在此基础上开发基因表达的精细调控策略。此外,针对异源蛋白在解脂耶氏酵母中表达活性偏低、内源途径和异源途径难以适配的问题,未来可利用细胞器工程、辅因子工程以及转运体工程等手段,克服诸如前体供应、通量平衡、产物抑制等限制性因素,进一步促进解脂耶氏酵母底盘细胞的升级改造与应用。
为了充分利用并挖掘解脂耶氏酵母底盘细胞的潜能,未来的研究重点还应该包括两个方面:一是进一步完善该酵母的合成生物学工具箱,提高其遗传改造效率,具体包括在鉴定新的合成元件的基础上,开发新的方法实现基因表达的精细调控,进一步提高CRISPR/Cas 的编辑效率实现对该酵母的基因组精确快捷的编辑,进一步完善DNA 组装的效率以快速验证外源途径的有效性;二是有效地进行合成生物学与系统生物学等学科的交叉,包括采用自上而下(高通量组学分析)和自下而上(数学建模方法)的系统生物学工具来确定解脂耶氏酵母底盘细胞高产目标化合物的潜在遗传改造靶标,进一步在上述完善的解脂耶氏酵母的合成进生物学工具箱基础上,基于系统生物学方法鉴定的遗传靶标,对目标基因靶标进行微调或干扰,最终实现解脂耶氏酵母底盘细胞的升级改造与应用。