整合关联分析和共表达网络分析挖掘甘蓝型油菜籽粒质量候选基因
陈元军, 马娟娟, 史 睿, 李伟龙, 王 婷, 彭 琦, 张 维, 陈 锋, 王晓东, 高建芹, 付三雄, 张洁夫, 孙程明, 季彪俊, 胡茂龙,3,4
(1.福建农林大学农学院,福建 福州 350002; 2.江苏省农业科学院经济作物研究所/农业农村部长江下游棉花与油菜重点实验室/江苏省农业生物学重点实验室/江苏省现代作物生产协同创新中心,江苏 南京 210014; 3.南京农业大学作物遗传与种质创新国家重点实验室,江苏 南京 210095; 4.江苏大学生命科学研究院,江苏 镇江 212023)
甘蓝型油菜(BrassicanapusL.)是中国主要的食用油来源之一,种植面积约7.0×106hm2,所产植物油量约占国产植物油总量的55%。但中国菜籽油产量已连续十年低于消费量,2020年,菜籽油产量为6.36×106t,消费量为8.25×106t,缺口达1.89×106t,这对中国粮食安全构成了重大威胁[1]。因此,油菜产量的提高成为当今油菜育种工作中最为关键的目标。籽粒质量是油菜产量性状的重要组成部分,相较于角果长、每角粒数等其他产量性状具有更高的遗传力[2]。研究结果表明,籽粒质量改良是近年来油菜产量提升的重要原因[3]。因此,解析籽粒质量遗传基础、挖掘有利基因可以提高油菜产量、保障中国油料供给安全。
甘蓝型油菜是双子叶植物,油菜种子由胚、胚乳和种皮等部分组成,分别由受精卵、受精中央细胞和珠被组织发育而成。基因型通过调控胚乳发育决定种子大小,珠被组织决定了种子发育的空间,受精卵发育成胚,三者结合,共同决定了种子的质量和大小[4]。目前种子发育大小的主要形成机制分为2类,一类是种子早期发育阶段胚乳增殖形成的空腔大小决定了种子体积,随后胚乳细胞分裂促进种子质量增加;另一类是种皮和角果皮等母体组织调控种子发育,种子在发育过程中依赖母体的光合作用提供的养分[5]。目前,一系列基因已被报道调控种子发育,如IKU1通过调控胚乳生长影响种子籽粒质量[6];STK通过控制种皮的结构和机械性能调节细胞分裂素水平来控制果实大小[7];GW5通过泛素蛋白酶体途径调节种子细胞分裂,控制种子粒宽和籽粒质量等[8]。
甘蓝型油菜籽粒质量是由多基因控制的数量性状,受基因型和环境共同作用[9]。王瑞等[10]利用7个黄籽油菜品系配制完全双列杂交组合,利用ADM(加性-显性-母体遗传效应)遗传模型分析产量性状,结果表明,千粒质量的遗传主要由基因的加性和显性效应联合决定,而母体效应比重小,同时环境对各性状的遗传均有一定影响。崔嘉成等[11]利用11个甘蓝型油菜亲本杂交得到30个组合,对各组合及亲本角果性状的遗传模型的分析结果表明,基因的加性效应控制千粒质量的遗传,无显性效应。戚存扣等[12]对2个遗传差异大的亲本构建的世代家系群体的分析结果表明,该组合千粒质量主要受主基因的加性效应和多基因的加性和显性效应共同决定。李娜[13]的研究结果表明,油菜籽粒质量主要受母体基因型调控,籽粒质量的自然变异由细胞数目的变异决定,而非由种子密度决定。尽管油菜籽粒质量的遗传基础十分复杂,但前人研究形成的共识是籽粒质量遗传力较高,籽粒质量主要受到基因间加性效应的影响,显性效应影响较小,杂种优势不强。因此,可以通过聚合不同种质中的有利基因来增加油菜籽粒质量。
全基因组关联分析(Genome-wide association study,GWAS)是一种以位点间连锁不平衡为基础,用统计学分析检测遗传多态性与目标性状间关联的分析方法[14]。如今GWAS已被广泛应用于解析油菜的重要产量性状。Lu等[15]对520份甘蓝型油菜种质资源的7个产量性状进行关联分析,共检测到128个显著位点,其中93个为新检测到的位点,结合4个产量差异极端材料的转录组数据,确定14个候选基因。Dong等[16]对157份甘蓝型油菜的籽粒质量进行关联分析,检测到20个籽粒质量显著位点,在A09染色体显著位点附近找到油菜籽粒质量和角果长已克隆基因BnaA.ARF18.a。Khan等[17]对521份甘蓝型油菜品种的胚珠数、每角粒数和籽粒质量性状进行关联分析,利用多位点和单位点模型分别检测到280个和31个显著单核苷酸多态性(SNP),并挖掘出42个产量性状候选基因。林升丽[18]通过重测序对505份油菜种质资源进行基因分型,对关联群体7个环境的籽粒质量表型进行关联分析,检测到127个显著位点,找到BnaA07.KCR、BnaA07.EXPA1和BnaA10.GIF2等多个候选基因。
加权基因共表达网络分析(Weighted gene co-expression network analysis,WGCNA)是利用大量表达谱数据对表达模式类似的基因进行聚类,挖掘与性状关联基因模块的分析方法。WGCNA目前已被广泛应用于油菜重要性状的候选基因挖掘。Ma等[19]基于油菜感染黑胫病病菌的转录组数据,对检测到的1 892个差异剪接基因进行WGCNA,检测到8个共表达基因模块,并挖掘出属于WRKY、AP2、HMG和C2H2等转录因子家族的枢纽基因。同时,越来越多的研究将GWAS与WGCNA相结合,找到一系列调控目标性状的候选基因。鲜小华等[20]利用GWAS挖掘出1 826个黄籽名义候选基因,利用WGCNA找到2个黄籽相关基因模块,挖掘到BnF3H、BnANS等多个候选基因。刘景森[21]利用GWAS检测到14个生物产量显著位点,利用叶片、种子和茎秆等组织的转录组数据构建油菜生物产量共表达网络,鉴定到BnA04g06420D、BnA09g35380、BnC03g73810D和BnC08g48810D等多个生物产量候选基因。田贵福等[22]整合了油菜籽粒质量的GWAS和QTL定位结果,利用71份油菜的角果转录组数据构建了共表达网络,挖掘出枢纽基因BnSWH1并验证了其对种子籽粒质量的负调控作用。本研究采用整合GWAS和WGCNA的策略,挖掘控制籽粒质量的候选基因,为今后籽粒质量相关的基因克隆和调控机制研究提供参考。
1 材料与方法
1.1 材料与数据来源
本研究的关联群体包含496份国内外的地方品种、育成品种及高世代育种材料,其中有444份材料来源于国内油菜主产区,包括江苏、湖北、湖南和四川等,国外材料来自德国、瑞典和加拿大等国家。试验材料于2014年种植于江苏南京(记作14NJ),2015年、2016年种植于江苏泰州(记作15TZ、16TZ)。在前期研究中,我们已利用MLM(混合线性模型)和GLM(一般线性模型)对该群体进行籽粒质量关联分析,本研究所使用的基因型和表型源于前期发表的论文[23]。
本研究中用于WGCNA的转录组数据集来自国家基因组科学数据中心(National Genomics Data Center,NGDC)的生物项目数据库BioProject(ID:PRJCA001246),包含大粒品种中双11和中小粒品种中油821开花后第7 d、第10 d、第14 d、第45 d的种子和开花后第7 d、第10 d、第14 d的角果皮共计28份转录组数据。
1.2 全基因组关联分析
本研究利用A-D Test模型对籽粒质量基因型和表型进行关联分析,显著性阈值(P)计算方法为0.01/总标记数,取对数为-lgP=6.28。若1 Mb区间内存在较多的显著SNP,把两两间决定系数(R2)≥0.1的SNP视为1个关联位点,选取其中P值最小的为代表,利用qqman包绘制QQ图(Quantile-quantile plot)和曼哈顿图(Manhattan plot)[24]。
1.3 权重基因共表达网络分析
利用WGCNA包构建基因共表达网络[25],过滤变异系数(CV)<0.4、表达量(TPM)≤1和缺失样本比例超过10%的基因,根据基因间的表达量数据对样品进行层次聚类分析,采取逐步法聚类表达模式相近的基因,绘制出聚类树和每个样品的表达图。为了使结果符合无尺度网络分布[26],选取拟合曲线R2接近0.9时的权重参数β,power值为10。利用动态剪枝法识别共表达模块,计算每个模块的特征向量,合并距离较近的模块并选择相关系数绝对值大于0.75的模块作为研究的目标模块。使用omicshare在线分析平台(https://www.omicshare.com/tools/)对目标模块进行GO富集,对富集结果进行柱状图、气泡图和圈图等图表的绘制和展示。将|模块身份(Module membership,KME)|≥0.90的基因定义为枢纽基因,利用Cytoscape软件对籽粒质量相关模块进行网络可视化展示[27]。
1.4 候选基因挖掘
以R2=0.2时的连锁不平衡(Linkage disequilibrium,LD)衰减距离作为GWAS显著位点的置信区间,提取区间内的基因编码序列(CDS),与模式植物拟南芥的基因CDS进行BLAST比对(E-value≤1×10-10),用相似比最大的拟南芥基因来标注油菜基因。同理,注释WGCNA中籽粒质量相关模块的基因。最终,将2个分析中找到的油菜籽粒质量已知基因和拟南芥籽粒质量已知基因的同源基因作为候选基因[28]。
2 结果与分析
2.1 全基因组关联分析
利用A-D Test模型对籽粒质量最佳线性无偏预测值(BLUP)进行关联分析,设置显著性阈值为-lgP=6.28,共检测到37个显著SNP;合并存在连锁不平衡的 SNP(R2≥0.1),得到19个显著SNP,分布在A01、A02、A06~A09、C02、C03、C05、C06、C09等11条染色体上(图1、表1)。利用一般线性模型计算, 19个位点联合解释34.1%的表型变异。显著性最高位点Bn-scaff_17526_1-p1066214位于C09染色体1.49 Mb处,-lgP=13.06(表2);显著性次高位点Bn-scaff_16804_1-p203519位于C02染色体6.98 Mb处,-lgP=11.24;其余位点的-lgP值范围为6.47~9.67。与单个环境的试验结果相比,14个位点在至少2个环境中被重复检测到,其中,显著性排名前4的位点Bn-scaff_17526_1-p1066214、Bn-scaff_16804_1-p203519、Bn-scaff_17119_1-p148890和Bn-A08-p20343735在3个环境(14NJ、15TZ及16TZ)中均被重复检测到,证实了本研究结果的可重复性和可靠性(表2)。

表1 籽粒质量显著关联位点
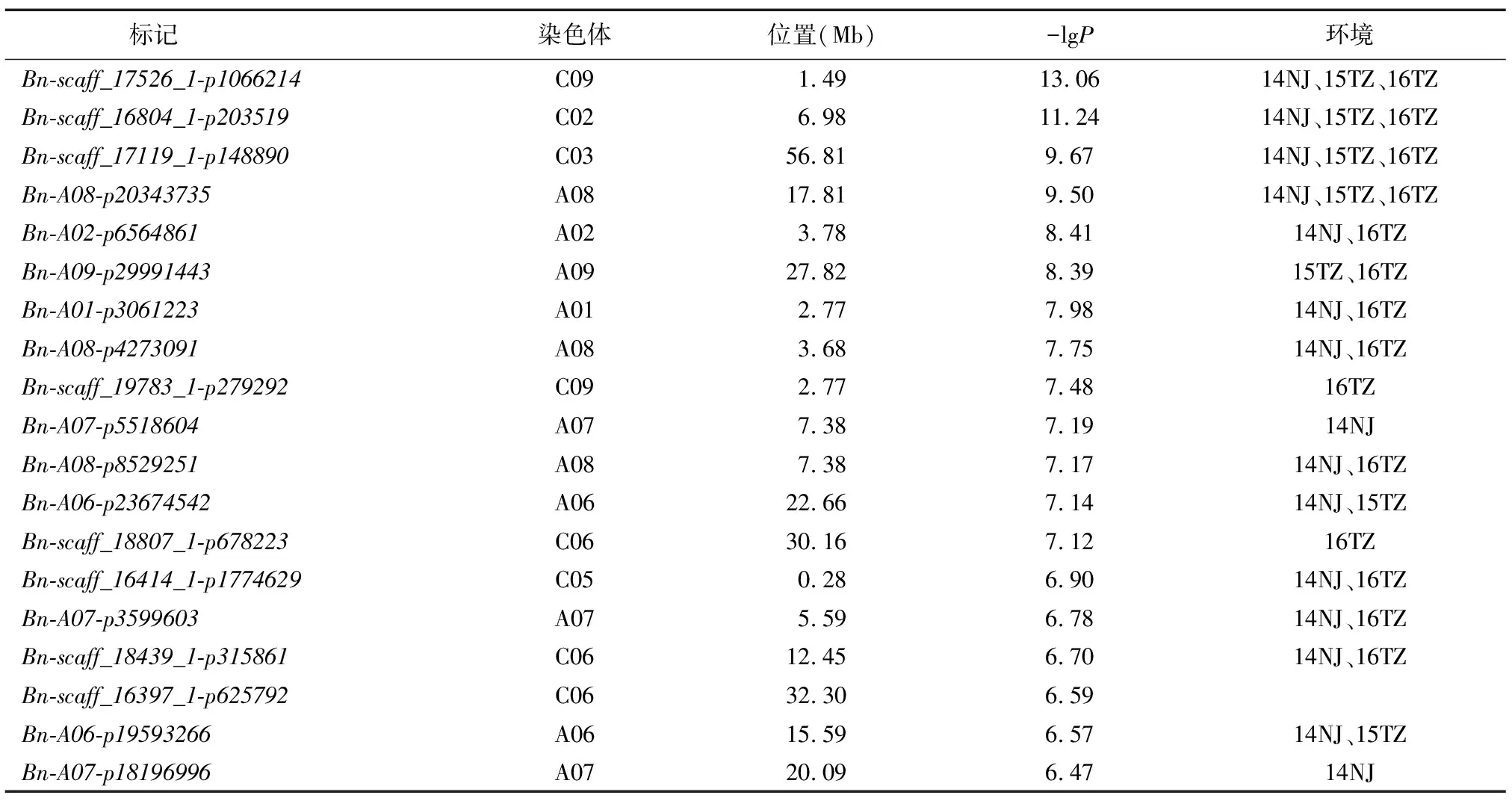
表2 各环境下A-D Test模型关联位点

A:籽粒质量A-D Test曼哈顿图;B:籽粒质量A-D Test QQ图。a:A01;b:A02;c:A03;d:A04;e:A05;f:A06;g:A07;h:A08;i:A09;j:A10;k:C01;l:C02;m:C03;n:C04;o:C05;p:C06;q:C07。图1 油菜籽粒质量A-D Test全基因组关联分析Fig.1 Genome-wide association study of seed weight in rapeseed by A-D Test model
比较前人GLM和MLM模型结果,8个位点与GLM重叠,2个位点与MLM重叠(表1)。位点Bn-scaff_17526_1-p1066214和Bn-A02-p6564861在3个模型中都被重复检测到。不仅如此,A-D test还找到11个新位点,Bn-scaff_16804_1-p203519分布在C02染色体6.98 Mb处,-lgP=11.24,在3个环境中都被检测到。Bn-A09-p29991443位于A09染色体27.82 Mb处,-lgP=8.39,在2个环境(15TZ、16TZ)中都被检测到。位点Bn-A01-p3061223和位点Bn-A08-p4273091均在14NJ和16TZ中被检测到,-lgP值分别为7.98和7.75,此外还有7个新位点位于各染色体上,分别在1~2个环境中被检测到。合并3个模型的结果,得到71个显著位点,11个分布在A07染色体上,9个分布在C06染色体上,8个分布在A03染色体上,其余染色体上分布1~7个位点。分析显著位点的分布,57.7%的位点分布在A亚基因组,42.3%的位点分布在C亚基因组。利用一般线性模型计算,发现71个位点联合解释50.1%的表型变异。
2.2 加权基因共表达网络分析
大粒品种中双11的千粒质量约为4.6 g,中小粒品种中油821的千粒质量约为3.4 g。本研究下载了两者开花后第7 d、10 d、14 d、45 d的种子和开花后第7 d、10 d、14 d的角果皮转录组数据,利用R软件中WGCNA包对28份转录组数据的100 919个基因进行分析,过滤低表达(TPM≤1)和变异系数较低(CV<0.4)的基因后,保留了35 540个基因。通过层次聚类绘制样本树并构建无尺度网络(图2A、图2B),采取逐步法聚类表达模式相近的基因(图2C),最终得到13个共表达模块。不同模块间包含的基因数目差别大,turquoise模块含有数量最多的基因,包含7 176个基因;salmon模块包含基因数目最少,仅包含108个基因;其余模块内基因数目范围为185~6 189。根据模块间相关性绘制相关性热图,purple与green,purple与pink,magenta与yellow,magenta与black等模块间相关性较高(图2D)。
2.3 筛选目标模块及GO富集分析
计算模块特征向量与籽粒质量表型的相关系数,结果显示,模块系数绝对值范围为0.004 9~0.820 0,以0.75为阈值,得到2个籽粒质量关联模块,其中purple模块系数最高(|r|>0.80,P<4×10-7),magenta模块次之(|r|>0.76,P<2×10-6)(图3A)。

A:模块与籽粒质量性状关联热图;B:purple模块表达值热图与特征值条形图;C:magenta模块表达值热图与特征值条形图。图3 基因共表达模块分析Fig.3 Gene co-expression module analysis
purple模块包含1 109个基因,分布在19条染色体上,各染色体基因数目为25~92。比较2个品种,purple模块基因在大粒品种中双11种子和角果皮中表达量较低,在中小粒品种中油821中表达量较高(图3B)。对模块基因进行GO富集分析,共富集到108个显著GO 途径(图4A),包括苯丙氨酸氨基转移酶活性、天冬氨酸转氨酶活性、2-酮戊二酸转氨酶活性、硫双加氧酶活性和肉桂酸生物合成等(图4B)。这些分子功能在控制种子的生长发育中有重要作用,如苯丙氨酸参与幼苗早期细胞分裂生长和种子发育等重要过程[29];天冬氨酸转氨酶(AAT)是合成氨基酸的一种关键酶,Zhou等[30]研究发现天冬氨酸转氨酶在水稻中过表达影响种子的氮代谢和氨基酸含量;硫双加氧酶是拟南芥基因ETHE1编码的一种对种子胚胎和胚乳发育至关重要的酶类[31];Baleroni等[32]研究发现肉桂酸衍生物对甘蓝型油菜种子子叶的脂肪酸和总脂质积累有积极作用。

A:紫色(purple)模块GO富集圈图;B:purple模块GO富集分析中生物过程分类前20个GO富集途径;C:洋红色(magenta)模块GO富集气泡图。D:magenta模块前20个GO富集途径。Z值表示某个基因集合在特定生物过程或功能方面的显著性程度。图4 目标模块GO富集分析Fig.4 Target module GO enrichment analysis
magenta模块含有1 114个基因,分布在19条染色体上,各染色体基因数目为23~127。与purple模块相反,magenta模块基因在大粒品种中双11中表达丰度显著高于中油821(图3C)。对模块基因进行GO富集分析,共富集到521个显著GO term。图4C和图4D展示的是magenta模块中生物学过程、分子功能和细胞组分三大类TOP 20 GO通路气泡图,其中核酸代谢过程、杂环代谢过程、细胞氮化合物代谢过程、细胞芳香族化合物代谢过程等代谢通路被显著富集。这些通路的基因参与了种子的发育过程,如在模式植物拟南芥中,焦磷酸酶的表达促进种子中蛋白质和油类物质的合成,UPF1RNA解旋酶参与调控种子大小[33-34]。
2.4 挖掘关联分析候选基因
基于中双11基因组注释信息,在Bn-A09-p29991443位点下游0.17 Mb和0.18 Mb处分别找到油菜角果长和籽粒质量已知基因ARF18和CYP78A9。ARF18编码1个生长素响应因子,CYP78A9编码1个细胞色素P450单加氧酶,两者均通过促进油菜角果伸长进而影响籽粒质量[35-36]。
根据Darmor基因组的注释信息,在Bn-A02-p6564861位点上游约0.100 Mb处找到候选基因BnaA02g07770D,其拟南芥同源基因AT5G58230(MSI1)为拟南芥的母性效应胚胎滞育基因,在植物胚乳和胚胎发生过程中起作用,直接影响后期种子的生长发育,从而导致籽粒质量改变[37]。在位点Bn-A06-p19593266上游约0.695 Mb处找到候选基因BnaA06g21460D,其拟南芥同源基因AT5G62000(ARF2)通过限制种皮细胞增殖影响籽粒大小[38]。在Bn-A01-p15496639位点上游0.635 Mb处找到候选基因BnaA01g20420D,其拟南芥同源基因AT3G48610编码1个非特异性磷脂酶NPC6,过表达NPC6能显著提高亚麻荠的籽粒质量、含油量和单株产量[39]。在Bn-A03-p8851142位点上游0.122 Mb处找到候选基因BnaA03g17130D,其拟南芥同源基因AT2G37260(TTG2)编码的WRKY转录因子表达于种皮中,通过增加种皮的细胞延伸从而促进种子的生长发育[40]。在Bn-A07-p11611255位点上游0.115 Mb处找到候选基因BnaA07g16350D,其拟南芥同源基因AT3G54320(WRI1)编码1个AP2/ERWEBP类转录因子,通过增大种子体积和参与贮藏化合物的生物合成以增加种子质量[41]。此外,还找到其他16个候选基因,包括拟南芥中已知籽粒质量调控基因CLV3、AHK4、FIS1、GLN1;1、TCTP1、FER、CKX1、EOD1、AHK2等在油菜中的同源拷贝(表3)。
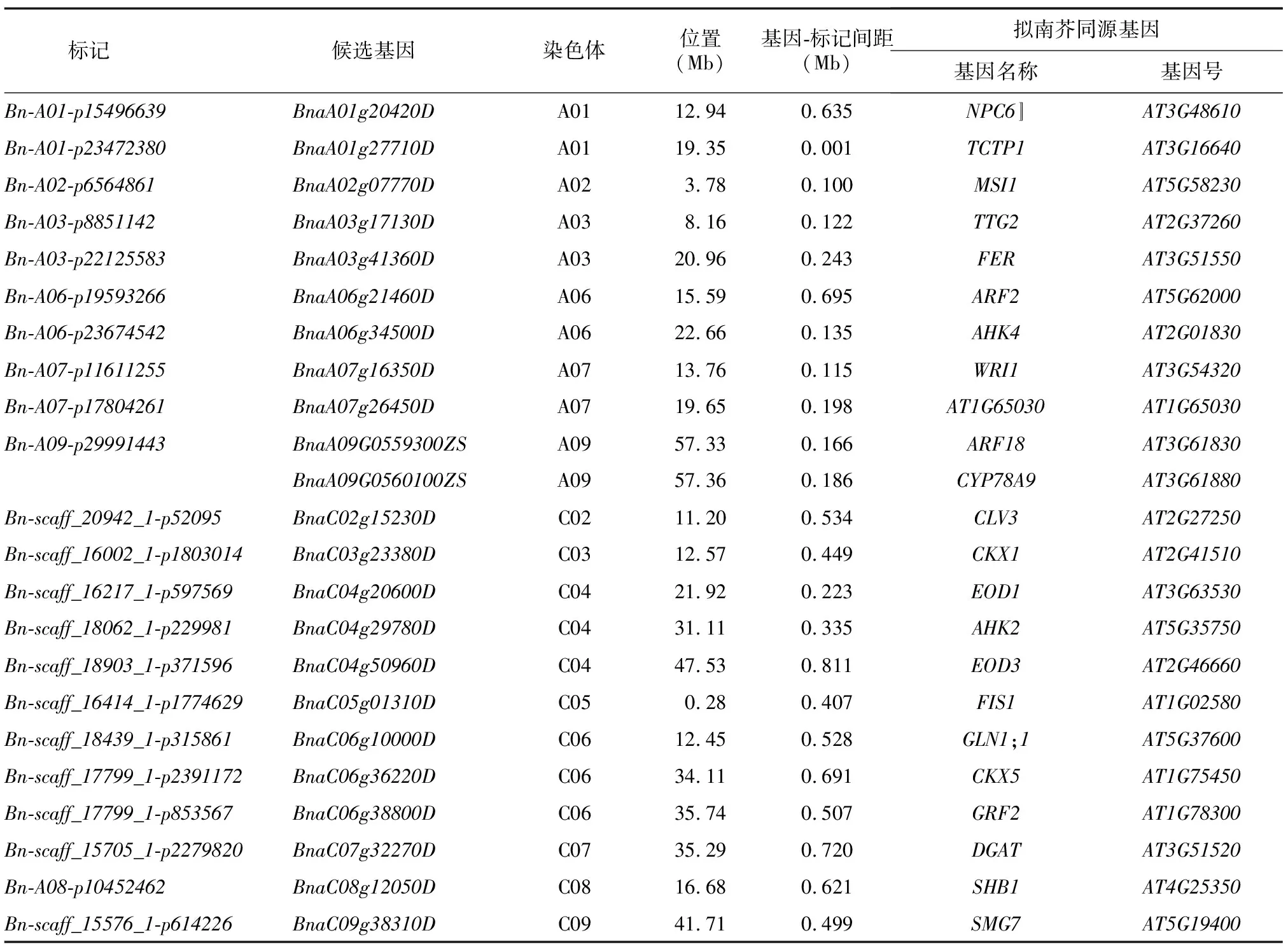
表3 籽粒质量候选基因信息
2.5 挖掘WGCNA籽粒质量候选基因
利用软件Cytoscape对purple和magenta模块中的基因网络进行可视化表达(图5)。在purple模块中,根据|KME|≥0.90的标准筛选出340个枢纽基因。枢纽基因BnaA06g00850D(KME=0.97)的拟南芥同源基因AT1G53580(ETHE1)编码1个硫双加氧酶,调节种子中的硫化物水平,在种子胚胎和胚乳发育过程中发挥重要作用[31]。 枢纽基因BnaA01g00990D(KME=0.92)的拟南芥同源基因为籽粒质量已知基因AT4G36860(DAR1)(表4),DAR1属于泛素结合蛋白家族,通过限制珠被的细胞增殖从而控制种子大小和籽粒质量[42]。枢纽基因BnaC06g10000D(KME=0.91)的拟南芥同源基因AT5G37600(GLN1;1)编码1种胞质谷氨酰胺合成酶,在种子萌发和灌浆过程中起到决定作用,影响种子胚乳的发育从而控制籽粒质量[43]。此外,purple模块还包含拟南芥籽粒质量已知基因TTN5和SKP1等在油菜中的同源拷贝。基因表达量热图(图6)显示,这些基因在中双11中表达量很低,而在中油821中表达量较高,特别是在开花后第7 d、10 d和14 d的籽粒和角果皮中,但在成熟的籽粒中表达量显著降低,表明它们在籽粒前期发育中发挥作用。

表4 Purple和magenta模块包含的籽粒质量已知基因

A:purple模块内基因共表达网络;B:magenta模块内基因共表达网络。图5 Purple和magenta模块的基因共表达网络Fig.5 Gene co-expression network of purple and magenta modules
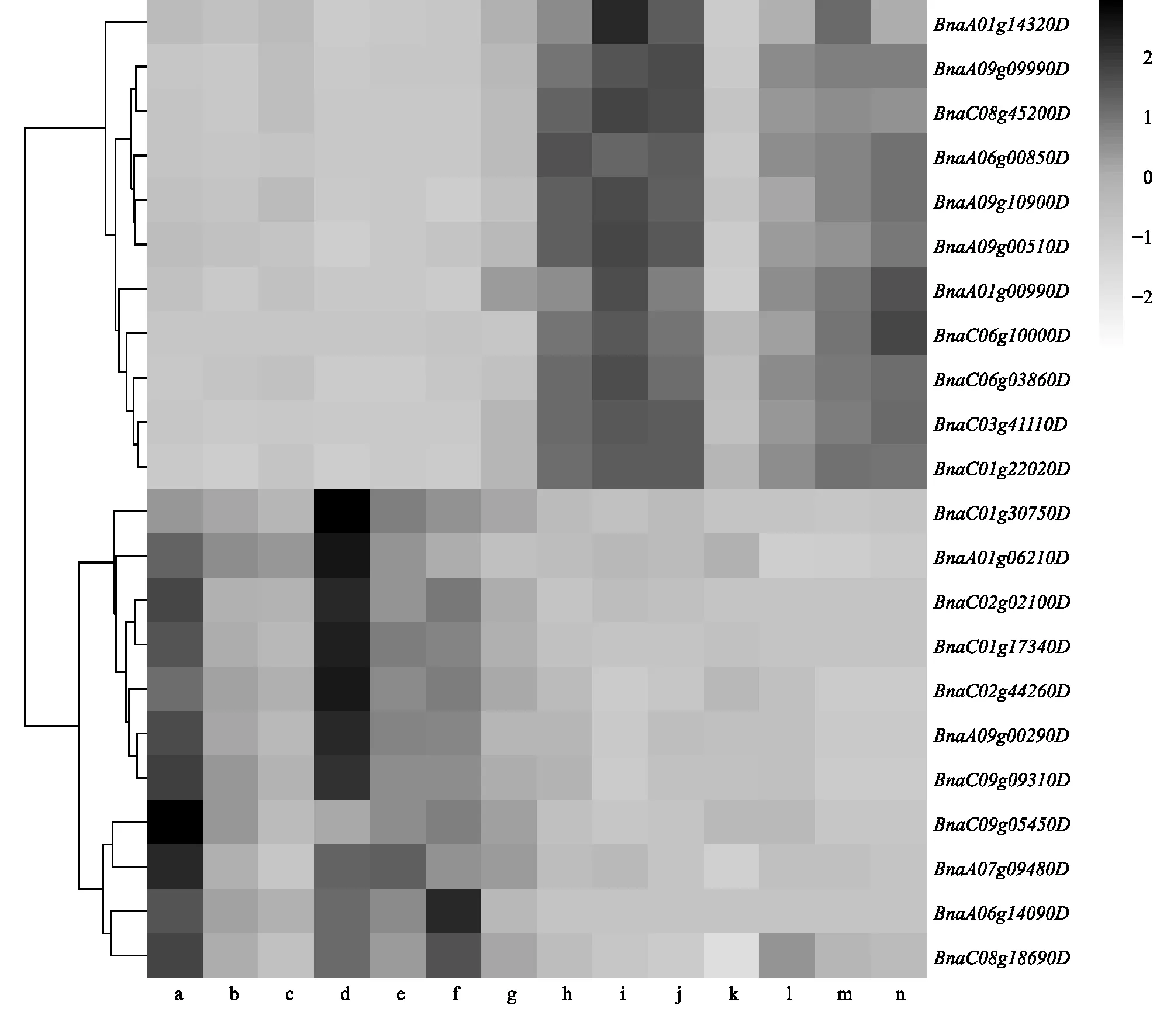
a:中油821_角果皮_14 d;b:中油821_角果皮_10 d;c:中油821_角果皮_7 d;d:中油821_种子_45 d;e:中油821_种子_14 d;f:中油821_角果皮_10 d;g:中油821_种子_7 d;h:中双11_角果皮_14 d;i:中双11_角果皮_10 d;j:中双11_角果皮_7 d;k:中双11_种子_45 d;l:中双11_种子_14 d;m:中双11_种子_10 d;n:中双11_种子_7 d。图6 Purple和magenta模块内的基因表达量热图Fig.6 Heatmap of gene expression in purple and magenta modules
在magenta模块中,根据|KME|≥0.90的标准共筛选到149个模块枢纽基因,其中枢纽基因BnaC02g44260D(KME=0.96)的拟南芥同源基因为籽粒质量已知基因AT5G19400(SMG7)(表4),编码减数分裂所必需的蛋白质SMG7,SMG7的缺失会引起染色体去密集化和减数分裂纺锤体的异常重排,从而导致胚死亡,影响籽粒发育[44],BnaC02g44260D在C09染色体的同源基因BnaC9.SMG7b也已被报道影响油菜每角粒数、籽粒质量等性状[45]。模块基因BnaC08g18690D的拟南芥同源基因为籽粒质量已知基因AT1G19270(DA1),编码1个泛素受体,在调节胚乳种皮细胞再复制中发挥作用。在甘蓝型油菜中降低DA1的表达量可以提高种子产量和生物量[46]。模块基因BnaA06g14090D、BnaA05g14370D和BnaC09g05450D共同对应的拟南芥同源基因为AT5G62000(ARF2),通过限制种皮细胞增殖而影响籽粒大小[38]。此外,magenta模块还包含拟南芥籽粒质量已知基因GLN1;2、RPT2A和BRM等在油菜中的同源拷贝。基因表达量热图(图6)显示,这些基因在中油821中表达量很低,而在中双11中表达量较高。在角果皮中,它们的表达量随着籽粒发育进程逐渐降低。在籽粒中,这些基因在开花后第7 d和45 d表达量较高,而在第10 d和14 d表达量显著降低,这表明它们在籽粒的发育早期和末期发挥作用。
2.6 整合2种分析方法挖掘候选基因
整合GWAS和WGCNA 2种分析方法进行分析,结果表明,在42个显著关联位点的LD置信区间内找到90个与籽粒质量相关的模块基因,其中49个属于magenta模块,41个属于purple模块(表5)。对比它们的拟南芥同源基因功能注释,发现部分基因在种子的各项发育过程中起着决定性作用。在A01染色体位点Bn-A01-p3061223下游0.120 Mb处找到magenta模块基因BnaA01g06210D,其拟南芥同源基因AT4G30930(NFD1)编码1个定位在线粒体的核糖体蛋白质,基因突变后影响雌雄配子的发育[47]。在A07染色体位点Bn-A02-p305007下游0.170 Mb处找到magenta模块基因BnaA07g14990D,其拟南芥同源基因AT5G40480(EMB3012)与胚发育缺陷相关,基因在种子和胚中表达量较高[48]。在A07染色体位点Bn-A10-p11601681下游0.06 Mb处找到purple模块基因BnaA07g03030D,其拟南芥同源基因AT2G17800(ROP3)编码1个GTP结合蛋白质,参与生长素激活的Aux/IAA蛋白质水解途径,基因功能突变后导致胚发育异常[49]。在C03染色体位点Bn-scaff_26320_1-p269450下游0.14 Mb处找到magenta模块基因BnaC03g46120D,其拟南芥同源基因AT3G01610(CDC48C)参与细胞分裂循环,与胚发育缺陷有关[50]。

表5 显著关联位点置信区间内的magenta和purple模块基因
3 讨 论
A-D test是一种非参数统计模型,利用中值替换均值,解决了关联分析中基因型分布不均匀造成的偏差,提高了检测精度[51]。相较于其他模型,A-D test模型对于效应小、数据非正态分布的基因尤其有效。本研究对A-D Test设置了严格的显著性阈值(阈值=0.01/总标记数),检测到19个显著位点,其中14个位点在至少2个环境中被重复检测到,4个位点在3个环境中均被重复检测到。与另外2个模型的结果比较,8个位点与GLM重叠,2个位点与MLM重叠。同时,本研究在6个A-D test显著位点置信区间内找到ARF18、AHK4、FIS1、GLN1;1和ARF2等拟南芥已知籽粒质量基因的同源基因。这些结果证实了A-D test模型的准确性和可靠性。合并3个模型结果共得到71个显著位点,挖掘出ARF2、NPC6、TTG2、WRI1和CLV3等23个拟南芥已知籽粒质量基因的同源基因。同时,Bn-A06-p23674542(-lgP=5.97~7.14)等位点在多个环境和多个模型中被检测到,但置信区间内尚未找到籽粒质量已知基因,后续可作为研究重点进行深入探究。
随着测序技术的发展,利用共表达网络对转录组进行系统研究,是目前比较流行的分析方法。WGCNA能够聚类表达模式相似的基因,构建与目标性状关联、具有生物学意义的共表达模块,进而挖掘共表达网络中的关键基因。在本研究中,我们利用大粒品种中双11和中小粒品种中油821的28份转录组数据进行WGCNA,挖掘到purple和magenta 2个模块与籽粒质量表型显著相关。2个模块基因显著富集条目包括苯丙氨酸氨基转移酶活性、硫双加氧酶活性、肉桂酸生物合成和焦磷酸酶活性等,这些酶活性在种子生长发育过程中都起到重要作用。2个模块的枢纽基因如BnaA06g00850D、BnaA01g00990D、BnaA07g36220D和BnaC06g10000D等拟南芥同源基因ETHE1、DAR1、TTN5和GLN1;1等已被报道参与籽粒质量调控,magenta模块枢纽基因BnaC02g44260D是油菜已克隆每角粒数、籽粒质量调控基因BnaC9.SMG7b在C02染色体的同源拷贝。这些结果证实了通过WGCNA挖掘油菜籽粒质量性状调控基因的可行性和可靠性。
GWAS分析的难点之一是在显著位点置信区间内高效鉴定候选基因,而WGCNA能够特异地筛选出与目标性状关联的差异表达基因,2种分析方法具有很好的互补性。Farber[52]首次结合GWAS和WGCNA挖掘调控骨密度的相关基因,对关联候选基因构建共表达网络,挖掘到3个与性状显著相关的基因模块。在油菜的研究中,越来越多的研究者也采取相同策略,如王艳花等[53]结合GWAS和WGCNA 2种方法筛选出调控油菜生物产量的候选基因BnA07g19320D、BnC03g33610D和BnC03g73810D等,鲜小华等[20]结合GWAS和WGCNA 2种方法挖掘出甘蓝型油菜黄籽候选基因BnATCAD4、BnF3H和BnANS等。在本研究中,我们在42个显著位点的置信区间内找到90个属于2个目标模块(purple模块和magenta模块)的基因。尽管这些基因尚未被报道直接参与籽粒质量调控,但它们在大粒品种中双11和中小粒品种中油821的籽粒中表达丰度不同,部分基因如BnaA01g06210D、BnaA07g14990D、BnaA07g03030D等直接或间接调节种子、胚胎等相关发育进程,后续工作可以深入挖掘这些基因在籽粒质量调控中的具体功能。
4 结 论
本研究利用A-D Test模型对496份油菜的籽粒质量进行GWAS分析,共检测到19个显著位点。整合前期MLM和GLM模型结果后共得到71个位点,联合解释50.1%的表型变异。在21个关联位点置信区间内找到SMG7、ARF2、NPC6、TTG2、WRI1等油菜、拟南芥中已被报道的籽粒质量基因的同源基因。利用大粒品种中双11和中小粒品种中油821的28份转录组数据,构建了13个共表达模块,其中magenta和purple模块与籽粒质量表型相关性最高。在2个目标模块中挖掘出BnaA06g00850D、BnaA01g00990D、BnaC06g10000D、BnaC02g44260D和BnaC08g18690D等籽粒质量候选基因。整合GWAS和WGCNA的分析结果,在42个显著位点的置信区间内找到90个属于2个籽粒质量相关的模块基因,其中BnaA01g06210D、BnaA07g14990D和BnaA07g03030D等参与调控种子、胚胎等相关发育进程;同时,A-D Test挖掘的多个大效应位点如Bn-A06-p23674542等置信区间内尚未找到与籽粒质量相关的已知基因,值得后续深入挖掘。

