一株4 型副猪嗜血杆菌的分离鉴定与耐药性分析
栗卫东
(济源市农业综合行政执法支队,河南济源 459000)
副猪嗜血杆菌病是一种由巴氏杆菌科的副猪嗜血杆菌(Haemophilus parasuis,HPS)感染猪引起的以多发性纤维素性心包炎、脑膜炎、关节炎和浆膜炎为病理特征的细菌性传染病[1]。病猪多表现为发烧,呼吸困难,关节肿胀,皮肤及黏膜发绀,部分猪可见共济失调、转圈等神经症状。副猪嗜血杆菌病在世界各地的养猪场均有发生,我国猪群的病死率一般为30%~40%,严重时可达50%[2],断奶仔猪和保育猪多发,给养猪业造成严重经济损失。HPS 通常存在于猪的上呼吸道,为条件致病菌,健康猪并不发病,多在受到应激、感染免疫抑制性猪蓝耳病、猪伪狂犬病、猪瘟等多种疾病影响下,猪机体免疫力降低,继发HPS 病,加重猪的病情。HPS血清型较多,目前已发现15 个血清型,其他20%以上的分离株血清型未能定型[3]。国内流行较多血清型主要有4、5、13、14。同一地区甚至不同猪场流行菌株血清型存在差异,不同的血清型之间缺乏交叉保护率,目前国内使用的二价菌苗(4、5 血清型)无法对其他血清型起到有效免疫效果[4]。防治HPS 临床用药多使用抗生素,然而长期不合理地使用抗生素容易导致菌株耐药性增强,给养猪场治疗该病带来困难。此外,通过药敏试验可以监测HPS 对抗生素的耐药情况,为临床合理用药指明方向。本研究对河南省济源市某规模化养猪场疑似HPS 病猪进行实验室诊断,通过对分离菌株纯化培养、PCR 扩增和血清分型,鉴定分离菌株为4 型HPS,并对该菌株药敏性分析,旨在为副猪嗜血杆菌病防治提供精准的科学参考。
1 材料与方法
1.1 HPS 病料
采集河南省济源市某规模化猪场临床疑似HPS 病死猪的肺脏、心脏、关节液、胸腹腔液等组织样品。
1.2 HPS 标准菌株和标准阴、阳性血清
1~15 型HPS 标准菌株,1~15 型HPS 标准阴性血清和阳性血清,均来自河南农业大学动物医学院微生物实验室。
1.3 主要试剂和仪器
巧克力培养基、7%绵羊血琼脂培养基、胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆固体培养基(TSA)固体培养基等购自北京索莱宝科技有限公司;细菌微量生化鉴定管、24 种药敏纸片购自青岛海博生物技术有限公司;细菌DNA 基因抽提试剂盒购自南京诺唯赞生物科技有限公司;dNTP Mix、10×Buffer、Taq 酶、DL-2 000 Marker,购自生工生物工程(上海)股份有限公司;多功能梯度PCR 扩增仪由Thermo Fisher 公司生产。
1.4 细菌分离鉴定
1.4.1 细菌纯化培养与镜检
无菌采集病料接种于7%绵羊血琼脂培养基,置入恒温箱,37℃培养24 h,挑取单个菌落接种于巧克力培养基上,37℃恒温培养24 h,然后挑取单个菌落分别接种于巧克力培养基和TSA 固体培养基上,挑取菌落在TSB 培养基纯化生长,7℃恒温培养24 h 后,制作涂片,革兰氏染色,镜检。
1.4.2 生化鉴定
分离菌株生化试验鉴定,按照细菌微量生化鉴定管说明书操作,37℃培养24 h,观察各生化鉴定管结果。
1.4.3 PCR 鉴定
根据Oystein 等[5]、Howell 等[6]研究方法,针对HPS vanY 基因序列设计1 对用于扩增鉴定HPS 引物P1、P2,P1:5'-ACAACCTGCAAGTACTTATCGGGAT-3',P2:5'-TAGCCTCCTGTCTGATATTCCCACG-3',预期大小276 bp。引物由生工生物工程(上海)股份有限公司合成。分离菌株DNA 模板按照细菌DNA 基因抽提试剂盒说明书操作,无菌接种病料于TSB 培养基,37℃培养24 h,吸取培养菌液装入1.5 mL 离心管,加20 μL ddH2O,沸水浴10 min,-20℃冰浴10 min,12 000 rpm,离心10 min,取上清液作为分离菌株DNA基因组模板。扩增体系体积为25 μL:10×PBS 缓冲液2.5 μL,dNTPs 0.5 μL,DNA 模板1 μL,Taq 酶1 μL,10 μmol/L P1、P2 引物各1 μL,加入ddH2O 至25 μL。扩增程序:94℃5 min;94℃1 min,58℃1 min,72℃45 s,共35 个循环;72℃延伸10 min。取10 μL扩增产物用1.2%琼脂糖凝胶电泳检测,凝胶成像系统下观察结果。
1.5 血清型分型
1.5.1 琼脂扩散法分型
根据徐引弟等[7]的研究方法,将分离菌株接种于TSB 培养基,37℃培养36 h,挑取菌落加入装有pH 值为7.2、10 mL 缓冲液的灭菌管,8 000 rpm 离心3 min,弃去上清液,再加入体积为管内沉淀物9 倍的PBS,混匀,120℃高压2 h,取出后8 000 rpm 离心5 min,上清液即为用作琼脂扩散试验的分型抗原。将8.5 g 和1 g琼脂糖放入100 mL PBS 缓冲液,加热溶解,倒入平板,用打孔器在平板中央打1 个直径3 mm 的孔,周围打5个同样孔,孔间距4 mm,分型抗原加入中央孔,周围孔加入1~15 型HPS 标准阴性血清和阳性血清,放入塑料湿盒,37℃36 h,观察结果。
1.5.2 PCR 扩增分型
根据王同兆等[8]的试验方法,针对HPS wciP 基因序列设计1 对用于扩增鉴定4 型HPS 的特异性引物P3、P4,P3:5'-GGTTAAGAGGTAGAGCTAAGAATAGAG G3',P4:5'-CTTTCCACAACAGCTCTAGAAACC-3',预期大小349 bp。引物由生工生物工程(上海)股份有限公司合成。参照1.4.2 中的反应体系和反应条件,用引物P3 和P4 进行分离菌株PCR 扩增,扩增产物送生工生物工程(上海)股份有限公司测序,用BLAST 软件对测序结果与GenBank 中的参考菌株同源性比对分析。
1.6 药敏试验
挑取分离菌株HPS 放入灭菌生理盐水,涡旋振荡混匀,调整浓度至0.5 个麦氏比浊度。用棉拭子将菌悬液均匀涂布于TSA 培养基,自然晾干,药敏纸片平贴培养基上,37℃培养36 h,测量药物的抑菌圈直径大小。按照美国临床实验室标准化协会(CLSI M100—S25,2015 版)标准判耐药结果。
2 结果与分析
2.1 细菌纯化培养和镜检
在7%绵羊血培养基上可见边缘整齐、圆形、灰白色菌落;在TSA 培养基上可见光滑湿润、边缘整齐、灰白色的菌落,直径为1~2 mm;在巧克力培养基上可见表面隆起、圆形、光滑整齐、灰白半透明的菌落。镜检结果,菌体为细丝状、球状、短杆状等多种形态。
2.2 生化鉴定结果
分离菌株接触酶试验呈阳性,氧化酶、脲酶、吲哚、鸟氨酸脱氢酶均呈阴性,不分解甘露醇,能分解蔗糖、果糖、葡萄糖、麦芽糖、半乳糖和阿拉伯糖。生化特性符合副猪嗜血杆菌,初步鉴定分离菌株为副猪嗜血杆菌。
2.3 PCR 鉴定结果
细菌PCR 扩增获得1 条目的基因条带,长度为276 bp,符合预期大小,结果判定为副猪嗜血杆菌,见图1。
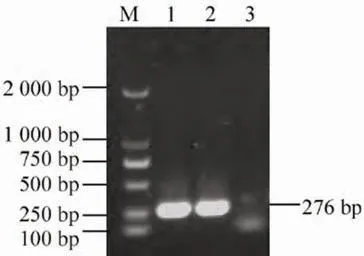
图1 分离菌PCR 鉴定结果
2.4 血清型分型
2.4.1 琼脂扩散法分型结果
中央孔内的分型抗原和4 型HPS 标准阳性血清之间有沉淀线出现,而其他型血清无沉淀线,证实分离菌株为4 型HPS。
2.4.2 PCR 血清型鉴定结果
用4 型HPS 特异性引物P3、P4 对分离菌的DNA进行PCR 扩增,获得1 条目的条带,长度为349 bp。对扩增结果进行测序,并应用BLAST 生物软件,与GenBank 中4 型HPS 参考菌株SW124(登录号:KC795356)基因序列同源性比对,同源性为100%,证实该分离菌株为4 型HPS。见图2。
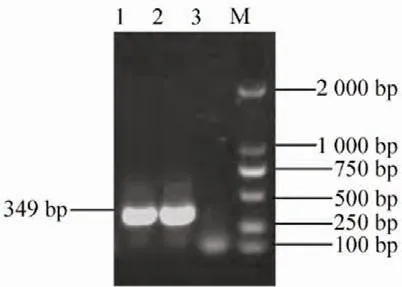
图2 分离菌PCR 分型鉴定结果
2.5 药敏试验结果
由表1 可知,分离的4 型副猪嗜血杆菌菌株对头孢曲松、头孢噻肟、氨苄西林、阿莫西林敏感;对环丙沙星、阿米卡星、链霉素、多西环素、卡那霉素、庆大霉素等产生耐药性。
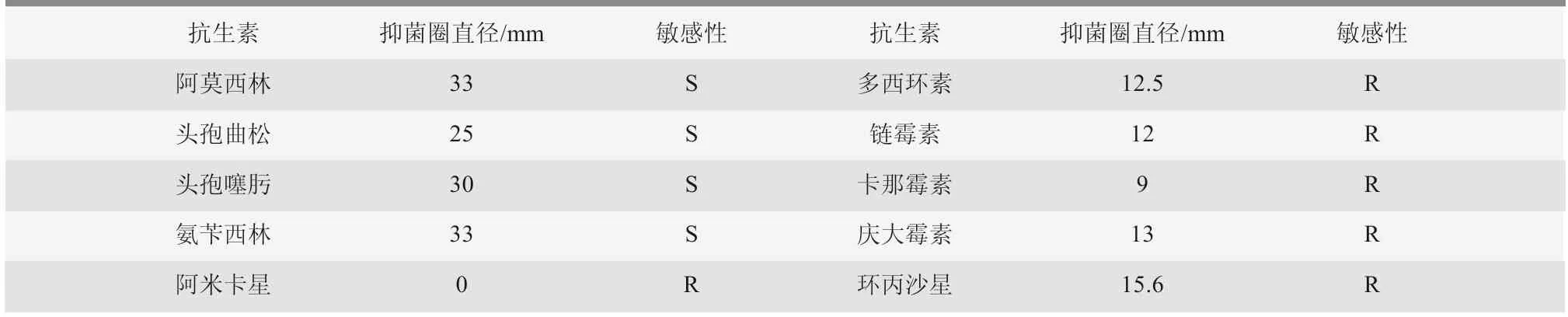
表1 副猪嗜血杆菌耐药性分析结果
3 讨论
猪的副猪嗜血杆菌广泛存在于我国各地养猪场中,成为重要的细菌性疫病,其防控仍具有挑战性。HPS 是一种非溶血性、多形态、无芽孢、不运动的革兰氏阴性菌,兼性厌氧和依赖V 因子(烟酰胺腺嘌呤二核苷酸,NAD)生长[9]。由于其生长繁殖对环境条件要求高,在采集病料和分离纯化培养中应注意采集部位、抗生素使用、培养基选择等因素对该细菌生长的影响。有报道,HPS 主要侵染上呼吸道和肺部,且长时间使用抗生素的猪难以分离出病原菌,因此,病料采集重点在鼻腔、呼吸道和肺部,并结合猪的临床表现采集相应的组织器官,以提高检出率[10]。传统的细菌分离培养比较繁琐,耗时较长,且准确率不高,采用分子生物技术PCR 可以提高检测效率和准确性,并能对细菌进行进一步血清分型[11]。本试验采用传统细菌分离培养和生化试验的同时,利用PCR 扩增技术对病原菌进行检测和血清分型,找到本次疫情的致病菌HPS 的主要血清型,为下一步有效防控提供了明确方向。
在HPS 标准血清型中,1、5、10、12、13 和14 被认为是强毒性毒株,2、4、15 和8 被认为是弱毒性毒株,血清型3、6、7、9 和11 被认为是无毒性毒株。血清型4 和5 在我国最流行,其次是血清型7、12、13 和14[12]。HPS 血清型的存在具有地区差异性,不同地区甚至不同猪场由于用药习惯、饲养管理等不同,其血清型也不同[13]。其流行特点与不同血清型菌株毒力、猪群免疫、抗生素使用、应激和疫苗接种程序等有直接关系[14,15]。本研究分离菌株为4 型HPS,属于弱毒性菌株,也是我国流行菌株,本次样本来源于一个猪场,对于济源市其他养猪场中存在的HPS 血清型是否为4-HPS,需要进一步检测。抗生素依然是有效防控和治疗该病的首选药物,但由于耐药性成为阻碍抗生素发挥治疗效果的棘手难题,使得开展耐药性监测成为必要。通过药敏试验能够为临床用药提供参考,避免盲目滥用,导致细菌耐药性扩大。
本次药敏结果显示,在10 种抗生素种,分离的副猪嗜血杆菌菌株对头孢曲松、头孢噻肟、氨苄西林、阿莫西林敏感,其他表现为耐药。因此,临床防治要选择敏感药物,并交叉轮换用药,提高治疗效果。
4 小结
综上所述,副猪嗜血杆菌在猪场中都有存在,而有的猪场猪群会发病,有的猪群则不发病。且发现HPS 的致病机制尚不清楚,且存在多种血清型,各血清型之间缺乏免疫保护,发病菌血清型与疫苗血清型不同,造成疫苗免疫失败。因此,针对本场疫情,应通过实验室诊断找到具体的血清型,或者应用自家苗预防副猪嗜血杆菌感染。

