丁苯酞联合法舒地尔对脑动脉瘤栓塞术后脑血管痉挛患者氧化应激及凋亡因子的影响*
高良君,林秀琴,王 斌,章剑剑
(1. 湖北省黄梅县人民医院,湖北 黄冈 435500; 2. 武汉大学中南医院,湖北 武汉 430000)
脑动脉瘤为常见神经系统肿瘤疾病,好发于40~70 岁的中老年人群,发病率为1.5%~2.8%[1]。脑动脉瘤破裂可致蛛网膜下腔出血(SAH),继发颅内血肿,引起一系列神经功能缺损症状,具有较高的致死率和致残率。脑动脉瘤栓塞术是治疗SAH 的主要方法,能快速、有效地控制出血,缓解病情,但并发症较多[2]。脑血管痉挛(CVS)为脑动脉瘤栓塞术的常见并发症,发生率为35%~60%,严重影响脑动脉瘤栓塞术患者的康复效果[3-4]。故早期预防和积极干预CVS的发生对提高预后极为重要。法舒地尔是一种Rho 激酶抑制剂,通过抑制肌球蛋白轻链磷酸化,拮抗钙离子敏化效应,扩张血管,缓解血管痉挛症状,但其作用特异性强,单一用药效果不佳[5-6]。丁苯酞是一种改善脑部循环的药物,具有促进毛细血管再生、保护神经、改善代谢等作用,广泛用于急性脑梗死、血管性痴呆等脑血管疾病的治疗[7],但关于丁苯酞治疗CVS 的报道较少。本研究中探讨了丁苯酞联合法舒地尔治疗脑动脉瘤栓塞术后CVS的临床疗效,以及对患者氧化应激反应及凋亡因子水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:经血管造影确诊为脑动脉瘤破裂导致的SAH[8],接受脑动脉瘤栓塞术治疗;发病至入院时间低于24 h;术后发生CVS[9];Hunt-Hess 分级Ⅰ-Ⅲ级;病理资料完整,依从性好。本研究方案经医院医学伦理委员会批准(批件号为hmym202003138),患者及家属签署知情同意书。
排除标准:多发性脑动脉瘤、脑血管畸形、脑损伤等其他中枢神经疾病;其他原因导致的CVS;心、肝、肾等脏器功能障碍;伴严重感染、恶性肿瘤、血液系统、免疫系统及内分泌系统疾病;精神性疾病;入组前已接受其他治疗;病情恶化,更换治疗方案。
病例选择与分组:选取湖北省黄梅县人民医院2020 年6 月至2022 年8 月收治的脑动脉瘤栓塞术后CVS 患者86 例,按随机抽签法分为观察组和对照组,各43 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
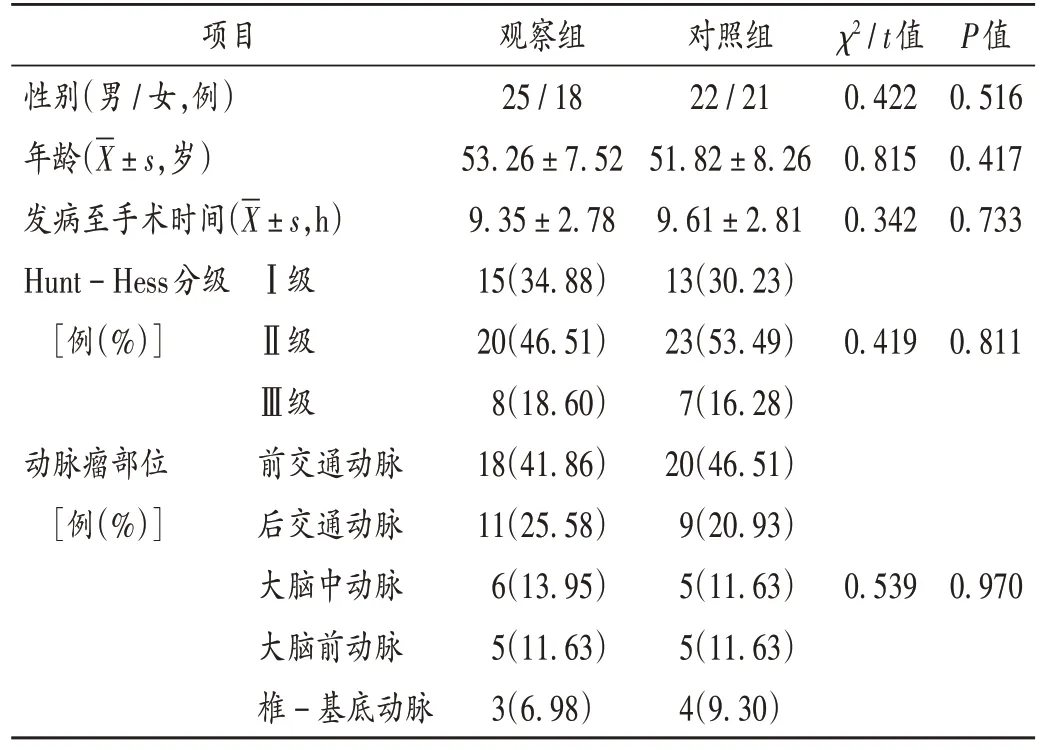
表1 两组患者一般资料比较(n=43)Tab.1 Comparison of the patients' general data between the two groups(n=43)
1.2 方法
两组患者术后均予降压、调脂、控制脑水肿、营养神经、维持电解质平衡等基础治疗。对照组患者在此基础上给予盐酸法舒地尔注射液(天津红日药业股份有限公司,国药准字H20040356,规格为每支2 mL∶30 mg)静脉滴注,每次30 mg,每日3 次。观察组患者在对照组治疗基础上联用丁苯酞氯化钠注射液(石药集团恩必普药业有限公司,国药准字H20100041,规格为每支100 mL∶丁苯酞25 mg 与氯化钠0.9 g)静脉滴注,每次25 mg,每日2次。两组患者均治疗14 d。
1.3 观察指标与疗效判定标准
观察指标:1)神经功能。采用美国国立卫生研究院卒中量表(NIHSS)评估患者治疗前后神经功能缺损情况;采集患者治疗前后空腹静脉血各3 mL,离心(转速为2 500 r/min)10 min,分离取血清,低温保存,采用酶联免疫吸附试验(ELISA)法检测治疗前后血清神经元特异性烯醇化酶(NSE)、S100 钙结合蛋白β(S100β)等神经功能损伤标志物水平。2)脑血流动力学状态。利用CBBACV-300 型脑血流动力学分析仪(上海麦登生物工程公司)测量治疗前后患者脑中动脉平均血流速度(Vm)、搏动指数(PI)、CVS 指数(Linde - gard)。3)氧化应激。采用ELISA法检测治疗前后血清谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)水平。4)凋亡因子。采用ELISA法检测治疗前后血清B淋巴细胞瘤-2(Bcl-2)、可溶性凋亡相关因子配体(sFASL)、可溶性凋亡相关因子(sFAS)水平。5)安全性:记录患者治疗期间皮疹、腹部不适、恶心呕吐、头晕头痛等不良反应发生情况。
疗效判定[9]:显效,临床症状及体征均明显改善,脑血流速度基本正常;有效,临床症状及体征均减轻,脑血流速度有所改善;无效,临床症状及体征、脑血流速度均未改善,甚至恶化。总有效=显效+有效。
1.4 统计学处理
2 结果
结果见表2至表7。
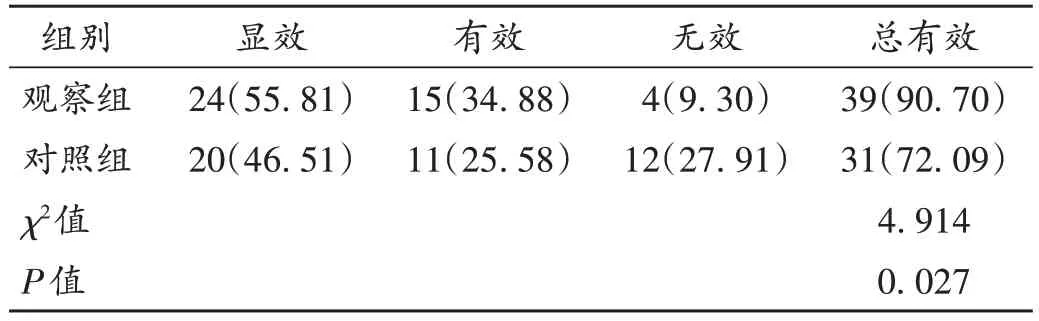
表2 两组患者临床疗效比较[例(%),n=43]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=43]
表3 两组患者神经功能指标比较(,n=43)Tab.3 Comparison of neurological function indexes between the two groups(,n=43)

表3 两组患者神经功能指标比较(,n=43)Tab.3 Comparison of neurological function indexes between the two groups(,n=43)
注:与本组治疗前比较,*P <0.05。表4至表6同。Note:Compared with those before treatment,*P < 0.05 (for Tab.3 - 6).
组别观察组对照组t值P值NIHSS评分(分)治疗前21.02±4.01 20.85±4.35 0.152 0.879治疗后11.19±2.70*14.31±2.78*5.261 0.000 NSE(µg/L)治疗前22.09±4.13 22.71±4.32 0.708 0.481治疗后13.80±2.99*15.41±3.02*2.464 0.016 S100β(µg/L)治疗前2.52±0.41 2.61±0.44 1.002 0.319治疗后1.39±0.31*1.61±0.38*2.772 0.007
表4 两组患者脑血流动力学指标比较(,n=43)Tab.4 Comparison of cerebral hemodynamics indexes between the two groups(,n=43)
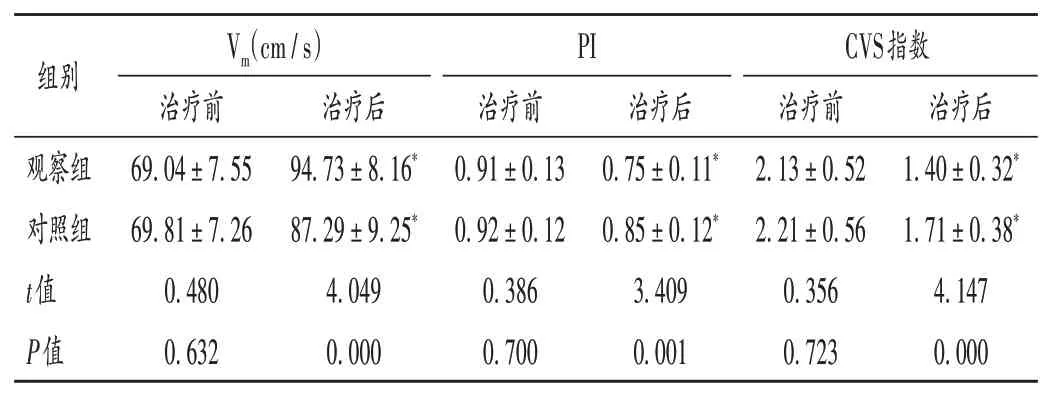
表4 两组患者脑血流动力学指标比较(,n=43)Tab.4 Comparison of cerebral hemodynamics indexes between the two groups(,n=43)
组别Vm(cm/s)治疗前治疗后PI治疗前治疗后CVS指数治疗前治疗后观察组对照组t值P值69.04±7.55 69.81±7.26 0.480 0.632 94.73±8.16*87.29±9.25*4.049 0.000 0.91±0.13 0.92±0.12 0.386 0.700 0.75±0.11*0.85±0.12*3.409 0.001 2.13±0.52 2.21±0.56 0.356 0.723 1.40±0.32*1.71±0.38*4.147 0.000
表5 两组患者血清氧化应激指标水平比较(,n=43)Tab.5 Comparison of serum oxidative stress indexes between the two groups(,n=43)

表5 两组患者血清氧化应激指标水平比较(,n=43)Tab.5 Comparison of serum oxidative stress indexes between the two groups(,n=43)
组别观察组对照组t值P值GSH-Px(mmol/L)治疗前24.23±5.76 24.49±6.03 0.206 0.837 MDA(µmol/L)治疗前8.09±1.56 8.21±1.59 0.706 0.482治疗后4.36±1.09*5.43±1.17*4.373 0.000治疗后43.17±6.52*35.43±6.87*5.307 0.000
表6 两组患者血清凋亡因子指标比较(,n=43)Tab.6 Comparison of serum apoptotic factor indexes between the two groups(,n=43)
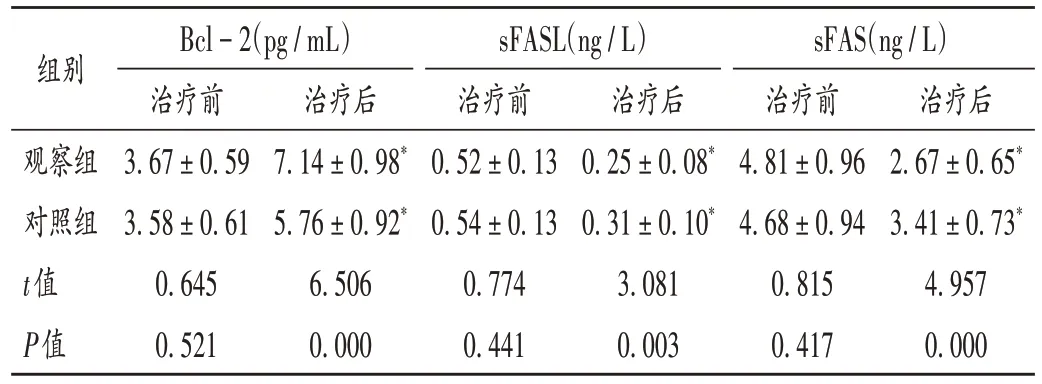
表6 两组患者血清凋亡因子指标比较(,n=43)Tab.6 Comparison of serum apoptotic factor indexes between the two groups(,n=43)
组别治疗后2.67±0.65*3.41±0.73*4.957 0.000 Bcl-2(pg/mL)治疗前3.67±0.59 3.58±0.61 0.645 0.521 sFASL(ng/L)治疗前0.52±0.13 0.54±0.13 0.774 0.441治疗后7.14±0.98*5.76±0.92*6.506 0.000观察组对照组t值P值治疗后0.25±0.08*0.31±0.10*3.081 0.003 sFAS(ng/L)治疗前4.81±0.96 4.68±0.94 0.815 0.417
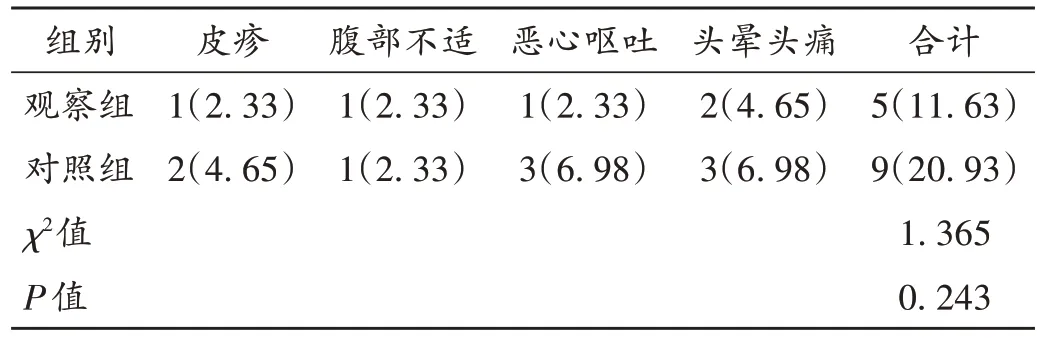
表7 两组患者不良反应发生情况比较[例(%),n=43]Tab.7 Comparison of the incidence of adverse reaction between the two groups[case(%),n=43]
3 讨论
CVS可造成脑组织缺血、缺氧损害,是造成脑动脉瘤栓塞术后患者预后不良的重要原因[10]。CVS发病机制复杂,与脑血管机械性损害、钙离子内流等多种因素有关。法舒地尔能抑制平滑肌收缩,舒张血管,缓解CVS症状[11]。
丁苯酞是一种多靶点神经营养药物,具有改善脑循环、提高脑血流量的作用,还能调节神经递质,改善血管内皮功能,重构脑组织微循环,促进神经元生长分化,临床作为急性脑卒中的指导用药[12]。本研究结果显示,观察组治疗总有效率显著高于对照组,且观察组治疗后的NIHSS评分、血清NSE及S100β水平均显著低于对照组,脑血流动力学指标均显著优于对照组,提示在法舒地尔基础上加用丁苯酞能改善脑动脉瘤栓塞术后CVS 患者脑组织血流动力学状况,促进神经功能恢复,从而提高临床疗效。分析原因可能为,丁苯酞能抑制花生四烯酸表达,促进血管舒张因子一氧化氮等释放,扩张血管,从而减轻血管痉挛;还可降低细胞内钙离子浓度,与法舒地尔协同增效,舒张血管平滑肌,缓解血管痉挛症状。
氧化应激反应在SAH 及CVS 病理过程中发挥重要作用。SAH 会加剧氧化应激和脂质过氧化反应,促进血管内皮损害和内皮细胞凋亡,从而诱导CVS 发生[13-14]。GSH - Px 是一种抗氧化剂,通过清除体内过量氧自由基,使机体处于还原状态,保护细胞免受损害[15]。MDA 为常见过氧化物,侧面反映体内氧自由基水平。本研究结果显示,两组患者治疗后的血清MDA水平显著降低,GSH-Px 水平显著升高,观察组改善幅度显著优于对照组,提示丁苯酞能进一步降低机体氧化应激程度。分析原因可能为,体内氧化应激程度与线粒体功能障碍密切相关,丁苯酞能改善脑组织血流灌注,维持神经功能代谢,增强脑细胞线粒体功能,减少自由基生成,提高抗氧化应激能力。
脑动脉瘤破裂后造成脑组织缺血、缺氧,诱发CVS、神经炎性损害、神经细胞凋亡等病理改变,神经细胞持续凋亡直接影响神经功能的恢复,对预后造成严重不良影响[16]。Bcl-2,sFASL,sFAS 是典型的凋亡因子,其中Bcl- 2 为抗凋亡因子,通过抑制多种细胞的毒性作用,从而减缓细胞的凋亡;sFASL 和sFAS 能促进神经缺血和加速神经细胞凋亡,从而影响疾病转归[17-18]。本研究结果显示,两组患者治疗后的血清Bcl- 2 水平均显著升高,sFASL 和sFAS 水平均显著降低,且观察组改善幅度均显著优于对照组,提示丁苯酞联合法舒地尔能调节细胞凋亡因子的表达与释放,抑制神经细胞凋亡,阻碍凋亡反应进程,从而保护神经元细胞,促进神经功能恢复。分析原因可能为,丁苯酞能促进毛细血管再生和侧支循环的建立,改善缺血脑区的微循环,营养脑部神经,抑制神经细胞凋亡;另外,丁苯酞还能改善脑组织细胞代谢,促进受损神经细胞的修复,从而改善临床预后。
综上所述,丁苯酞联合法舒地尔治疗脑动脉瘤栓塞术后CVS 疗效良好,可有效改善患者的脑组织血流动力学状况,减轻机体氧化应激反应,调控凋亡因子表达,促进神经功能恢复,且安全性良好。但本研究中未进行远期随访,且纳入样本量也较小,可能导致研究结果偏差,未来需作进一步研究。

