转基因大豆低水平混杂定量检测及其不确定度分析
邓婷婷,黄文胜,曹际娟,于 宁,邢冉冉,张九凯,葛毅强,陈 颖,
(1.中国检验检疫科学研究院,北京 100176;2.大连民族大学生命科学学院,辽宁 大连 116600;3.中国农村技术开发中心,北京 100045)
转基因产品低水平混杂(low level presence,LLP),即生产、贸易及加工的农产品中,因各种原因导致含有较低或极低水平未经进口国批准的转基因成分。LLP有3 个明显特征:发生LLP的转基因作物非经进口国批准,但其安全性已得到其他国家的认可;转基因产品LLP问题仅与贸易有关;LLP是微量可限定的[1-4]。在农产品供应链的多个节点上,转基因产品都可能混杂的可能性,如育种阶段的花粉漂移、大宗运输及生产加工过程中的残留污染等,完全清除供应系统中的转基因成分残留有现实难度[5-7]。因此,转基因作物LLP从客观上无法避免。随着全球转基因作物种植面积越来越大,转基因产品的全球贸易量也在不断增加,但不同国家对转基因产品批准的范围与进度不一[8-9],农产品国际贸易中转基因产品LLP事件发生的频率越来越高,LLP事件已占转基因成分混杂事件的50%左右,其中大豆是引发LLP事件的主要作物之一[10-12]。因此,建立科学的转基因大豆LLP判定方法,尤其是定量分析方法,将农产品贸易中的转基因健康及环境风险降到最低,可以保障我国农产品进出口的稳定与进一步的发展。
转基因检测技术随着科技进步而快速发展,目前主要的检测手段仍以实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)为主,近年来数字PCR技术被广泛应用于转基因检测,数字PCR由于具有测量独立性与无需任何校准物的特点,使得低丰度靶标分子的精准定量成为可能。但无论是real-time PCR定性检测还是数字PCR定量检测,其检测极限值仍然存在,超出极限值的误差不可避免。任何检测结果都会或多或少偏离真实值,因此在描述转基因定量结果的同时指出定量结果的可靠程度非常有必要。CNASCL01-G003:2021《测量不确定度的要求》规定,检验实验室应对每项有数值要求的测量结果进行测量不确定度评定。不确定度作为衡量检测结果可靠程度的重要指标,能定量表示检测数据的分散范围,有助于判断“临界值”的符合性[13-16]。根据测量不确定度的定义,测量结果的不确定度可以用标准偏差进行表征。实际工作中则可以实验标准差S作为其估计值[17-19]。而在标准物质研制的过程中,将定值不确定度与均匀性评估、稳定性考察引入的不确定度按照平方和开方的方法叠加就给出了标准物质的合成标准不确定度,该合成标准不确定度乘以包含因子k得出的不确定度称为扩展不确定度U[20]。而对于转基因定量的不确定度目前鲜见研究报道。因此,采用数字PCR方法研究从转基因产品LLP定量的整个过程并科学评估定量结果的不确定度,建立科学的LLP判定方法,减少LLP贸易风险,对我国转基因产品进出口贸易具有极为重要的意义。
1 材料与方法
1.1 材料与试剂
转基因大豆(Glycine max)GTS40-3-2等标准物质购于欧盟联合研究中心标准物质与测量研究所(Institute for Reference Materials and Measurements,IRMM);非转基因大豆等样品由本实验室保存。
ddPCR Super Mix(no dUTP)、ddPCR Droplet Generation Oil、ddPCR Droplet Reader Oil、Droplet Generator DG8 Cartridge等试剂和耗材 美国Bio-Rad公司;RealMaster Mix(with ROX)美国ABI公司;十六烷基三甲基溴化铵(cetyltrithyl ammonium bromide,CTAB)、氯化钠(NaCl)北京索莱宝科技有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、乙二胺四乙酸二钠(disodium ethylenediamine tetraacetic acid,Na2EDTA)美国Amresco公司;三氯甲烷、无水乙醇、异丙醇(均为分析纯)北京六合通公司。
1.2 仪器与设备
QX200TMDroplet Digital PCR系统(包括微滴生成器、封膜机、PCR扩增仪和微滴读取仪)美国Bio-Rad公司;7500实时荧光PCR仪 美国ABI公司;研磨机德国IKA公司;离心机 美国Beckman Coulter公司;Qubit核酸蛋白分析仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 样品制备与试剂配制
低含量转基因大豆GTS-40-3-4样品的制备:取0.5 g转基因大豆GTS40-3-2标准物质加入到49.5 g非转基因大豆中,充分混合均匀并研磨至60 目,制成转基因大豆GTS40-3-2质量分数为1%的样品,再取0.5 g含1%转基因大豆GTS40-3-2的样品加入到49.5 g非转基因大豆中,充分混合均匀并研磨至60 目,制成转基因大豆GTS40-3-2质量分数为0.1%的样品,按照此方法再依次制成含0.05%、0.01%、0.005%和0.001%转基因大豆GTS40-3-2的样品。
CTAB提取缓冲液(20 g/L CTAB、1.4 mol/L NaCl、0.1 mol/L Tris-HCl、0.02 mol/L Na2EDTA,pH 8.0):称取5 g CTAB、20.45 g NaCl、3.03 g Tris和1.86 g Na2EDTA,溶于200 mL去离子水中,充分搅拌均匀,用浓HCl调节溶液的pH值至8.0,最后加去离子水定容至250 mL,121 ℃灭菌20 min,室温保存备用。
CTAB沉淀液(5 g/L CTAB、40 mmol/L NaCl):称取0.5 g CTAB和0.234 g NaCl加入去离子水定容至100 mL,121 ℃灭菌20 min,室温保存备用。
TE缓冲液(10 mmol/L Tris-HCl、1 mmol/L EDTA,pH 8.0):量取1 mL 1 mol/L Tris-HCl(pH 8.0)和0.2 mL 0.5 mol/L EDTA(pH 8.0),加去离子水定容至100 mL,121 ℃灭菌20 min,室温保存备用。
1 mol/L Tris-HCl(pH 8.0)缓冲液:称取121.1 g Tris置于1 L烧杯中,约加入800 mL去离子水,充分搅拌溶解,应使溶液冷却至室温后用浓HCl调节溶液的pH值至8.0,最后加去离子水定容至1 L,121 ℃灭菌20 min,备用。
0.5mol/L EDTA(pH 8.0)缓冲液:称取186.1 g Na2EDTA·2H2O,置于1 L烧杯中,约加入800 mL去离子水,充分搅拌,用NaOH调节pH值至8.0(约20 g NaOH),最后加去离子水定容至1 L,121 ℃灭菌20 min,室温保存备用。
1.3.2 基因组DNA提取
样品采用GB/T 19495.3—2004《转基因产品检测核酸纯化提取方法》中改良的CTAB法[21]提取基因组DNA,提取过程中将样本量增加2 倍,蛋白酶K量增加2.5 倍,去蛋白的步骤重复1 次,溶解沉淀的缓冲液体积减少至原来1/2。利用核酸蛋白分析仪分别测定提取的样品DNA溶液的浓度及质量后,-20 ℃保存备用。
1.3.3 引物和探针的设计及合成
根据欧盟标准方法(JRC,2017)合成大豆凝集素基因(Lectin)和GTS-40-3-2品系特异性基因引物探针,根据GB/T 38164—2019《常见畜禽动物源性成分检测方法 实时荧光PCR法》[22]方法合成黄牛Cytb基因引物探针(表1),相关序列及其标记由英潍捷基(上海)贸易有限公司合成。

表1 转基因大豆GTS-40-3-2定量引物探针序列Table 1 Sequences of primers and probes used for quantitative analysis of GTS-40-3-2
1.3.4 扩增体系和反应参数
数字PCR扩增体系:分别向0.2 mL PCR管中加入2×ddPCR Super Mix(no dUTP)10 μL,终浓度为0.4 µmol/L的正向引物和反向引物,0.2 µmol/L荧光标记探针,5 µL DNA模板,利用ddH2O补齐至20 µL。
数字PCR扩增参数:根据仪器要求,将配制好的数字PCR混合液,加入Droplet Generator DG8 Cartridge的加样孔中,在其另一侧加入ddPCR Droplet Generation Oil后放入QX200TMDroplet Digital PCR微滴生成器中,由仪器自动生成微滴。将生成的微滴移至PCR板中进行加膜密封后放置于PCR扩增仪中,按以下参数进行PCR扩增:95 ℃预变性5 min(1 ℃/s),1 个循环;94 ℃变性15 s,60 ℃退火1 min(1 ℃/s),50 个循环;98 ℃延伸10 min(1 ℃/s),1 个循环;12 ℃保存反应产物。将扩增产物放入微滴读取仪中进行荧光检测,记录阳性和阴性微体系数量及其比值。根据比值分别计算数字PCR体系中的大豆Lectin基因和GTS-40-3-2品系特异性基因拷贝数(copies/μL)。
real-time PCR扩增体系和参数:0.2 mL PCR反应管中加入2×RealMaster Mix(with ROX)10 μL,终浓度为0.4 µmol/L的正向引物和反向引物、0.2 µmol/L的探针、5 µL DNA模板,利用ddH2O补齐至20 µL。real-time PCR程序为:95 ℃预变性10 min;95 ℃变性10 s;60 ℃退火延伸45 s;45 个循环。
1.3.5 real-time PCR方法定性检测限的确定
将含0.1%、0.05%、0.01%、0.005%和0.001%转基因大豆GTS-4-3-2的样品基因组DNA模板10、100、1000 ng加入real-time PCR扩增体系中,每个样品重复20 次,确定95%置信区间下能稳定检出的最低DNA添加量和定性检测限。每个扩增反应中添加黄牛DNA(20 copies/反应)作为内参照,ddH2O为空白对照。
1.3.6 数字PCR方法的定性检测限和定量检测限的确定
按1.3.3节方法分别对含0.1%、0.05%、0.01%、0.005%和0.001%转基因大豆GTS-4-3-2的样品进行数字PCR定量,每个样品进行3 次平行检测。
1.3.7 数字PCR方法定量精密度和重复性
为验证所建立的ddPCR方法对低含量转基因大豆的定量精密度,在重复性条件下,用同样的方法、相同的测试环境下进行数字PCR定量实验,每个样品平行检测10 次。根据内外源基因的拷贝数计算其标准偏差、相对标准偏差(relative standard deviation,RSD)及相对误差,以判别其精密度和重复性。
2 结果与分析
2.1 real-time PCR检测模板添加量和定性检测限
将含0.1%、0.05%、0.01%、0.005%和0.001%转基因大豆GTS-4-3-2的样品基因组DNA模板10、100 ng及1000 ng加入real-time PCR扩增体系中扩增时,每个扩增反应中添加的内参照黄牛DNA均被检出且Ct值无显著差异(P>0.05),表明即使扩增体系中DNA模板含量高达1000 ng,PCR也未受抑制。含0.1%和0.05%转基因大豆GTS-4-3-2的样品分别添加10 ng和100 ng模板即可检出。含0.01%转基因大豆GTS-4-3-2的样品需要将模板量添加至1000 ng时才可检出GTS-4-3-2品系特异性基因,而低于此含量后,0.005%和0.001%的样品GTS-4-3-2品系特异性基因检出率极低(表2)。即95%置信区间下,当模板添加量为1000 ng时,LLP转基因大豆GTS-4-3-2的realtime PCR定性检测限为0.01%,低于其他报道中的realtime PCR检测方法[23-24]。表明即使扩增体系中DNA模板含量高达,PCR也未受抑制。
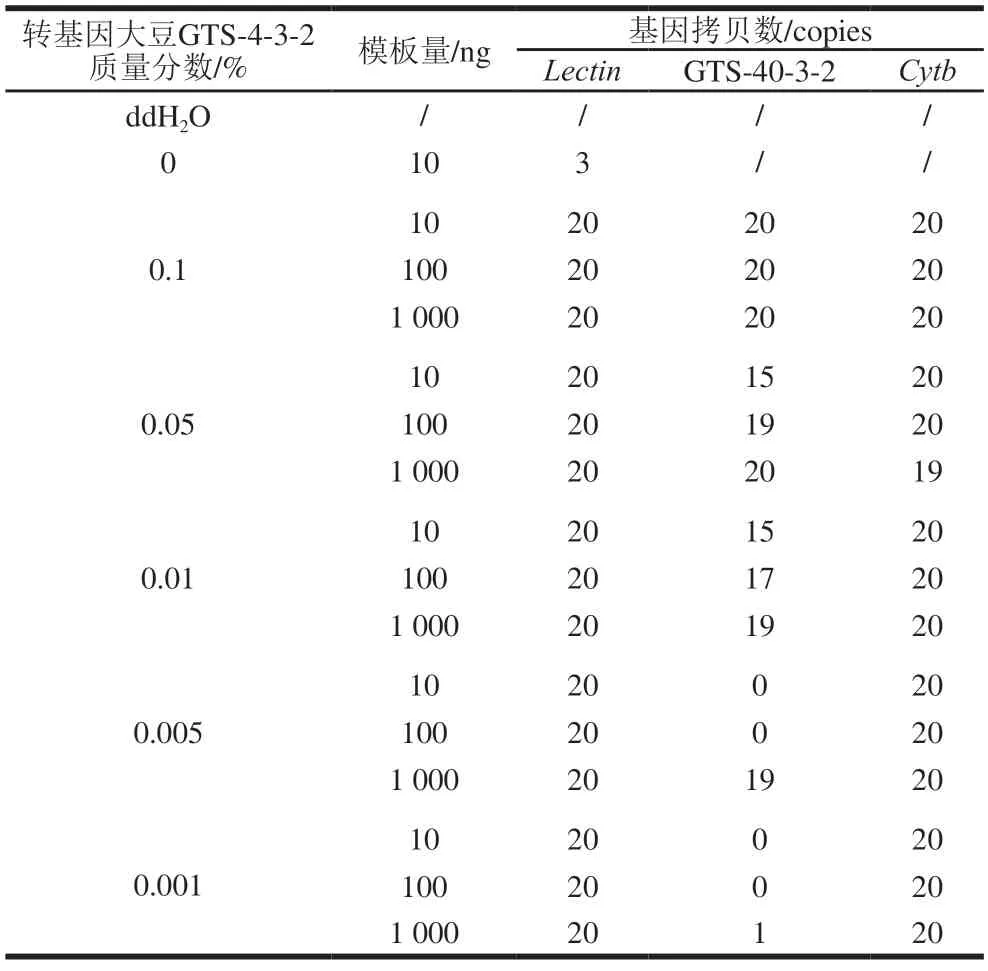
表2 不同样品real-time PCR检测20 次重复阳性结果统计Table 2 Results of different samples being tested positive 20 times by real-time PCR
2.2 数字PCR的定性检测限和定量检测限
分别对含0.1%、0.05%、0.01%、0.005%和0.001%转基因大豆GTS-4-3-2的样品进行数字PCR定量时,在内外源基因阴性对照及空白对照无扩增的情况下,所有转基因大豆GTS-4-3-2样品Lectin基因定量结果的3 次重复RSD值均在5%以内,表明所有操作精密度较好,定量结果较为可靠。含0.1%转基因大豆GTS-4-3-2样品定量结果为0.104%,相对误差和3 次重复RSD分别为4.015%和18.533%,小于目前国际通用的定量方法要求。含0.05%转基因大豆GTS-4-3-2样品的相对误差和3 次重复RSD分别为42.305%和61.171%,不符合转基因定量中相对误差在25%以内的要求,结果仅可作为样品中转基因大豆GTS-4-3-2品系LLP的含量参考。而3 次重复定量的0.01%样品均出现阳性结果(表3)。表明本研究建立的数字PCR方法对LLP转基因大豆GTS-40-3-2样品的定量检测灵敏度可达0.1%,定性检测限则可达0.01%。

表3 不同含量转基因大豆样品数字PCR定量检测结果Table 3 Quantitative results of different contents of GTS-40-3-2 by digital PCR
2.3 数字PCR定量方法的精密度和重复性
为验证所建立的ddPCR方法对低含量转基因大豆的定量检测精密度,在重复性条件下,用同样的方法、相同的测试环境下,很短的时间间隔内得到测试结果的相关数据,每个样品平行检测6 次。含0.1%转基因大豆GTS-4-3-2六个平行样品的定量结果分别为0.102%、0.081%、0.104%、0.112%、0.094%和0.118%,所有样品的3 次重复RSD在11.28%~22.75%之间,与实际含量的相对误差值在-10.55%~24.12%之间(图1a)。

图1 转基因大豆GTS-4-3-2样品6 次重复定量结果Fig.1 Quantitative results of six replicates of GTS-40-3-2
含0.1%转基因大豆GTS-4-3-2样品的相对误差和RSD均小于常规定量要求的25%,表明该方法即使在对低含量的样品进行重复定量时,其精密度和稳定性均较为理想。含0.05%转基因大豆GTS-4-3-2六个平行样品定量结果分别为0.026%、0.063%、0.046%、0.025%、0.033%、0.027%、0.034%,所有样品的3 次重复RSD在43.98%~67.54%之间,与实际含量值的偏差在-50.00%~26.00%之间(图1b),定量精密度和定量值波动范围超过国际通用定量要求,但在日常可操作的前提下,也可实现半定量,对LLP样品的筛查检测和出入境贸易可以提供一定参考依据。
2.4 转基因大豆GTS-40-3-2LLP定量的不确定度
日常可接受的操作范围内,本研究分别对质量分数不小于0.1%和0.05%的转基因大豆GTS-40-3-2样品进行LLP定量研究,因此以下将分开计算这两种不同含量样品的定量不确定度。
根据ISO导则35、ISO/TS 21748:2017和我国相关标准[25-28],对转基因产品LLP检测的不确定度进行评定。转基因产品LLP定量检测过程带来的合成不确定度由两部分组成,第一部分是通过测量数据的标准偏差、测量次数及所要求的置信水平按统计方法计算出的A类不确定度;第二部分是通过对测量影响因素的分析,以非统计分析方法评定的B类不确定度。
2.4.1 A类不确定度
由于数字PCR为终点计数的绝对定量,传统realtime PCR定量方法中需考虑的内外源基因标准曲线不确定度、样品批内Ct值不确定度、PCR扩增效率的不确定度等都无需考虑。因此其A类不确定度表示为:
式中:μa为标准不确定度;为n次含量测定值的算术平均数,n≥6;x为每次含量测定值;i为测定序号;n为平行测量次数。
由2.4节可计算出6 次重复的含0.1%转基因大豆GTS-40-3-2定量的A类相对不确定度uAr0.1%为0.1152,而6 次重复的0.05%转基因大豆GTS-40-3-2定量的A类相对不确定度应uAr0.05%为0.5359。
2.4.2 B类相对不确定度
采用的数字PCR仪器为Bio-Rad QX200微滴式数字PCR,因此B类不确定度的来源主要有微滴体积引入的测量不确定度、配制样品时天平变动性引入的不确定度、数字PCR仪器校准引入的不确定度。
2.4.2.1 微滴体积引入的测量不确定度
本研究采用的数字PCR仪器微滴体积引入的测量不确定度u体积为常数1.40%。
2.4.2.2 配制样品时天平变动性引入的不确定度
天平变动性产生的不确定度:由天平的检定证书可知其变动性为0.1 mg,按照矩形分布,则样品净质量为2 次称量操作所得。每次称质量均为独立观测结果,故计算两次为:
天平的最大允差产生的不确定度:由天平检定证书可知其最大允差为0.15 mg,按照矩形分布,则u1最大允差同样,样品净质量为两次称量操作所得。每1 次称质量均为独立观测结果,故计算两次为:
称量10、1、0.5 g大豆产生的相对不确定度分别为:
合成称量产生的相对不确定度:
2.4.2.3 数字PCR仪器校准引入的不确定度
根据仪器校准证书可知,本实验所用的Bio-Rad QX200微滴式数字PCR校准不确定度u校准为2.03%。
本研究中数字PCR定量GTS40-3-2的B类不确定度由上述3 个分量组成,其合成标准不确定度则表示为:
0.1%及以上转基因大豆GTS-40-3-2定量的合成相对不确定度应为:
含0.05%的转基因大豆GTS-40-3-2定量的合成相对不确定度应为:
取包含因子k=2(置信区间95%),则结果报告为0.1%转基因大豆GTS-40-3-2定量扩展不确定度为23.56%,0.05%的转基因大豆GTS-40-3-2定量的扩展不确定度为107.29%。
3 结论与讨论
有效的转基因成分定量检测方法无疑是对转基因大豆进行LLP检测和实施标识制度最直接的技术保障。数字PCR步骤繁琐,检测通量比real-time PCR低,因此在转基因成分定性检测中,仍然不及real-time PCR优势明显。但数字PCR技术由于将含有DNA模板的微量样品进行稀释以及分液,分布到大量的独立反应室中进行扩增,极大降低了反应间的相互抑制,提高了反应效率。数字PCR可以对样品进行绝对定量分析,比real-time PCR仅依靠标准曲线确定转基因成分含量更加准确。因此,本研究开展了从DNA提取到定量全过程的系统性转基因大豆GTS-40-3-2的LLP检测研究,定性检测样品中的转基因LLP时仍然推荐real-time PCR方法,定性检测限基本与数字PCR一致,可低至0.01%。定量检测时数字PCR优势明显,可对含0.1%转基因的样品进行准确定量,即使是低至0.05%的转基因大豆GTS-40-3-2样品仍可进行半定量,其定性和定量灵敏度低于已发表文章中的检测限,也低于国内外的现行标识最低阈值[23-24,29-30]。且本研究采用的检测方法对实验室和人员要求较为宽松,因此建立的定量方法在转基因大豆GTS-40-3-2的LLP检测中具有比realtime PCR更大的实际应用价值。
对于LLP的定量检测,实验中考虑测量值的不确定度非常有必要。采用数字PCR检测时,不受标准样品、内外源基因拷贝数、标准曲线及PCR扩增效率的不确定度影响,因而定量结果更为可靠。本研究对0.1%和0.05%的GTS-40-3-2品系转基因大豆原料进行定量检测的扩展不确定度分别为23.56%和107.29%。在实际检测中,若样品为加工食品时,则还需考虑样品的基质效应及食品加工过程中带来的DNA断裂、降解等产生的不确定度。对于这些因素,目前的科学手段还无法描述,因此在实际检测过程中,难以给出加工食品LLP定量的不确定度。

