中药对氨基糖苷类药物和顺铂致耳毒性的抑制研究进展
宋伏洋, 黄壮壮, 李 波, 李金晟, 刘 峰, 3, 4*
1.陕西中医药大学, 咸阳 712046; 2.陕西国际商贸学院, 咸阳 712046; 3.陕西步长制药有限公司, 西安 710075; 4.陕西省中药绿色制造技术协同创新中心, 咸阳 712046
据世界卫生组织统计,全球约4.6亿人患有听力障碍,药物性耳聋是其重要原因之一[1],其中氨基糖苷类药物和顺铂是近年来应用较多的致耳毒性药物。氨基糖苷类药物包括链霉素、庆大霉素、妥布霉素、阿米卡星和依替米星等。由于其对耳、肾具有毒性和不良反应,在过去一段时间内,较少应用于临床,但随着多重耐药细菌感染事件的增多,人们重新开始关注氨基糖苷类药物,由于其价格低廉且具有广谱抗菌的特性,目前仍然是全球广泛使用的抗生素之一[1-2]。顺铂是临床上治疗多种实体瘤的一线药物[3],广泛用于肺癌、睾丸癌、卵巢癌、胃癌、间皮瘤等的治疗[4],但其具有较大的毒性和不良反应,即使癌症痊愈后,也会影响患者的生活质量。
氨基糖苷类药物和顺铂导致耳毒性往往与内耳毛细胞受损有关,由于哺乳动物听觉毛细胞再生功能障碍,内耳毛细胞受损后往往是不可逆的[5]。目前中药对氨基糖苷类药物和顺铂导致的内耳毛细胞损伤有较好的治疗作用,凸显出了该类中药潜在的临床应用价值,因此,概述当前氨基糖苷类药物和顺铂诱发耳毒性的研究现状,梳理对氨基糖苷类药物和顺铂致耳毒性有预防作用的中药,并归纳其共同的作用机制,可为后续开发基于靶点的耳毒性中药提供重要的依据。
1 氨基糖苷类药物和顺铂进入毛细胞的主要途径
氨基糖苷类药物和顺铂主要通过转运蛋白或转运离子从血管纹进入内淋巴液。其中顺铂可能通过边缘细胞中的有机阳离子转运蛋白2(organic cation transporter 2,OCT2)和铜转运蛋白1(copper transporter 1,CTR1)等进入内淋巴液,氨基糖苷类药物进入内淋巴液的途径尚不清楚,但有研究表明,瞬时受体电位V1(transient receptor potential vanilloid 1,TRPV1)和瞬时受体电位V4(transient receptor potential vanilloid 4,TRPV4)可能是其进入内淋巴液的途径[6]。最终药物通过立体纤毛机械电传导(mechanoelectrical transducer,MET)通道、瞬时感受器电位(transient receptor potential,TRP)通道等从毛细胞的顶端进入毛细胞[7]。
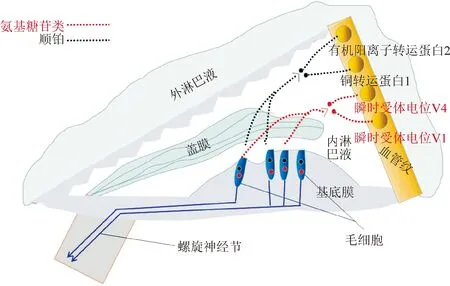
图1 氨基糖苷类药物和顺铂进入毛细胞途径示意图
2 氨基糖苷类药物和顺铂致耳毒性机制的研究进展
氨基糖苷类药物导致的细胞毒性是由于线粒体核糖体与细菌核糖体的竞争性结合导致的。氨基糖苷类药物原本与细菌核糖体结合发挥抗菌作用,但因线粒体核糖体与细菌核糖体的相似性,使得氨基糖苷类药物误与线粒体核糖体结合,抑制线粒体中蛋白的生物合成,从而导致呼吸链功能出现异常,氧自由基增多[8]。
顺铂诱导的细胞毒性是由于顺铂进入耳蜗细胞后,顺铂上的氯原子被水分子取代后形成潜在的亲电子体水合顺铂,可与核和线粒体脱氧核糖核酸(deoxyribo nucleic acid,DNA)上2个相邻鸟嘌呤共价结合,形成加合物,阻断了DNA转录并导致双链断裂[9]。此外,顺铂还能激活内质网应激途径和线粒体活性氧(reactive oxygen species,ROS)生成途径,产生过量的ROS[10]。
ROS作为正常细胞氧代谢的副产物,可参与多种酶促反应,在细胞信号转导中具有重要的作用。然而在一些耳毒性药物如氨基糖苷类和顺铂的刺激下,ROS水平会显著升高。ROS作为一种强氧化剂,与一些分子相互作用,促进自由基的产生,从而严重破坏细胞结构。为了维持体内氧化还原稳态,细胞内的过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、还原性谷胱甘肽(glutathione,GSH)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶可中和过量的ROS以减轻耳毒损伤[11]。当抗氧化酶消耗过多,毛细胞内残余的ROS会破坏细胞结构,导致毛细胞凋亡[12]。
氨基糖苷类药物和顺铂还会使毛细胞内诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达增加,iNOS催化L-精氨酸引起体内大量一氧化氮(nitric oxide,NO)的产生。NO除本身细胞毒性外,还会与ROS发生反应,生成氮的过氧化物, 也对细胞有较强的毒性作用[12]。
氨基糖苷药物和顺铂还可激活信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1),增加促炎细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和核因子-κB(nuclear factor κB,NF-κB)的产生,进而激活半胱氨酸天冬氨酸蛋白酶(caspase)家族中caspase-3和caspase-49,最终导致细胞凋亡[11]。
此外,钙离子(Ca2+)也会影响细胞凋亡,Ca2+在细胞膜上是以与磷酸肌醇酯相结合的状态存在的,由于氨基糖苷类药物和顺铂等也会与磷酸肌醇酯结合,竞争性结合后,胞内Ca2+释放,胞外Ca2+增多,大量的Ca2+会通过MET等通道进入毛细胞内,从而激活胱天蛋白酶凋亡通路,导致听觉系统损伤[13]。
3 氨基糖苷类药物和顺铂致耳毒性的影响因素
当人体内某些基因发生突变时,使用这两类药物导致耳毒性的风险会大幅增高。研究表明,当特定的线粒体基因(如A1555G、C1494T、T1095C、A839G和A1027G)发生突变时,会使氨基糖苷类药物与线粒体核糖体有更好的亲和力,导致蛋白质合成过程中mRNA的错误翻译,最终导致细胞死亡[7]。顺铂致耳毒性发生也与特定的基因有关,张维真等[14]确定了TPMT和COMT基因的变异与顺铂诱导的儿童听力损伤相关。还有证据表明ACYP2基因变异也与顺铂诱导的耳毒性有关[15]。
此外,给药频率及患者年龄也会影响耳毒性的发生。在对药物清除率的研究中发现,依替米星在大鼠内耳清除半衰期(t1/2)为(155.96±19.95),在耳组织的清除t1/2远长于在血浆的t1/2,表明其在体内的清除速度缓慢[16]。若长期服用,或短期频繁使用,容易造成药物蓄积,使药物穿过血-迷路屏障((blood-lybrinth barrier,BLB),蓄积于内淋巴液中,从而损伤内耳毛细胞[17]。患者年龄也会影响耳毒性的发生,儿童患者内耳累积量高于普通成年人,其原因可能与儿童患者肾小球、肾小管发育不全导致清除率低有关[18]。
4 中药对氨基糖苷类药物和顺铂致耳毒性抑制作用的研究进展
4.1 中药单体化合物对氨基糖苷类药物和顺铂致耳毒性的抑制作用 见表1。
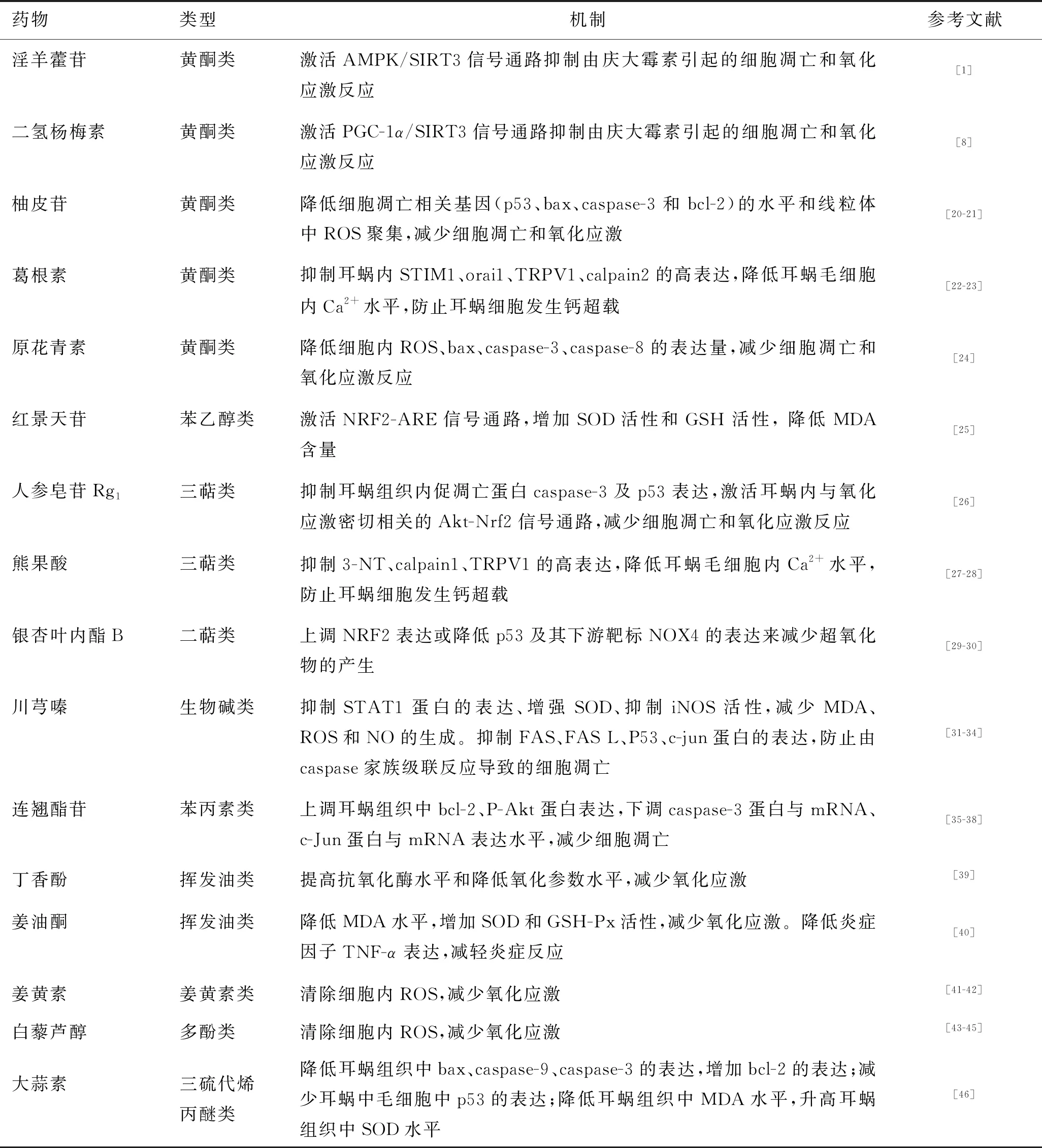
表1 中药单体化合物对氨基糖苷类药物和顺铂致耳毒性的抑制作用
4.1.1淫羊藿苷 淫羊藿苷已被证实能抑制细胞自噬,从而减少细胞凋亡[19]。胡月[1]在庆大霉素耳毒性模型中发现,庆大霉素还可以通过激活与氧化应激密切相关的腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)/沉默信息调节因子3(sirtuin 3,SIRT3)信号通路抑制氧化应激来发挥耳毒性抑制作用。
4.1.2二氢杨梅素 韩贺舟[8]用庆大霉素构建氨基糖苷类药物耳毒性模型,结果发现,二氢杨梅素可通过激活过氧化物酶体增殖物活化受体γ协同刺激因子-1α(peroxisome proli-ferator-activated receptorgamma coactivator,PGC-1α)/去乙酰化酶蛋白sirtuin 3(SIRT3)信号通路抑制由庆大霉素引起的细胞凋亡和氧化应激反应,进而发挥耳毒性抑制作用。
4.1.3柚皮苷 柚皮苷在不影响氨基糖苷类药物抑菌效果和顺铂抗肿瘤效果的前提下,可以降低与细胞凋亡相关的caspase-3、P53蛋白、bcl-2相关的X基因(bcl-2-associated X protein,BAX)和B淋巴细胞瘤-2(B-cell lymphoma-2,bcl-2)表达的水平和线粒体ROS自由基的水平从而降低耳毒性[20-21]。
4.1.4葛根素 马婷婷等[22-23]研究发现,葛根素通过降低耳蜗内基质交感分子1(stromal interaction molecule,STIM1)、orai1瞬时感受器电位、TRPV1、钙蛋白酶2(calpain2,CAPN2)的高表达,抑制耳蜗细胞发生钙超载,减轻顺铂致耳毒性。
4.1.5原花青素 原花青素可使细胞内ROS自由基含量降低,bax、caspase-3、caspase-8表达量降低[24]。
4.1.6红景天苷 红景天苷通过激活核因子E2相关因子2(nuclear factorerythroid 2-related factor 2,NRF2)/抗氧化反应元件(antioxidant response element,ARE)信号通路,增加SOD活性和GSH活性, 降低丙二醛 (malondialdehyde,MDA)含量,发挥抗氧化作用,减轻耳蜗毛细胞损伤[25]。
4.1.7人参皂苷Rg1人参皂苷Rg1可使耳蜗内氧化水平降低,减轻豚鼠内耳外毛细胞及螺旋神经节的损伤。研究表明,其主要是通过抑制耳蜗组织内促凋亡蛋白caspase-3及p53的表达,激活耳蜗内与氧化应激密切相关的蛋白激酶B(protein kinase B,Akt)/ Nrf2信号通路发挥作用的[26]。
4.1.8熊果酸 熊果酸可拮抗顺铂导致的小鼠耳毒性,其通过抑制3-硝基酪氨酸(3-nitro-l-tyrosine,3-NT)、钙蛋白酶1(calpain1,CAPN1)、TRPV1的高表达以及细胞内Ca2+的浓度,从而改善顺铂导致的听力损伤程度[27-28]。
4.1.9银杏叶内酯B 银杏叶内酯B通过上调Nrf2的表达或降低促凋亡因子P53及其下游靶标NOX4的表达水平来减少超氧化物的产生[29-30]。
4.1.10川芎嗪 在对顺铂的研究中,杨佳慧等[31]研究发现,川芎嗪可抑制信号转导和转录激活 (signal transducer and activator of transcription,STAT)家族中STAT1蛋白的表达, 减少细胞内ROS的生成, 继而抑制由细胞氧化反应引起的细胞凋亡或坏死。冷辉等[32-33]研究发现,川芎嗪通过抑制顺铂与细胞膜表面的自杀相关因子(fatty acid synthase,FAS)及其配体(fatty acid synthase,FASL)结合、抑制促凋亡基因p53的表达、抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族的重要成员c-jun氨基末端激酶 (c-junN-terminal kinase,JNK)及其下游蛋白的表达,来防止细胞凋亡执行阶段关键蛋白caspase-3的活化,从而抑制由caspase家族级联反应导致的细胞凋亡。在对氨基糖苷类药物的研究中还发现,川芎嗪通过提高SOD含量抑制MDA产生,或通过抑制iNOS活性的异常增高, 减少NO的过量生成, 从而减少自由基生成, 保护耳蜗组织免受氨基糖苷类药物毒性的破坏[34]。
4.1.11连翘酯苷 连翘酯苷在一定程度上可以防治顺铂所致的耳蜗损伤,其机制与上调耳蜗组织抑凋亡蛋白bcl-2的表达,下调caspase-3蛋白、c-jun蛋白表达水平有关[35-37]。此外,赵安未等[38]研究表明,与顺铂组相比,使用连翘酯苷后,豚鼠耳蜗磷酸化蛋白激酶B(phosphorylated Akt protein,P-Akt)表达水平升高,表明连翘酯苷对耳蜗的保护作用也可能与上调P-Akt表达有关。
4.1.12丁香酚 丁香酚可通过提高抗氧化酶水平和降低氧化参数水平来保护内耳毛细胞,其抗氧化活性来自其甲氧基酚结构[39]。
4.1.13姜油酮 姜油酮可致大鼠耳蜗内MDA水平明显降低,SOD和GSH-Px明显升高,炎症相关因子TNF-α表达降低。表明姜油酮主要通过抵抗氧化应激和炎性反应预防耳毒性[40]。
4.1.14姜黄素 姜黄素可能是一种自由基清除剂。研究发现,与对照组相比,顺铂可增加1.2 倍ROS的量[41]。当与姜黄素类化合物CLEFMA和EF24 联合使用后,ROS降低,且姜黄素联合顺铂组的细胞凋亡率明显低于顺铂组[42]。结果表明,姜黄素可能通过清除顺铂产生的ROS,减少细胞凋亡发挥抗耳毒性作用。
4.1.15白藜芦醇 白藜芦醇预防顺铂耳毒性的有效性已在多项研究中得到证实,其主要通过减少ROS增强抗氧化作用从而抑制耳毒性[43-45]。
4.1.16大蒜素 大蒜素能显著降低耳蜗组织中bax、caspase-9、caspase-3的表达,增加bcl-2的表达,减少顺铂诱导的螺旋神经节神经元中线粒体的损伤,同时减少耳蜗中转、底转外毛细胞p53的表达及耳蜗中转支持细胞中p53的表达,保护耳蜗外毛细胞和支持细胞的凋亡。大蒜素还能降低耳蜗组织中MAD水平,升高耳蜗组织中SOD的水平,通过抗氧化作用抑制顺铂诱导的耳蜗损伤[46]。
4.2 中成药及中药方剂对氨基糖苷类药物和顺铂致耳毒性的抑制作用 见表2。

表2 中成药对氨基糖苷类药物和顺铂致耳毒性的抑制作用
4.2.1刺五加注射液 刺五加注射液可通过降低外源性谷氨酸的浓度,减少Ca2+大量内流,发挥抗耳毒性作用[47]。胡文良等[48]通过实验证明,刺五加干预后螺旋神经节磷酸化P38丝裂原活化蛋白激酶(P-P38 mitogen-activated protein kinase,P-P38MAPK)的表达降低,表明刺五加可能通过抑制P-P38MAPK蛋白的表达,清除自由基,从而抑制耳蜗细胞凋亡。
4.2.2丹参注射液 丹参注射液可抑制iNOS表达,减少NO合成,减少细胞毒性和细胞凋亡[49]。
4.2.3复方健耳剂 复方健耳剂中含有黄芪、丹参、骨碎补、葛根等药材,通过上调硫氧还蛋白-1(thioredoxin-1,Trx-1)、硫氧还蛋白-2(thioredoxin-2,Trx-2) mRNA表达减少氧化还原反应,下调凋亡信号调节激酶1 (apoptosis signal-regulating kinase 1,ASK1) mRNA的表达,减少细胞凋亡[50]。
4.2.4柴胡聪耳汤 柴胡聪耳汤中含有连翘、柴胡、炙甘草等药材,通过提高SOD、CAT含量,降低MDA含量,减少氧化应激反应,减轻庆大霉素诱发的耳毒性[51]。
5 结论
中药对氨基糖苷类药物和顺铂致耳毒性的抑制机制主要通过以下几个方面:一是激活与氧化应激密切相关的AMPK/SIRT3、PGC-1α/SIRT3、NRF2/ARE、Akt/Nrf2等信号通路,提高SOD和GSH-Px的活性,减少MDA和ROS的产生,防止过氧化导致细胞凋亡;二是抑制3-NT、Calpain1、TRPV1的表达,降低耳蜗毛细胞内Ca2+水平,防止耳蜗细胞发生钙超载导致细胞凋亡;三是抑制炎症因子,如TNF-α的表达,减少炎症产生,防止细胞凋亡;四是抑制iNOS表达,减少NO过度产生,防止NO与自由基反应生成毒性更强的物质导致细胞凋亡;五是直接上调抗凋亡蛋白bcl-2和P-Akt的表达,或下调凋亡蛋白如bax、p53、c-jun的表达,抑制caspase家族级联反应,防止细胞凋亡。
上述用于预防氨基糖苷类药物和顺铂致耳毒性的中药单体化合物中,抗氧化剂最多,且黄酮类化合物最多。大多数耳毒性抑制中药研究对象为单体化合物,中成药对氨基糖苷类和顺铂致耳毒性的抑制研究较少。
中医认为耳毒性属于瘀毒的范畴,其主要与肾精亏虚有关,古典医集中有肾气充实则耳聪、肾气虚败则耳聋之说,因此可以通过行气解毒、化瘀通络、补肾气来抑制氨基糖苷类和顺铂致耳毒性[52-53]。在补肾药中开发能有效预防或减轻氨基糖苷药物和顺铂致耳毒性的药物也是未来药物研究的一个潜在方向。
内耳是一个复杂的立体腔隙结构,其组织取材过程较其他组织复杂,同时对于特定检测指标的定位及定量评判需要更加专业的知识,导致了该领域技术发展缓慢[54]。内耳BLB的存在,使普通药物难以直接作用于目标靶点,增加了治疗难度。目前大多数患者主要依靠助听器和人工耳蜗等辅助设备接收声音,但这些设备都存在分辨率差的缺点。但在很多场合下,多数听障人士虽然可以听到声音,却无法分辨声音,可能与周边环境嘈杂及助听器和人工耳蜗技术发展受限有关。未来改善听力的方式或许可以向脑机接口等方向发展,用体外设备将声音接收,无需经过内耳途径,直接与脑机接口连接,成为人们所理解的语言。

