老年人营养不良多学科决策模式中国专家共识(2023)
马丽娜,吉彤,李海龙,陈旭娇,张新军,冯辉,吴心音,陈彪,张存泰,于普林,陈琼,李耘,中华医学会老年医学分会
1.首都医科大学宣武医院老年医学科,国家老年疾病临床研究中心,北京 100053;2.中国医学科学院 北京协和医学院 北京协和医院临床营养科,北京 100730;3.浙江医院老年病科,杭州 310013;4.四川大学华西医院老年医学科,国家老年疾病临床医学研究中心,成都 610041;5.中南大学湘雅护理学院,长沙 410013;6.中南大学湘雅公共卫生学院,长沙 410078;7.华中科技大学同济医学院附属同济医院老年病科,华中科技大学同济医学院附属同济医院老年病研究所,武汉 430030;8.北京医院 国家老年医学中心 国家老年疾病临床医学研究中心 中国医学科学院老年医学研究院,北京 100730;9.中南大学湘雅医院,国家老年疾病临床医学研究中心,长沙 410008
我国人口老龄化进程不断加快,2020年我国60岁及以上人口已高达18.70%,65岁及以上人口达到13.50%[1]。老年人发生营养不良的风险较高,尤其是多病共存或患有严重疾病者。中国社区老年人营养不良和营养不良风险合并患病率为41.2%[2],这会降低老年人健康水平,增加相关医疗花费[3]。由于老年人营养不良常合并多个器官功能的减退、多重用药和精神心理障碍等多方面的问题,因此传统的单一学科诊疗模式往往难以达到理想效果。2020年,世界卫生组织(WHO)针对全球老龄化提出“2020—2030年健康老龄化行动十年计划”,强调了医务人员之间应该加强沟通及团队合作,建议由老年医学专家、全科医生、护士、药剂师、营养师、康复治疗师、心理学家和社会工作者等不同专业人员组建的多学科团队对老年患者进行全人综合管理[4]。为全面改善老年人营养不良,积极促进健康老龄化,实现“健康中国2030”的战略目标,我们组织了老年医学多学科专家团队,经过多轮会议讨论和修改,制定了《老年人营养不良多学科决策模式专家共识(2023)》。本共识参考国内外老年营养不良相关的最新指南和研究进展,并结合专家团队的临床实践经验制定而成,以期为临床全面管理老年人营养不良提供参考。
1 营养不良的定义
营养不良是指由于摄入不足或利用障碍引起能量或营养素缺乏的一种状态,伴有或不伴有炎症(导致代谢需求增加),导致身体成分和身体细胞质量发生改变(特别是去脂体重的降低),从而对躯体和心理功能乃至临床结局产生不良影响[5]。由欧洲临床营养和代谢学会(European Society for Clinical Nutrition and Metabolism,ESPEN)、美国肠外肠内营养学会(American Society for Parenteral and Enteral Nutrition,ASPEN)、拉丁美洲联盟肠外肠内营养学会和亚洲肠外肠内营养学会多个临床营养学会的代表组成的核心领导委员会共同探讨形成的营养不良全球领导人倡议(the Global Leadership Initiative on Malnutrition,GLIM)标准共识于2018年在多个网站发表,这是第一个关于营养不良诊断标准的国际标准和共识[6],对于营养不良的规范化诊疗具有重要意义。
2 流行病学
老年人营养不良的患病率受不同的医疗环境、伴随疾病及筛查和评估工具的影响[7-8]。一项基于微型营养评定(mini nutritional assessment,MNA)量表评估老年人营养不良的荟萃分析显示,在不同环境中老年人营养不良的患病率从3%(社区)到29.4%(康复/亚急性护理机构)不等[9]。根据GLIM标准应用不同的营养筛查工具对国内同一医疗环境中≥70岁的老年人进行评估发现,营养不良的患病率在25.4%~32.6%范围内波动[10]。营养不良会增加老年人不良临床结局的风险,如躯体功能下降、认知功能下降、抑郁、衰弱、肌少症、住院时间延长、生活质量下降、感染风险增加、死亡率上升及相关医疗花费增加[3,11-13]。
共识1:老年人营养不良的患病率高,导致或加重多种负性临床事件,需要早期识别和干预以改善预后。
3 发病机制与危险因素
低摄入、高需求以及能量和营养的生物利用率受损是营养不良的主要致病机制[14]。内部和外部诸多因素都会影响老年人的营养状况[15](见图1)。内部因素是在衰老过程中人体器官结构和功能的退化,功能储备减少。随着年龄增长,老年人的身体功能包括消化功能、咀嚼和吞咽功能、味觉、心理和认知状态以及内分泌、心脏、肺和肾脏功能等出现不同程度的下降[16-21],致使能量摄入和消耗不平衡,最终导致营养不良。外部因素包括环境、社会经济因素、多重用药、住院和不良生活方式等[22-23]。其中,躯体功能减退、无法独立进食、食欲减退、健康状况差和住院是老年人营养不良的决定因素[24]。
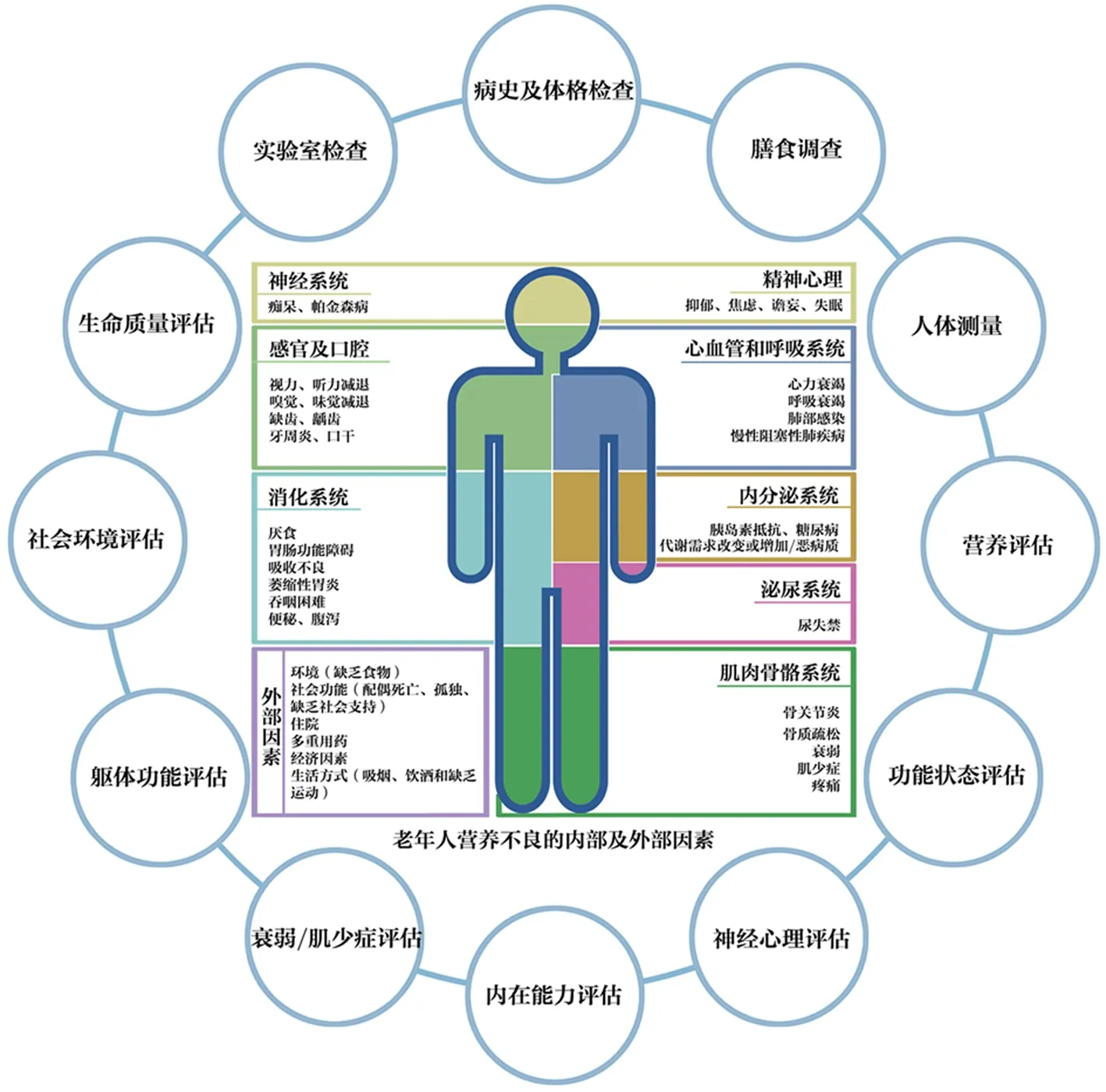
图1 老年人营养不良的内部及外部因素以及营养综合评估的流程
共识2: 影响老年人营养不良的危险因素复杂,包括年龄、器官功能储备、疾病、精神状况等内部因素,以及环境、社会经济水平、生活方式等外部因素,提示老年营养不良需要多维度、多学科共同评估及干预。
4 营养不良的“筛查-多重干预-联合管理”多学科决策模式
4.1 营养不良的多模式、多学科干预及管理
4.1.1 多学科营养支持团队的发展历史 1968年,人类历史上第一次使用肠外营养(parenteral nutrition,PN)进行营养支持,但进行PN时败血症的发生率高[25]。为了降低感染发生率,为需要PN的患者更好地提供营养支持,1972年首次报道了营养支持团队(nutrition support team,NST)[26]。1976年ASPEN以及1979年ESPEN相继成立,促进了NST的临床应用和发展[27]。1992年英国肠外和肠内营养学会(British Association for Parenteral and Enteral Nutrition,BAPEN)成立,描述了NST是一个由不同学科组成的团队,具备良好的沟通能力,能够以最佳方式为患者提供营养支持[25]。2013年中华医学会肠外肠内营养学分会(Chinese Society for Parenteral and Enteral Nutrition,CSPEN)提出老年人营养不良的诊治需要NST干预[28]。2018年ESPEN指南建议老年人的营养管理需要多模式和多学科团队干预策略,保证充足的饮食摄入,改善功能和临床结局[29]。2020年《中国老年患者肠外肠内营养应用指南(2020)》开篇提出多学科NST联合管理[30]。2022年《老年人营养不良防控干预中国专家共识(2022)》提出组建以老年医学专家牵头的多学科营养支持团队,进行综合营养管理及干预[31]。研究显示,NST营养支持可有效控制成本(提高治疗质量、避免不必要的干预和简化管理),这尤其符合现代医疗保健政策[27,32-34]。荟萃分析显示,多学科营养支持可能对降低老年患者的死亡率产生积极的影响,并能改善其生活质量[35]。一项多中心、随机、对照试验[36]证实了早期NST参与的营养支持可以改善营养不良住院患者死亡等不良临床结局。老年综合征智慧防控技术综合示范研究课题组在国家重点研发计划的支持下正在开展的基于多学科团队决策的中国老年人营养不良管理研究(3M研究)[37],希望能为NST提供进一步的循证依据。图2为营养不良的“筛查-多重干预-联合管理”的多学科决策模式。

注:MNA-SF为微型营养评估简表;NRS2002为营养风险筛查2002;GLIM为全球营养不良领导人倡议;BMI为体重指数;ASMI为四肢骨骼肌质量指数;DXA为双光能X线;BIA为生物电阻抗;FFMI为去脂体重指数。图2 营养不良 “筛查-多重干预-联合管理”的多学科决策模式
4.1.2 多学科营养支持团队的成员、职责及干预措施 多学科团队成员包括1名老年医学科医师、2名临床专科护理人员、1名营养科医师、1名临床药师、1名康复师和若干名其他专科的医师[38-42],要求每位成员熟练掌握相关领域的诊疗技术。其中,老年医学科医师发挥核心管理作用,包括整合团队诊疗意见、管理患者等,临床专科护士、营养师、临床药师、康复师为团队的主要成员,口腔科、外科、神经科、心理科等临床专科医师为管理团队提供技术保障(图2)。
共识3:老年人营养不良管理应采用“筛查-多重干预-联合管理”的多学科决策模式,定期随访,保证充足的膳食摄入,以改善功能和临床结局。
4.2 营养不良的筛查-诊断-评估
4.2.1 营养不良的筛查 营养筛查是营养不良多学科决策模式的第一步,使用适当的和经过验证的工具对入住医疗机构的所有老年患者(不受特定疾病诊断的影响,包括超重和肥胖)在24 h内进行规范的筛查,以尽快确定风险人群[43]。此后,根据患者的情况定期进行筛查(例如,病情稳定、长期照护的老年人每3个月1次,基层社区老年人至少每6个月或1年1次),尽早识别有风险的个体[31]。
目前用于老年患者的营养筛查工具非常多[44-51],例如微型营养评定简表(Mini-nutritional assessment short-form,MNA-SF)、营养风险筛查2002(Nutritional risk screening 2002,NRS2002)、营养不良通用筛查工具(The Malnutrition Universal Screening Tool,MUST)、简化的营养食欲调查表(Simplified Nutritional Appetite Questionnaire,SNAQ)、营养不良筛查工具(Malnutrition Screening Tool,MST)和患者主观整体评估(Patient-Generated Subjective Global Assessment,PG-SGA)等。表1列举了针对老年人的营养筛查评估工具及其应用的场所和人群。根据《中国老年患者肠外肠内营养应用指南》的推荐及《老年人营养不良防控干预中国专家共识》意见,对于老年住院患者推荐使用MNA-SF和NRS2002进行营养筛查[30-31]。GLIM共识建议对老年人采用MNA-SF进行营养不良筛查[6]。对中国老年住院患者的研究发现,与NRS2002及MUST相比,采用MNA-SF量表进行筛查可能是进行营养不良诊断更可靠的方法[52]。
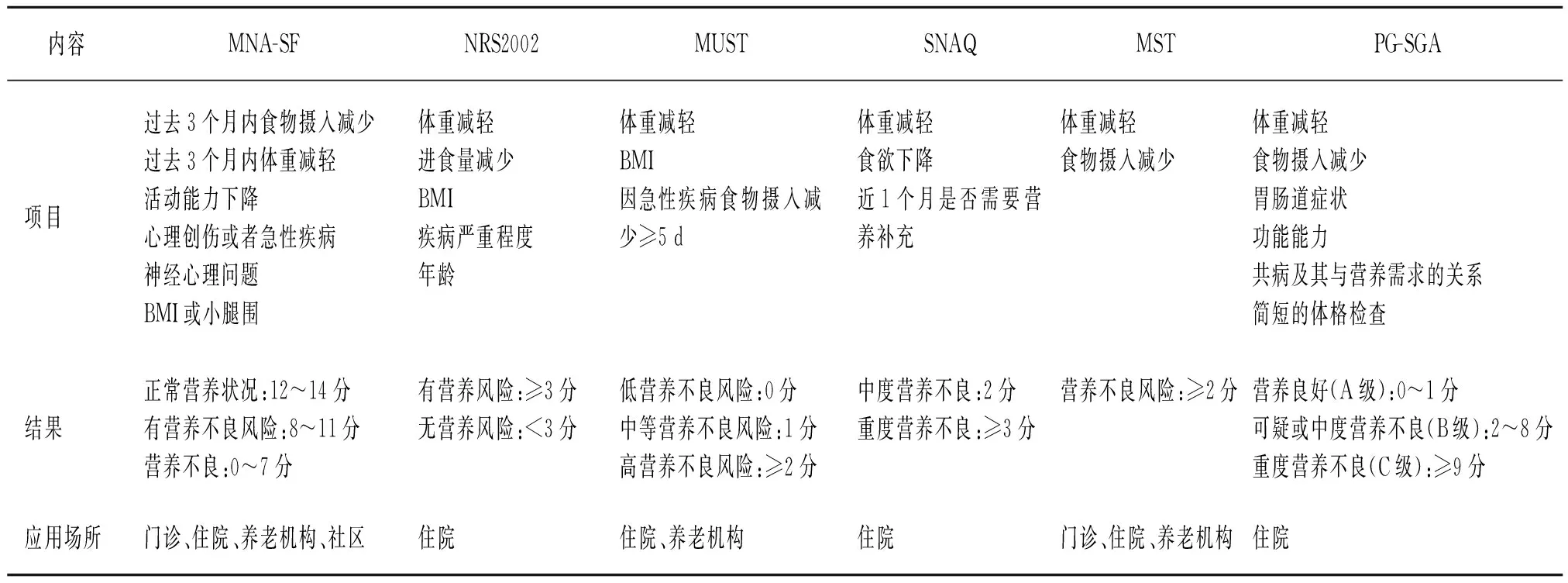
表1 老年人营养不良或营养风险的有效筛查评估工具及应用场所和人群
共识4:所有老年患者(不受特定疾病诊断的影响,包括超重和肥胖)应定期使用经过验证的工具进行营养筛查,以确定风险人群。本共识建议使用MNA-SF或NRS2002进行营养筛查。
4.2.2 营养不良的诊断 营养不良多学科决策模式的第二步是应用特定的标准来诊断营养不良(见图2)。GLIM共识发布的这些具体标准的最新版本在国内外得到了广泛应用[6,53]。GLIM标准提出两步骤流程:营养不良的筛查-诊断和程度分级。通过初步筛查识别有营养不良风险的患者,随后进行更深入的评估以诊断营养不良并对其严重程度进行分级。营养不良的诊断标准需满足至少1项营养不良表型标准和1项病因学诊断标准,并根据营养不良表型指标将营养不良分为中度和重度[6]。
表型标准包括非自愿性体重减轻、低体重指数(BMI)、肌肉质量减少。其中,过去6个月内体重减轻>5%或超过6个月体重减轻>10%被认定为非自愿体重减轻;患者年龄为<70岁,BMI<18.5 kg/m2或年龄≥70岁,BMI<20 kg/m2被认定为低BMI。肌肉质量减少参照GLIM肌肉质量评估小组制定的相关指南进行定义[54]。如果临床条件允许,优先选择双能X线吸收法(dual-energy X-ray absorptiometry,DXA)、生物电阻抗(bioelectrical impedance analysis,BIA)、CT或超声来评估肌肉质量减少[54]。
肌肉质量采用四肢骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI)评估时,若使用DXA法,男性ASMI<7 kg/m2,女性ASMI<5.4 kg/m2被认为肌肉质量减少[54];若使用BIA法,男性ASMI<7 kg/m2,女性ASMI<5.7 kg/m2被认为肌肉质量减少。当采用去脂体重指数(fat free mass index,FFMI)进行评估时,男性FFMI<17 kg/m2,女性FFMI<15 kg/m2被认为肌肉质量减少;如果无法使用这些定量检测工具,也推荐使用小腿围、上臂围等检测肌肉质量,需要尽可能使用经过有效验证的种族和性别特异的界值,不推荐使用骨骼肌功能来代替测量肌肉质量。本共识小腿围的界值采用亚洲肌少症工作组的建议[55],男性小腿围<34 cm,女性小腿围<33 cm。
病因学标准包括食物摄入减少或吸收障碍和由于急性疾病/损伤或慢性疾病造成疾病负担或炎症。其中,食物摄入减少指食物摄入量≤50%的能量需要量持续1周,或食物摄入量减少超过2周或者合并任何影响消化和吸收的慢性胃肠状况。摄入/吸收障碍的症状包括吞咽困难、恶心、呕吐、腹泻、便秘或腹痛;慢性胃肠道疾病包括短肠综合征、胰腺功能不全、减肥术后、食管狭窄、胃轻瘫和假性肠梗阻。疾病负担或炎症依靠临床诊断和化验结果,其中急性疾病/损伤相关炎症指严重的炎症可能与严重感染、烧伤、外伤或闭合性头部损伤有关。慢性疾病相关炎症指肿瘤疾病、慢性阻塞性肺疾病、充血性心力衰竭、慢性肾衰竭等疾病。轻度的短暂性炎症不符合病因学标准[6]。
共识5:采用营养筛查工具发现有营养风险或营养不良风险的老年患者后,应根据GLIM标准明确营养不良的诊断和分级。
4.2.3 营养综合评估 一旦营养不良的诊断成立,多学科团队(老年医学科医师、老年专科护士、营养科医师等)应在48 h内进行全面详细地营养综合评估,为制定个性化的营养保健计划打下基础[56]。营养综合评估包括病史采集、膳食调查(24 h膳食回顾调查、食物频数法、饮食日记、数字成像技术监测饮食摄入[57]等)、体格检查(严重皮下脂肪丢失、肌肉萎缩、水肿等)、人体测量(体重、身高、BMI、上臂围、小腿围、皮褶厚度等)、功能状态(ADL、IADL、FIST[58]等)、人体成分(BIA、DXA等)、实验室检查(血红蛋白、视黄醇结合蛋白、淋巴细胞计数、低密度脂蛋白胆固醇、C反应蛋白、白蛋白、前白蛋白、肌酐、尿素氮、铁蛋白、锌、叶酸、维生素B12、维生素D、电解质等)和社会环境评估(受教育水平、家庭支持、环境、经济状况等)。此外,还需进行老年综合评估[30],如神经心理状态(痴呆、抑郁等)、肌少症和衰弱(衰弱表型、衰弱指数、FSQ[59]等)、躯体功能[握力、步速、简易体能状况量表(SPPB)等]、社会支持、睡眠障碍、感官(视力、听力、嗅觉、味觉等)、口腔状况、疼痛、内在能力等[30]。通过评估寻找并尽量消除影响老年人营养不良的因素,尽早筛查出高风险老年人群,预防跌倒等不良事件发生。营养综合评估需要多学科团队成员共同分析从评估中获得的信息,全面、准确地分析有助于提供个性化和有效的营养干预和监测。营养综合评估的流程详见图1。
共识6:老年人营养不良诊断确定后,多学科团队应在48 h内展开营养综合评估及分析,为提供个性化的干预策略提供基础。
4.3 营养不良的干预策略
4.3.1 营养干预策略 本共识参考目前最新老年人营养不良指南如2022版欧洲临床营养和代谢协会(ESPEN)指南[43]、美国肠外和肠内营养学会(ASPEN)指南[60]及我国肠外肠内营养学会指南[30-31],制定了营养干预策略流程(见图3)。在营养干预的过程中,不同阶梯之间可以同时使用。

注:SPN为补充性肠外营养;TPN为全肠外营养;PN为肠外营养。图3 营养不良及营养风险老年患者营养干预策略流程图
4.3.1.1 营养干预的治疗目标 要求满足4个营养素指标达标,分别是:≥70%的能量目标需求,90%的液体目标需求,100%的蛋白质目标需求和100%的微量营养素目标需求[61]。
在营养干预前对老年患者每日能量需要量进行估算。热量目标估算常用方法为间接测热法、拇指法则和公式预测法。间接测热法是公认的测量静息能量代谢的金标准[62],但测量仪器价格昂贵,操作复杂。国内外指南推荐老年患者的能量目标量为20~30 kcal·kg-1·d-1[30-31],其可改善预后,降低病死率。目前最常用的热量预测公式为Harris-Benedict公式[63],可用其预测静息能量消耗,即基础代谢率(basal metabolic rate,BMR),但缺点为与实测值相差较大。因此本共识建议在有条件的情况下可以使用间接能量测定仪(代谢车)或者根据循证指南建议20~30 kcal·kg-1·d-1(1 kcal=4.184 kJ)进行热量估算。多学科NST团队中的老年医学科医师、营养师、临床药师等根据患者的营养状况、体力活动水平、疾病状况及耐受程度对能量目标进行相应调整。根据国内外循证依据和指南,对于无肾功能不全等因素影响的老年住院患者建议每日膳食蛋白质总摄入量1.0~1.5 g/kg,可以选择易吸收的乳清蛋白。微量元素应在多学科NST的指导下进行个体化补充。关于液体目标,在适宜环境温度和一般活动强度下,在没有特殊临床情况(心力衰竭、肾衰竭等)时,推荐老年女性饮水量≥1.6 L/d,老年男性≥2.0 L/d(在适宜饮品的范围内,可根据个人喜好进行选择)[30-31,43,60]。
共识7:多学科团队成员根据营养综合评估结果,为患者制定个体化的热量目标值、蛋白质目标值、微量元素目标值及液体目标值。
4.3.1.2 营养教育及支持性干预 对老年患者进行营养教育的内容包括告知营养筛查及评估的目的、回答患者及其家属提出的关于营养不良的问题、查看并告知血液及检验结果、讨论个体化的营养干预目标、讲授营养知识和科普营养套餐,可采用科普读物、短视频等方式。在住院期间营造清洁整齐、空气新鲜、类似于家庭的用餐环境,促进食欲,鼓励其与他人共同用餐,增加合理的饮食摄入,并提供辅助用餐服务,进行用餐指导(进餐姿势指导、不良习惯纠正),鼓励自主进餐,及时处理恶心、呕吐和呛咳等问题[30-31,43,60]。
4.3.1.3 营养咨询 多学科团队应为营养不良或有营养不良风险的老年人提供个性化的营养咨询,以保证充足的膳食摄入并改善或维持营养状况。个体化的营养咨询应由训练有素的营养师提供给营养不良或有营养不良风险的老年人和(或)其护理人员,咨询的形式可以是面对面咨询、电话咨询和书面建议相结合,为了保证营养咨询的有效性,咨询应持续较长时间(至少8周)[30-31,43,60]。一项系统综述显示,无论有无口服营养补充剂,营养咨询会轻微降低6个月的死亡率和住院率,并可减少并发症的发生(但不会减少住院时间)[64]。
共识8:作为多学科综合干预联合管理的一部分,团队成员应分工合作向营养不良或有营养风险的老年人提供个性化的营养信息、教育以及营养咨询服务,以提高老年人对营养问题的认识,促进充足的膳食摄入。
4.3.1.4 膳食强化 膳食强化指的是提供强化食品、额外的点心及丰富的改良食物。通过膳食强化可以增加老年人能量和蛋白质摄入量,改善临床结局[30-31,43,60]。可在两餐中间为老年人提供营养丰富的强化食品。在一项为有营养不良风险且接受长期护理的老年患者,在主餐和睡前提供3种零食的研究中发现,3周后和6周后能量摄入增加了大约30%[65]。同时,应向营养不良或有营养不良风险合并口咽吞咽困难和(或)咀嚼障碍的老年人提供质地改良的强化食品,作为保证充足膳食摄入的补偿策略[30-31,43,60]。研究显示添加维生素D的强化食品(牛奶、面包)可增加老年人维生素D的摄入[66]。
共识9:建议营养不良或有营养风险的老年人在两餐中间进行膳食强化,应注意为吞咽及咀嚼困难的老年人提供质地改良的强化食品,保证充足的能量摄入。
4.3.1.5 口服营养补充剂(oral nutritional supplements,ONS) 对于营养不良或有营养不良风险的老年人,当常规食物摄入量不能满足其机体目标量的60%时,ONS是首选的营养干预方式[30-31,43,60]。ONS既可以在饮食中代替部分食物,也可以作为加餐以增加营养摄入,每日至少提供400 kcal和(或)30 g蛋白质,餐间分次口服是ONS的标准营养干预疗法。ONS应至少持续1个月,在向老年人提供ONS时,应至少每月评估1次营养状况(体重)、食欲和临床情况,以监测干预效果和评估预期益处。为了保证老年人服用ONS的依从性,所提供的产品应适应其愿望和需要。目前ONS有多种多样的口味、形式、类型和能量密度(1~3 kcal/mL),可满足老年人不同的需求。为避免老年人对同一种ONS制剂产生厌倦,需要定期评估依从性。NOURISH研究对因心肺疾病住院的营养不良老年人从住院到出院后90 d补充高蛋白及添加β-羟基-β-甲基丁酸酯(β-Hydroxy-β-methylbutyric acid,HMB)的ONS,发现可提高握力,并有助于患者的整体康复[67]。
共识10:当常规饮食摄入量<机体能量目标量的60%时,根据营养综合评估结果,建议营养不良或者有营养不良风险的老年人补充ONS,应每月评估营养状况、食欲及依从性,根据患者的需求,可以更换ONS的口味、形式、类型和能量密度,增加ONS的依从性。
4.3.1.6 肠内营养(enteral nutrition,EN) 对预计无法进食>3 d或饮食摄入低于能量需求的50%达1周者,应立即启动管饲。部分研究表明,EN不仅可以改善患者的营养状况,还可以改善老年人功能、降低死亡率、提高生活质量[30-31,43,60]。EN的预期益处和潜在风险应单独评估,在病情变化时定期重新评估。对于疾病终末期的患者应提供舒适喂养,而不是EN。标准整蛋白配方适合大多数老年患者的EN,优化脂肪酸的配方长期应用可改善脂代谢和降低心血管事件的发生。膳食纤维有助于减少管饲EN腹泻和便秘发生,膳食纤维摄入≥25 g/d有助减少管饲患者的便秘和改善临床结局[30,43]。如果患者需要EN的时间小于4周,优先选择鼻饲管,而不是经皮内镜下胃造瘘术(percutaneous endoscopic gastrostomy,PEG)或者经皮内镜下空肠造瘘术(percutaneous endoscopic jejunostomy,PEJ)。一项系统综述比较了鼻胃管喂养与PEG喂养对非卒中吞咽困难的老年患者的影响,发现与PEG喂养相比,使用鼻胃管喂养的患者肺炎和总体并发症风险没有显著差异[68]。对于预期需要EN≥4周,或不能接受及不能耐受鼻胃管的老年患者,建议选择PEG或者PEJ。与鼻胃管喂养相比,PEG喂养可能减少卧床或死亡的风险[69]。应鼓励管饲的老年患者在安全的情况下维持经口摄入食物的能力,如吞咽功能训练。老年营养不良患者,一旦有EN的适应证,应尽早开始EN;前3天应少量开始,根据耐受逐步增量,避免再喂养综合征的发生[70]。在对营养不良的老年人进行EN治疗的前3天应特别注意血液中的磷酸盐、镁、钾和硫胺素的水平,即使在轻度缺乏的情况下也应予以补充。一项关于营养支持的干预时间对接受EN患者营养状况影响的研究发现,早期NST干预可以改善患者的整体营养状况[33]。
4.3.1.7 肠外营养(parenteral nutrition,PN) 对于需要营养支持治疗的老年患者,EN摄入低于机体能量和蛋白质目标需要量的60%时,建议给予补充性肠外营养(supplementary parenteral nutrition,SPN)。老年患者胃肠功能严重障碍或不能使用EN时,建议给予全肠外营养(total parenteral nutrition,TPN)。老年患者PN建议采用全合一模式,将各种营养物质混合后输注,此方法更能满足生理需求,减少肝肾负担,降低单个营养素的浓度和渗透压,减少治疗相关不良事件的发生。对于有特殊营养需要的老年人,可开具自配型PN处方,满足个体化需求。一项系统综述显示,与标准护理相比,引入NST不仅降低了导管相关感染的发生率,而且降低了代谢并发症、死亡率和PN的不当使用率[32]。
4.3.1.8 营养监测 营养监测包括对患者临床症状及体征、能量供给达标情况、实验室检查(根据病情需要定期检测电解质、血糖、血脂、前白蛋白、白蛋白、C反应蛋白)、肠内和肠外营养并发症的监测和管理。营养支持并发症的防治包括管饲并发症(堵管、腹泻、误吸、消化道出血和造口管理)、再喂养综合征和PN的并发症(机械并发症、代谢并发症和感染并发症)[71]。院外干预期每半个月到1个月随访1次,干预期结束每3个月随访1次[71]。
共识11:根据老年患者的情况,预计无法经口摄入>3 d或饮食摄入低于能量需求的50%达1周时,应向老年人提供EN,以满足营养需求,维持或改善营养状况。若预计EN时间<4周,采用鼻饲管;若预计EN时间≥4周或者不耐受鼻饲管,选择PEG或者PEJ,在EN治疗的前3 d应逐步增量,严密监测营养状况,防止发生并发症。
共识12:根据个体的情况,在胃肠功能出现严重障碍,不能使用EN或者EN不能满足目标需要量的60%时,应启动PN,满足个体化需求,在治疗过程中应严密监测,避免发生并发症。
4.3.2 运动干预 在进行营养治疗的同时,积极运动和康复对于老年人来说是必要的,可有效治疗大多数非传染性慢性疾病和相关合并症,如认知障碍、衰弱、肌少症、营养不良、跌倒和失动[72]。一项荟萃分析显示,营养与运动相结合可以增加瘦体重和肌肉质量,从而改善肌肉功能[73]。相反,如果不运动而单纯提供营养支持并不能改善肌肉减少或衰弱[74-75]。一项系统综述[76]表明,单独运动或运动与营养相结合均可以改善营养不良老年人的肌肉力量和躯体功能。本共识鼓励营养不良和有营养不良风险的老年人在充足摄入营养的前提下,积极进行循序渐进的、有规律的运动及康复训练。由老年医学科医师主导,康复科医师根据患者综合评估情况,在形式、频率、持续时间和强度等方面制定个体化的运动康复方案。
WHO在“身体活动有益健康的全球倡议”中指出,65岁及以上的老年人每周应进行150 min中等强度或75 min高强度的有氧运动和2 d以上的抗阻运动[77]。2019年WHO发布的老年综合照护(Integrated Caring for Older People,ICOPE)指南中的VIVIFRAIL项目提供了复合模式运动训练方案[78]。VIVIFRAIL计划是一项以家庭为基础的锻炼计划,侧重于根据老年人的功能和能力进行个性化的多组分运动处方(www.vivifrail.com/resources/),包括抗阻、平衡、柔韧性和有氧运动。医务人员根据老年人的SPPB与跌倒风险量表的评估结果进行运动分级,并配有相应的运动手册。2021年国际衰弱和肌少症研究会议工作组提出了老年人最佳的维持功能能力的运动建议,制定包括抗阻、步态和平衡练习在内的多组分训练计划,以减少与衰弱和肌少症相关的不良健康后果[79]。2022年《老年人营养不良防控干预中国专家共识》提出了适合营养不良和有营养不良风险的老年人的康复训练方案及建议[31]。表2列出了目前国内外共识及工作组对于老年人的运动的建议及策略。

表2 国内外共识及工作组对老年人的运动建议及策略
共识13:在临床实践中,应根据营养综合评估的情况,在保证充足的热量和蛋白质摄入的基础上,多学科团队应为营养不良或有营养不良风险的老年人制定个体化的多组分运动计划和康复锻炼方案,以保持或改善肌肉质量和功能。
5 总结
老年人营养不良的患病率高,容易导致衰弱、肌少症、免疫力低下、生活质量下降甚至增加死亡风险,给个人和社会带来沉重的负担。通过早期识别和诊断,为营养不良老年人提供多学科个体化的干预措施,可以改善预后。多学科个体化的干预措施包括个性化的营养建议和营养咨询、ONS、膳食强化、根据需要进行EN或PN、运动干预。在临床工作中,应该充分发挥 NST的作用,使每位可能受益于营养支持的老年人都能快速、充分地获得最高质量标准的营养支持。
专家组(按姓氏笔画顺序排列):于普林(北京医院/国家老年医学中心);马清(首都医科大学附属北京友谊医院老年医学科);马丽娜(首都医科大学宣武医院老年医学科);王青(首都医科大学附属复兴医院老年医学科);王鹏(首都医科大学附属复兴医院老年医学科);王洁妤(首都医科大学宣武医院老年医学科);王晓娟(首都医科大学附属北京朝阳医院综合科);王晶桐(北京大学人民医院老年科);王翠丽(北京大学护理学院);牛慧彦(中国医科大学附属盛京医院老年医学科);毛拥军(青岛大学附属医院老年医学科);石艳清(福建医科大学附属协和医院老年医学科);田文(中国医科大学附属第一医院老年医学科);冯辉(中南大学湘雅护理学院);邢艳秋(山东大学齐鲁医院老年医学科);吕洋(重庆医科大学附属第一医院老年病科);吕继辉(北京老年医院精神心理科);刘晓蕾(四川大学华西医院老年医学科);刘慧珍(中国康复研究中心北京博爱医院急诊科);闫素英(首都医科大学宣武医院药学部);杜晓霞(中国康复研究中心北京博爱医院神经康复二科);李杰(吉林大学第一医院干部病房);李耘(首都医科大学宣武医院老年医学科);李理(北京老年医院老年示范病房);李新(天津医科大学第二医院老年病科);李静(首都医科大学宣武医院老年医学科);李缨(首都医科大学宣武医院营养科);李海龙(中国医学科学院北京协和医学院北京协和医院临床营养科);李菲卡(上海交通大学医学院附属瑞金医院老年病科);吴心音(中南大学湘雅公共卫生学院);吴秀萍(哈尔滨医科大学附属第一医院老年病科);何平(华中科技大学同济医学院附属协和医院老年病科);沈珊珊(浙江医院老年病科);张丽(首都医科大学宣武医院老年医学科);张钧(上海师范大学体育学院);张勤(浙江大学医学院附属第一医院老年病科);张巍(首都医科大学附属北京天坛医院认知障碍性疾病科);张存泰(华中科技大学同济医学院附属同济医院老年病科);张改改(清华大学第一附属医院北京华信医院老年医学干部医疗科);张艳红(首都医科大学宣武医院医务处);张新军(四川大学华西医院老年医学科);陈波(江苏省人民医院/南京医科大学第一附属医院老年医学科);陈彪(首都医科大学宣武医院国家老年疾病临床研究中心);陈琼(中南大学湘雅医院国家老年疾病临床研究中心);陈旭娇(浙江医院老年医学科);苗海军(新疆医科大学第一附属医院老年干部科);周厚广(复旦大学附属华山医院老年医学科);郑松柏(复旦大学附属华东医院消化内科/老年医学科);赵鲁卿(首都医科大学附属北京中医医院消化中心);胡坚(江西省人民医院干部病房);胡亦新(中国人民解放军总医院第一医学中心心血管内科);修双玲(首都医科大学宣武医院内分泌科);姜昕(深圳市人民医院老年医学科);秦明照(首都医科大学附属北京同仁医院老年医学科);夏经钢(首都医科大学宣武医院心脏科);钱力(山西医科大学第一医院老年病科);殷实(中国科学技术大学附属第一医院/安徽省立医院老年医学科);唐毅(首都医科大学宣武医院/国家神经疾病中心神经内科);曹剑(中国人民解放军总医院第一医学中心心血管内科);康琳(中国医学科学院北京协和医学院北京协和医院老年医学科);章晓燕(上海交通大学附属第六人民医院老年病科);寇京莉(首都医科大学宣武医院老年医学科);彭琳琳(中南大学湘雅医院老年病科);景丽伟(首都医科大学护理学院);廖赟(上海交通大学医学院附属同仁医院药学部);霍速(首都医科大学宣武医院康复医学科)

