桂枝茯苓胶囊通过调控NF-κB通路抑制卵巢癌细胞的迁移和诱导卵巢癌细胞的凋亡
郭晓娟,陈丽平,2,吕芹,杜瑞娟,2,罗琴,张阳,卞华,2,韩立,2
南阳理工学院1张仲景国医学院,2河南省张仲景方药与免疫调节重点实验室,河南 南阳 473004;3南阳医学高等专科学校中医系,河南 南阳473061
卵巢癌发病隐匿,大多数患者确诊即为中晚期,且已存在局部或远处转移,因此在女性生殖系统恶性肿瘤中死亡率最高,5年生存率约为46%[1]。与原发病灶相比,卵巢癌转移后,肿瘤细胞大多对常规化疗不敏感,产生耐药性,往往进一步促进卵巢癌的发展。上皮间质转化(EMT)在卵巢癌转移中具有重要作用,是一个动态和可逆的过程。EMT使具有极性的上皮细胞转化为具有移行能力的间质细胞,是肿瘤细胞侵袭和转移的关键启动步骤[2]。EMT过程中,上皮表型E-钙粘蛋白(CDH1)缺失或表达下调,间质表型N-钙黏蛋白(CDH2)表达上调。研究表明,核因子κB(NF-κB)通路激活可抑制CDH1表达,使细胞极性丧失,迁移能力增强,导致肿瘤转移和耐药[3]。抑制NF-κB可活化半胱氨酸蛋白酶-3(caspase 3)诱导凋亡,抑制肿瘤耐药和转移[4]。因此,靶向NF-κB是抑制肿瘤转移和耐药的有效治疗策略之一。
桂枝茯苓胶囊(GFC)是在张仲景《金匮要略》所载经方桂枝茯苓丸基础上采用现代工艺制备而成,由桂枝、茯苓、牡丹皮(去心)、赤芍、桃仁(去皮尖)组成,诸药合用共奏消瘕散结、活血化瘀功效。桂枝茯苓丸与临床常用的化疗方案联合用药治疗卵巢癌,其疗效优于单用化疗方案治疗,并可降低患者血清癌抗原125(CA125)水平[5-7],而NF-κB在CA125生成过程中发挥了重要作用[8]。此外,桂枝茯苓丸在人皮肤恶性黑色素瘤细胞中可下调EMT相关的TPT1-AS1[9],在S180小鼠转移瘤模型中抑制EMT相关的细胞黏附分子CD44的表达[10],提示该方具有潜在的EMT抑制作用,但相关机制研究并不深入。本课题组前期研究发现,采用桂枝茯苓丸制备的含药血清可通过诱导磷酸酶和张力蛋白类似物(PTEN)表达逆转卵巢癌耐药[11],而PTEN上调与抑制CD44表达直接相关[12]。然而,GFC是否靶向NF-κB影响卵巢癌的迁移尚不明确。本研究旨在探讨GFC抑制卵巢癌转移的作用,明确其靶向NF-κB 调控CDH1、CDH2和caspase 3的可能机制,为该方治疗卵巢癌转移提供依据。
1 材料和方法
1.1 材料
1.1.1 动物与细胞 雌性SPF Wistar大鼠60只,6~8周龄,体质量220±20 g,购自浙江维通利华实验动物技术有限公司,动物生产许可证号SCXK(浙江)2019-0001。所有动物实验操作和饲养均遵循实验动物福利及伦理要求(南理工动伦审[2020]004)。人卵巢癌顺铂耐药性SKOV3/DDP细胞购自浙江美森细胞科技有限公司,编号:CTCC-0118-NY。
1.1.2 药物与试剂 桂枝茯苓胶囊(江苏康缘药业股份有限公司,0.31 g/粒);NF-κB 抑制剂SN50(MedChemExpresss,纯度99.91%)。总RNA提取试剂盒(山东思科捷生物技术有限公司);RevertAid 第一链cDNA Synthesis 试剂盒(Thermo Fisher);QuantiNova SYBR Green PCR 试剂盒(QIAGEN);PE Annexin V Apoptosis Detection Kit(BD);Minute ™Total Protein Extraction Kit(Invent Biotechnologies);BCA蛋白浓度检测试剂盒(Thermo Fisher);速溶快速封闭颗粒、ECL化学发光试剂盒[密码子(中国)生物科技公司];胎牛血清、1640培养基(浙江美森细胞科技有限公司);重组CDH1兔单抗、重组CDH2兔单抗和重组NF-kB p65兔单抗(Abcam);caspase 3 兔多克隆抗体(Affinity Biosciences);HRP标记羊抗兔二抗(KPL);HRP标记GAPDH 鼠单抗(PROTEINTECH);TruePrepTMDNA Library Prep Kit V2 试剂盒(Vazyme,TD501)。
1.1.3 仪器 ABI ViiA7实时荧光定量PCR仪(赛默飞世尔公司);FACSCelesta流式细胞仪(BD);Tanon-5200凝胶化学发光成像系统(上海天能公司);Synergy H1全功能酶标仪(BioTek),Illumina Novaseq 6000 测序仪(Illumina)。
1.2 方法
1.2.1 含药血清制备 将60只Wistar大鼠随机分为空白血清组(-)、GFC低(+)、中(++)、高(+++)剂量组,15只/组。桂枝茯苓胶囊内容物用温水混悬后,根据临床用药剂量,以及人和动物给药剂量换算后[13],低、中、高剂量组分别按4、8、16 g·kg-1·d-1剂量,空白组给以等量生理盐水,连续灌胃5 d,各组分别于末次灌胃给药60 min后,采用2%戊巴比妥钠腹腔注射麻醉,0.3 mL/100 g。股动脉采血,室温静置2 h离心,分离含药血清,0.22 μm微孔滤膜过滤除菌,分装后置于-80 ℃冰箱备用。
1.2.2 划痕实验 SKOV3/DDP细胞置于5%CO2、37 ℃条件下培养在含10%胎牛血清、链霉素和青霉素各100 U·mL-1的RPMI 1640 培养基中,每3~4 d胰蛋白酶消化传代1 次。取对数生长期的SKOV3/DDP细胞,接种于6孔板,待过夜后细胞覆盖率达到90%,利用无菌200 μL枪头划痕,弃去培养基,PBS洗涤,加入培养基和不同药物。实验分组:空白血清组(-)、GFC低(+)、中(++)、高(+++)剂量组、18 μmol/L SN50组。根据文献和前期实验结果[11,14],空白血清和含药血清各组的血清比例均为10%,SN50组加入空白血清比例亦为10%。分别于给药后0 h、24 h,显微镜拍照观察,采用ImageJ分析各组图片,比较划痕愈合情况。
1.2.3 细胞凋亡分析 取SKOV3/DDP细胞接种于6孔板,细胞贴壁后分组同上。各组培养48 h后,胰酶消化,PBS洗涤细胞。按照凋亡检测试剂盒说明书处理后,采用流式细胞仪(BD FACSCelesta)检测细胞凋亡情况。
1.2.4 RT-qPCR分析 取对数生长期的SKOV3/DDP细胞,接种于12孔板,细胞贴壁后分组同上。各组细胞加药孵育48 h后,按照总RNA快速提取试剂盒说明书提取总RNA,逆转录合成cDNA,采用荧光定量PCR 仪(ABI ViiA7)扩增各目的基因,引物序列如下:CDH1:(F)CGAGAGCTACACGTTCACGG,(R)GGGTGTCG AGGGAAAAATAGG,产物长度119 bp;CDH2:(F)TGCGGTACAGTGTAACTGGG,(R)GAAACCGGG CTATCTGCTCG,产物长度123 bp;NF-κB:(F)CTGGC CTTTGAGTGCATCAC,(R)CGCTAACAACAATGT CCACCT,产物长度104 bp;caspase 3:(F)AGAACT GGACTGTGGCATTG,(R)CTTGTCGGCATACTGT TTCA,产物长度190 bp;GAPDH:(F)ACAACTTTG GTATCGTGGAAGG,(R)GCCATCACGCCACAGTT TC,产物长度101 bp。采用2-△△Ct法计算各药物处理组CDH1、CDH2和NF-κB mRNA相对于对照组表达量的变化,其中ΔΔCt=(Ct 目标基因-CtGAPDH)处理组-(Ct目标基因-CtGAPDH)对照组。
1.2.5 Western blot分析 SKOV3/DDP细胞处理和分组同上,各组细胞孵育48 h后,弃去培养基。蛋白裂解液裂解细胞,测定蛋白浓度。SDS-PAGE 电泳后转至PVDF膜,Kemix快速封闭液封闭,加入CDH1、CDH2、NF-κB、caspase 3蛋白一抗,室温孵育2 h,洗膜后加入对应HRP标记兔二抗室温孵育2 h,在Tanon 5200凝胶成像分析系统中进行化学发光显影。HRP直标GAPDH鼠单抗直接孵育2 h,化学发光检测内参GAPDH 条带。Image J软件分析成像蛋白条带,以目的蛋白条带灰度值/GAPDH蛋白条带灰度值计算各条带相对比值,以各药物处理组相对比值除以空白对照组相对比值计算蛋白相对表达量。
1.2.6 ATAC-seq测序 基于前述分析结果将SKOV3/DDP细胞分为空白血清组(-)和GFC中剂量含药血清组(++)。各组细胞以1×104接种于6孔板,待细胞贴壁后加入药物,继续培养48 h。收集细胞,离心去上清后裂解(裂解液组成:10 mmol/L Tris·Cl(pH 7.4),10 mmol/L NaCl,3 mmol/L MgCl2,0.1%(v/v)Igepal CA-630),根据TruePrepTMDNA Library Prep Kit V2试剂盒说明书建库,采用Illumina PE150 测序策略进行基于转座酶的染色质可及性高通量测序(ATAC-seq)。比较两组样品间ATAC-seq数据,检测出信号值存在显著差异的区域,即染色质差异开放区域(DAR),包括全部DAR(All DAR)、增强DAR(Gain DAR)和减弱DAR(Loss DAR)。DAR结果以人hg38为参考基因组,采用整合基因组浏览器(IGV)1.6.0版进行可视化分析。
1.3 统计学分析
所有数据以均数±标准差表示,采用Graphpad 9.0软件,对多个样本均数比较进行单因素方差分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 含药血清对SKOV3/DDP细胞迁移的影响
与空白对照组相比,GFC各剂量含药血清均能明显抑制SKOV3/DDP细胞迁移,且抑制作用逐渐增强(P<0.05,P<0.01);高剂量含药血清组对迁移的抑制作用与SN50组相比差异无统计学意义(P>0.05,图1、2)。

图1 各组细胞迁移变化Fig. 1 Scratch assay for assessing cell migration changes in each group(Original magnification:×40).
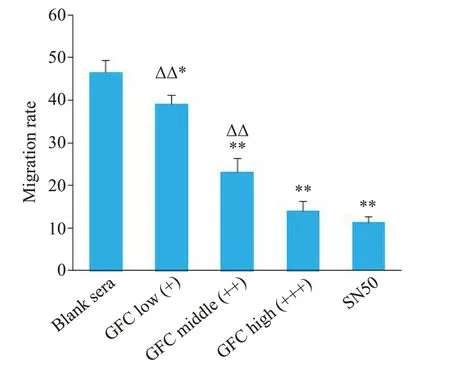
图2 各组细胞迁移率变化Fig. 2 Migration rates of the cells in each group.*P<0.05,**P<0.01 vs blank sera group;ΔΔP<0.01 vs SN50 group.
2.2 含药血清对SKOV3/DDP细胞凋亡的影响
与空白血清组相比,PE标记Annexin V早期凋亡细胞比例随着GFC含药血清剂量增加而增强(P<0.05,P<0.01);高剂量含药血清组诱导凋亡作用与SN50组相比差异无统计学意义(P>0.05,图3、4)。

图3 各组细胞凋亡变化Fig. 3 Flow cytometry for analyzing apoptosis of the cells in each group.A:Blank sera group.B:Low-dose GFC group.C:Medium-dose GFC group.D:High-dose GFC group.E:SN50 group.
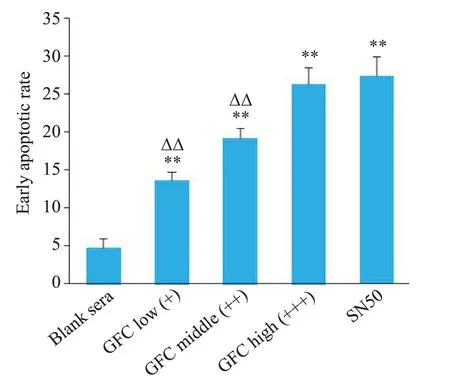
图4 各组细胞早期凋亡率变化Fig. 4 Early apoptotic rates in each group.**P<0.01 vs blank sera group;ΔΔP<0.01 vs SN50 group.
2.3 含药血清对CDH1、CDH2、caspase 3 和NF-κB mRNA表达的影响
与空白血清组相比,GFC含药血清各组可明显抑制SKOV3/DDP 中CDH2、NF-κB mRNA 表达,增加CDH1、caspase 3 mRNA表达,呈剂量依赖性(P<0.05,P<0.01);高剂量含药血清组对CDH2、NF-κB mRNA的抑制作用和对CDH1、caspase 3 mRNA 的诱导作用与SN50组相比差异无统计学意义(P>0.05,图5)。
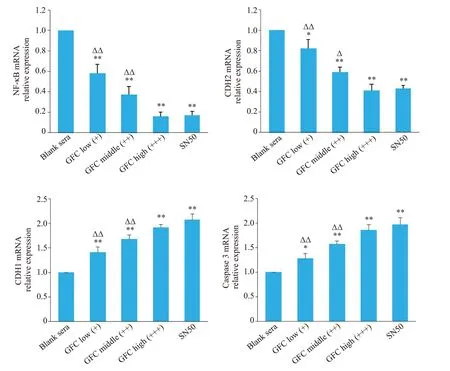
图5 各组细胞CDH1、CDH2、caspase 3 和NF-κB mRNA相对表达变化Fig. 5 Changes in relative expressions of CDH1,CDH2,caspase 3 and NF-κB mRNA in each group.*P<0.05,**P<0.01 vs blank sera group;ΔP<0.05,ΔΔP<0.01 vs SN50 group.
2.4 含药血清对CDH1、CDH2、caspase 3和NF-κB蛋白表达的影响
Western blot检测发现,GFC含药血清各组可明显抑制NF-κB、CDH2蛋白表达,增加CDH1、caspase 3蛋白表达(P<0.05,P<0.01);高剂量含药血清组对CDH2、NF-κB 蛋白的抑制作用和对caspase 3蛋白的诱导作用与SN50 组相比差异无统计学意义(P>0.05),但对CDH1 蛋白的诱导作用弱于SN50组(P<0.01,图6、7)。
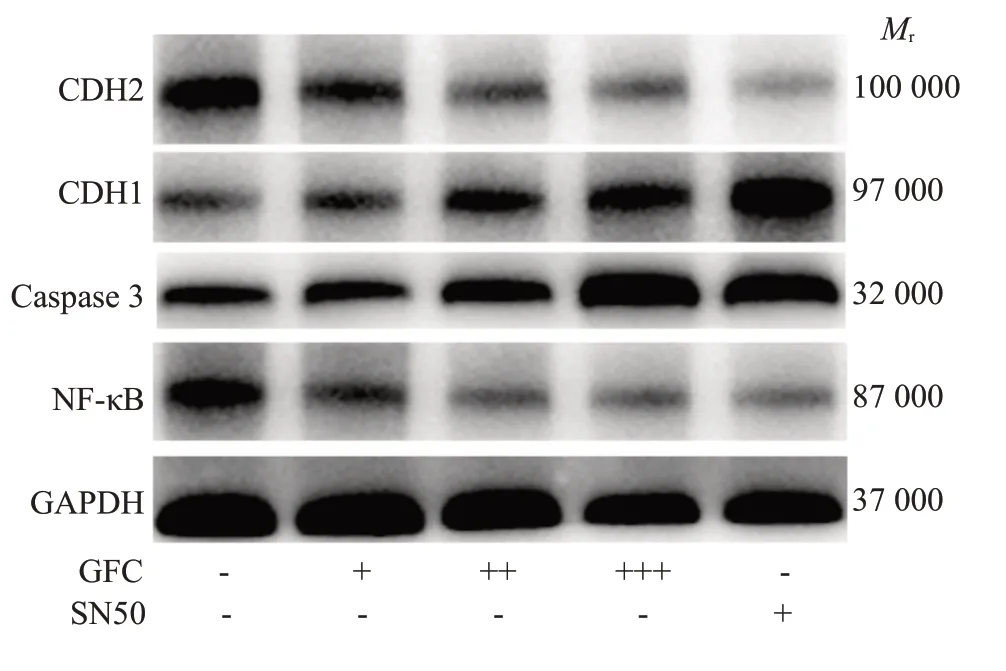
图6 各组细胞CDH1、CDH2、caspase 3 和NFκB蛋白表达变化Fig. 6 Changes in expressions of CDH1,CDH2,caspase 3 and NF-κB proteins in each group.
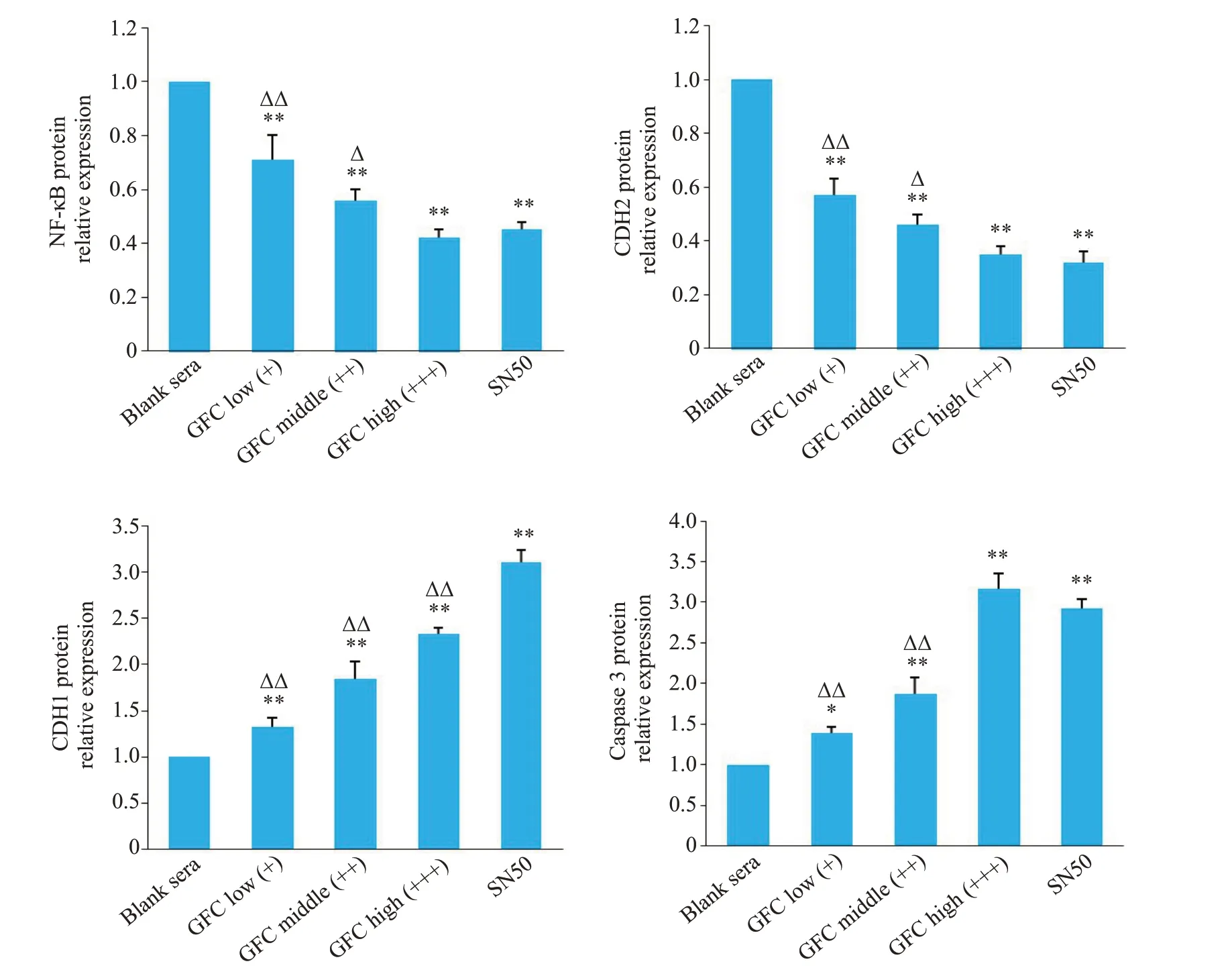
图7 各组细胞CDH1、CDH2、caspase 3 和NF-κB 蛋白相对表达变化Fig. 7 Changes in relative expression of CDH1,CDH2,caspase 3 and NF-κB proteins in each group.*P<0.05,**P<0.01 vs blank sera group;ΔP<0.05,ΔΔP<0.01 vs SN50 group.
2.5 含药血清对染色质开放区域CDH1、CDH2、caspase 3和NF-κB的影响
ATAC-seq测序后,分析空白血清与GFC(++)含药血清的DAR。结果发现,含药血清可减弱染色质开放区域NF-κB和CDH2基因信号,增强CDH1基因信号,但对caspase 3无影响(图8)。
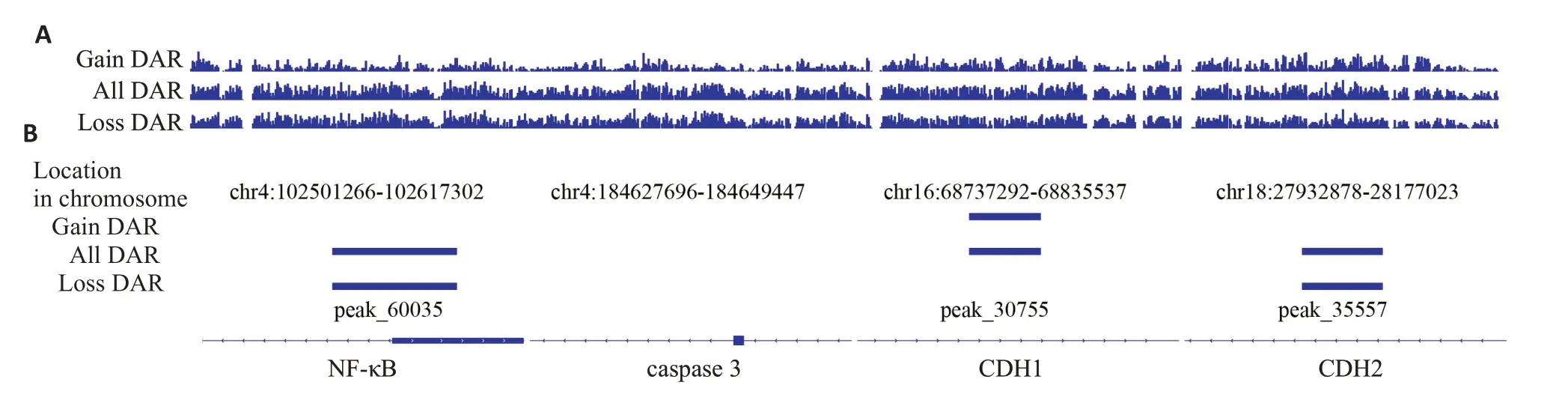
图8 桂枝茯苓胶囊含药血清对染色质开放区域CDH1、CDH2、caspase 3 和NF-κB 基因的影响Fig. 8 Effect of GFC-medicated sera on CDH1,CDH2,caspase 3 and NF-κB genes in the open areas of the chromatin.A:Peaks for DAR in all enrichment regions byATAC-seq.B:Peaks for DAR in specific enrichment regions byATAC-seq.
3 讨论
在临床实践中,中药复方与常用化疗方案联合应用于卵巢癌治疗,在抑制肿瘤转移、减轻化疗副作用、提高患者生存质量及5 年生存率等方面取得了一定的疗效[15,16]。桂枝茯苓丸已有两千多年的应用历史,安全性和疗效较好。课题组前期研究发现,GFC含药血清逆转卵巢癌耐药和转移的作用除了与诱导PTEN表达有关外,还与抑制PI3K/AKT通路,抑制MYC和表皮生长因子受体(EGFR)表达,减少染色体外DNA(ecDNA)数量有关[17,18]。ecDNA是细胞有丝分裂中期从染色体上脱落下来的环状DNA分子,与肿瘤进展、耐药和转移等亦密切相关,ecDNA中MYC、EGFR等是扩增频率最高的几种基因[19]。此外,桂枝茯苓丸通过靶向转录激活因子3(STAT3)信号通路抑制卵巢癌进展[20],在临床应用中显著降低卵巢癌患者血清CA125水平[7]。因此,桂枝茯苓丸抗卵巢癌的作用是一个多靶点、多通路的调控过程。
NF-κB是EMT的上游因子之一,在肿瘤转移、耐药和调控凋亡中具有重要作用,对多个靶点和通路均具有调控作用。研究发现,胶质母细胞瘤中CDH2和抑制CDH1表达的转录因子锌指E盒结合同源盒1(ZEB1),在化疗过程中随着厄罗替尼给药和撤药而呈动态变化[21],提示ZEB1、CDH1、CDH2等在化疗相关EMT的过程中发挥重要作用。此外,CD44通过STAT3/AKT/NF-κB信号通路促进卵巢癌转移和耐药[22]。在STAT3活化的肿瘤中,CDH1通过结合和泛素化降解STAT3,抑制肿瘤转移[23]。研究证实,在晚期高分化重度卵巢癌患者腹水中,CDH2/CDH1比例显著增高,而CDH1表达水平与CA125关系密切[24]。同样,卵巢癌患者血清CA125与caspase 3水平呈负相关[25]。研究表明,NF-κB可能是调控上述靶点的关键。NF-κB可以通过直接调节CDH1和CDH2的表达而影响细胞间粘附和细胞极性,调控肿瘤EMT,介导化疗药物对肿瘤细胞的敏感性[26]。NF-κB通过与黏蛋白16(MUC16)启动子结合,促使MUC16 高表达,MUC16 的胞外片段进而形成CA125,而MUC16的C端促进EMT表型形成[8]。这些发现凸显了NF-κB 对卵巢癌患者CA125、caspase 3、CDH1和CDH2的调控作用,结合桂枝茯苓丸的多靶点调控作用,这些发现为桂枝茯苓丸靶向NF-κB 调控EMT相关靶点提供了理论支撑。
为了证明GFC调控NF-κB抑制卵巢癌转移的作用,本实验以NF-κB抑制剂SN50为阳性对照。SN50抑制NF-κB可激活EMT的抑制剂CDH1,活化caspase 3,诱导凋亡,抑制EMT和转移[3,27]。本研究发现,GFC含药血清可明显抑制耐药性卵巢癌SKOV3/DDP细胞的迁移和诱导凋亡,抑制NF-κB、CDH2表达,诱导CDH1、caspase 3表达,提示GFC含药血清抑制卵巢癌转移的作用与调控这些因子表达有关。这些发现解释了临床患者中桂枝茯苓丸降低血清CA125水平的潜在机制,与临床病例中CA125、caspase 3、CDH1和CDH2的变化趋势相吻合,印证了靶向NF-κB调控这些因子对卵巢癌患者的治疗意义,然而尚需在动物实验和临床实验中进一步证实。为了证明GFC在DNA层面对EMT相关因子的调控作用,采用ATAC-seq技术通过Tn5转座酶切割DNA,经过PCR扩增获得测序文库并测序,获得染色体在某个特定的时空条件下染色质所有的开放区域[28]。GFC含药血清处理后,ATAC-seq检测到染色质开放区域NF-κB、CDH2减弱,CDH1增强,提示含药血清对这些基因表达的影响可能与其调控染色质开放区域有关。而ATAC-seq 检测未发现染色质开放区域caspase 3的信息,提示caspase 3的DNA序列在染色质区域可能为非开放状态,含药血清对其表达调控可能是通过转录或转录后调控实现。ATAC-seq技术早期用于分析肿瘤等疾病的染色质的开放性和染色质结构的动态变化,确定与染色质开放区域结合的转录因子、增强子等,有利于阐明疾病的作用机制。但对药物干预后染色质开放区域基因改变的研究相对较少,将此技术与中医药研究相结合,探讨中药对整个基因组或特定基因表达的影响,有助于对中药的疗效机制有更全面的认识。
本研究为GFC调控NF-κB抑制EMT,用于卵巢癌转移的临床治疗提供了实验基础,同时为抗NF-κB治疗药物的临床开发提供了一种潜在的新策略。然而,GFC靶向NF-κB的其他潜在调控机制仍有待进一步研究。

