益生菌发酵南瓜籽工艺优化及产氨基酸和挥发性香气成分分析
刘战霞,李文琦,杨慧,吴宏*,贾文婷*
(1.新疆农垦科学院 农产品加工研究所,新疆 石河子 832000;2.石河子质量与计量检测所,新疆 石河子 832000)
籽用南瓜是葫芦科植物的重要组成部分,是遗传和形态上最为多样的南瓜品种,可分为无壳南瓜(又称“裸瓜”)和带壳南瓜[1],其籽仁富含蛋白质、脂肪、多种不饱和脂肪酸等营养活性成分[2-3]。近年来,南瓜籽因其具有抗氧化、抗炎、降血糖、降血脂等营养保健作用而受到人们的广泛关注[4]。除了煮熟、炒制和作为蔬菜食用,南瓜籽还可以发酵,用作各种食品的调味剂、蛋白质补充物和功能保健品等[5]。
菌种对香气、品质发挥重要作用,是影响发酵过程及发酵结果的重要因素[6-8]。庞惟俏等[9]探究了大豆酱中主要菌种与香气成分的关系,对人工接种优势菌发酵的大豆酱进行挥发性成分的测定,结果表明优势菌M2 和M3 对宝泉酱香气成分酯和醇的产生贡献较大,是大豆酱发酵的有益菌株,有利于大豆酱风味的形成;Giami[10]研究了传统自然发酵对南瓜籽蛋白质、氨基酸、抗营养物质及营养品质的影响,研究发现发酵显著提高了种子粗蛋白质和体外蛋白质消化率;Adeyemo 等[11]在研究发酵豆类和谷物用作婴儿断奶食品时,发现植物乳杆菌能够为人体提供营养;周婵等[12]将南瓜籽打浆后与牛奶复配进行混合发酵,利用模糊数学综合评价法和响应面法优化发酵工艺,用南瓜籽和牛奶复合发酵的酸奶产品增加了南瓜籽的抗氧化、提高免疫力等优良特性,丰富了酸奶的营养。
目前,南瓜籽的发酵研究大多采用单菌株发酵[13-14],利用益生菌株发酵南瓜籽的研究相对较少。本研究将具有益生特性的菌种混合发酵,通过单因素和正交试验对发酵南瓜籽工艺进行优化,并利用氨基酸自动分析仪、气相色谱-质谱联用对自然发酵和益生菌发酵南瓜籽的品质、风味特性进行对比分析,以期为开发新型南瓜籽产品提供基础,为制备具有独特风味的益生菌发酵南瓜籽产品及其风味评价提供一定参考。
1 材料与方法
1.1 材料与试剂
‘塞外明珠’品种籽用南瓜:第十师北屯市新疆海川三新食品有限公司有机南瓜基地,挑选成熟度良好、个体大小均匀的南瓜籽作为试验材料。
益生菌(植物乳杆菌CICC 20265、酿酒酵母菌CICC 1015、紫色红曲菌CICC 40806):新疆农垦科学院微生物试验室。MRS 肉汤培养基、麦芽汁培养基、马铃薯葡萄糖水培养基:北京路桥技术有限责任公司;三氯乙酸(99%)、茚三酮(≥98%)、氨基酸混合标准品:美国sigma 试剂公司。
1.2 仪器与设备
LDZX-SOKBS 立式压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-2D 超净工作台:北京九润天成仪器公司;SPx-150B 生化培养箱、SPX-250C 恒温恒湿箱:济南卓隆生物科技有限公司;K9840 自动凯氏定氮仪:海能未来技术集团股份有限公司;S433D 全自动氨基酸分析仪:大昌洋行(上海)有限公司。
1.3 方法
1.3.1 样品的制备
对益生菌种(植物乳杆菌CICC 20265、酿酒酵母菌CICC 1015、紫色红曲菌CICC 40806)进行活化,种子液按3%比例接种于相应培养基中。30 ℃蒸馏水浸泡5~8 h,软化南瓜籽,分别取100 g 浸泡好的南瓜籽和5 mL蒸馏水于250 mL 锥形瓶中,121 ℃灭菌15 min。以5%接种量将培养至二代的菌分别接种于已高温灭菌并已冷却好的南瓜籽中,做好标记,37 ℃下每12 h 扣瓶1次,固态发酵5 d。以自然发酵的南瓜籽作为空白试验,自然发酵南瓜籽不接种益生菌,其他条件方法同上。
1.3.2 指标测定
参考GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》和GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》测定南瓜籽中脂肪和蛋白质含量;pH 值测定:称取10.0 g 发酵完成的南瓜籽溶于90.0 mL 去离子水中,均质10 s 后,于4 ℃条件下浸提24 h,用pH 计测定其pH 值。
1.3.3 感官评价
感官评价组由10 名具有较强专业背景的人员组成,分别对发酵南瓜籽进行感官评价。详细评分规则见表1。

表1 益生菌发酵南瓜籽感官评分标准Table 1 Criteria for sensory evaluation of pumpkin seeds fermented with probiotics
1.3.4 最适发酵南瓜籽单菌种的筛选及菌种复配筛选
分别进行单菌、双菌和三菌混菌复配筛选,进行南瓜籽模拟发酵试验,每组均设3 个重复,以蛋白质含量、脂肪含量和感官评分为指标,筛选出发酵南瓜籽的菌株组合。
1.3.5 单因素试验
1.3.5.1 菌种接种量
南瓜籽在121 ℃灭菌15 min,然后按1%、3%、5%、7%、9%,植物乳杆菌∶紫色红曲菌∶酿酒酵母菌1∶1∶1(质量比)接种。接种于南瓜籽后,36 ℃发酵5 d 后,对发酵南瓜籽进行感官评价。
1.3.5.2 菌种比例
南瓜籽在121 ℃灭菌15 min,然后按5%,植物乳杆菌∶紫色红曲菌∶酿酒酵母菌1∶1∶1、1∶2∶2、1∶2∶1、1∶1∶2、2∶1∶1(质量比)接种。接种于南瓜籽后,36 ℃发酵5 d 后,对发酵南瓜籽进行感官评价。
1.3.5.3 发酵温度
南瓜籽在121 ℃灭菌15 min,然后按5%,植物乳杆菌∶紫色红曲菌∶酿酒酵母菌1∶1∶1(质量比)接种。接种于南瓜籽后,32、34、36、38、40 ℃发酵5 d 后,对发酵南瓜籽进行感官评价。
1.3.5.4 发酵时间
南瓜籽在121 ℃灭菌15 min,然后按5%,植物乳杆菌∶紫色红曲菌∶酿酒酵母菌1∶1∶1(质量比)接种。接种于南瓜籽后,36 ℃发酵3、4、5、6、7 d 后,对发酵南瓜籽进行感官评价。
每种条件下进行3 组平行试验。
1.3.6 正交试验优发混菌发酵条件
采用L9(34)正交试验,以pH 值和感官评分为评价指标,正交试验因素及水平如表2 所示。

表2 发酵工艺正交试验因素及水平Table 2 Factors and levels of orthogonal design
1.3.7 益生菌发酵南瓜籽样品中氨基酸成分分析
参考武俊瑞等[15]对样品中游离氨基酸的分析方法,取干燥样品0.1 g 于研钵中,加入体积分数为5%的磺基水杨酸溶液3 mL,充分研磨后静置1 h,于12 000 r/min 离心10 min(离心半径为10 cm),取上清液用0.22 μm 微孔滤膜过滤,滤液采用全自动氨基酸分析仪进行测定。
1.3.8 香气成分富集及测定
“蔡先生大鉴,适才与我们民族博物馆馆长提伦纽斯教授商量过您的事情。他认为,您夫人在汉堡大学注册一事,当不成问题。我草拟了一份入学申请,随信寄上。务请您夫人尽快向大学提出申请。您若需要其他帮助,不妨去找汉堡大学汉学研究所的助教,他有意结识您及您夫人……希望不久能在此见到您和您夫人,并致以衷心问候。”[14]207
顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)条件[16]:取5.0 g 发酵南瓜籽样品置于20 mL 顶空瓶中,将老化后的50/30 μm CAR/PDMS/DVB 萃取头插入样品瓶顶空部分,于60 ℃吸附30 min,吸附后的萃取头取出插入气相色谱进样口,于250 ℃解吸3 min,同时启动仪器采集数据。
色谱条件:设定初始温度为40 ℃,保持温度恒定3 min,随后按以下方式升温:以3.5℃/min 的速度升温至142 ℃,以2 ℃/min 的速度升温至150 ℃,以3.5 ℃/min的速度升温至177 ℃,以6 ℃/min 的速度升温至200 ℃,以10 ℃/min 升温至230 ℃,保持温度恒定3 min。使用高纯度氦气(99.999 0%)为载气,以1.2 mL/min 的速度作为载气的恒定流速,进样口温度250 ℃,设置为不分流状态。
质谱条件[17]:电子轰击(electron impact,EI)离子源,电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,传输线温度28 ℃,质量扫描范围m/z 40~250。
1.4 数据分析
采用Origin 8.5 建立数据系统、统计分析和作图,利用SPSS 18.0 软件对主要的风味物质进行因子分析。
2 结果与分析
2.1 最适单菌种的筛选及菌种复配筛选
乳酸菌、酵母菌和红曲菌等益生特性的菌株经常被添加到食品中,产生各种有机酸和香味物质,对人体健康具有很大作用。因此,分别进行了单菌、双菌和三菌混菌复配筛选,进行南瓜籽模拟发酵试验,每组均设3 个重复,以蛋白质含量、脂肪含量、氨基酸含量和感官评分为指标,筛选出发酵南瓜籽的菌株组合。单株发酵接种率5%,双菌和三菌混合发酵时菌种配比为1∶1 和1∶1∶1(5%),于37 ℃发酵5 d,得发酵南瓜籽。表3 列出了3 种不同类型菌种混合发酵南瓜籽的蛋白质、脂肪、氨基酸和感官评分。

表3 发酵南瓜籽感官数据及理化数据Table 3 Sensory score and nutrient content of pumpkin seeds fermented with probiotics
由表3 可知,与空白相比,大部分发酵样品组的蛋白质含量、脂肪含量、氨基酸含量有明显增加,其中三菌种(植物乳杆菌∶紫色红曲霉∶酿酒酵母)混菌发酵南瓜籽的蛋白质含量、脂肪含量最高,分别为(37.47±0.03)、(51.00±0.01)g/100 g;三菌种发酵南瓜籽的氨基酸含量为(27.20±0.02)g/100 g,较空白组南瓜籽(25.80±0.02)g/100 g 有明显增加。因此,选择三菌复配进行后续研究。
2.2 单因素试验结果
三菌复配发酵南瓜籽的pH 值和感官评分单因素试验试验结果分别如图1 所示。

图1 单因素试验结果Fig.1 Results of single factor tests
从图1a 可以看出,随着接种量的增加,pH 值先升高后降低。如果益生菌的接种量太少,会延长南瓜籽的发酵时间,造成混合菌的污染,不仅影响产品风味,而且会抑制益生菌的生长,导致微生物细胞容易衰老,出现自溶,影响发酵南瓜籽的风味。pH 值反映发酵过程产酸量,当接种量为5%时,产酸量适中;当接种量为3%时,感官评分达到最大值。因此,正交优化试验分别选择3%、5%、7%。
由图1c 可知,随着植物乳杆菌比例的降低,发酵南瓜籽的pH 值和感官评分先升高后降低。三菌种(植物乳杆菌∶紫色红曲菌∶酿酒酵母菌)比例为1∶1∶1时,感官评分最高,南瓜籽气味温和,质地均匀,酥软。主要是因为多菌种混合发酵利用菌种之间协调互作关系,扩大了对南瓜籽的适应性和防杂菌能力。酵母类则可利用糖进行生长代谢,促进了酵母的生长,提高了发酵率,红曲霉可利用、分解纤维素和淀粉,而酵母菌主要利用糖源,可以通过菌种的协同作用提高对底物的利用效率,从而提高产品的蛋白质含量和营养功能。因此,正交试验选择1∶2∶1、1∶1∶1 和1∶1∶2的比例。
从图1d 可以看出,随着发酵时间的延长,pH 值和感官评分呈现先上升后下降的趋势。发酵时间少于5 h 时,发酵时间过短,发酵力不足,口感较硬;发酵时间超过5 h 时,发酵时间过长,会产生更多的乳酸,酸味明显,影响产品风味。在发酵时间为5 d 时,pH 值和感官评分均达到最大值,此时发酵南瓜籽香气更加明显,因此,选择发酵时间为4、5、6 d 进行正交优化试验。
2.3 益生菌发酵南瓜籽工艺正交优化试验
根据单因素试验的分析结果,选取接种量(A)、发酵温度(B)、菌种比例(C)和发酵时间(D)4 个因素,以pH 值和感官评分为指标,设计正交分析试验,结果见表4,方差分析结果见表5。
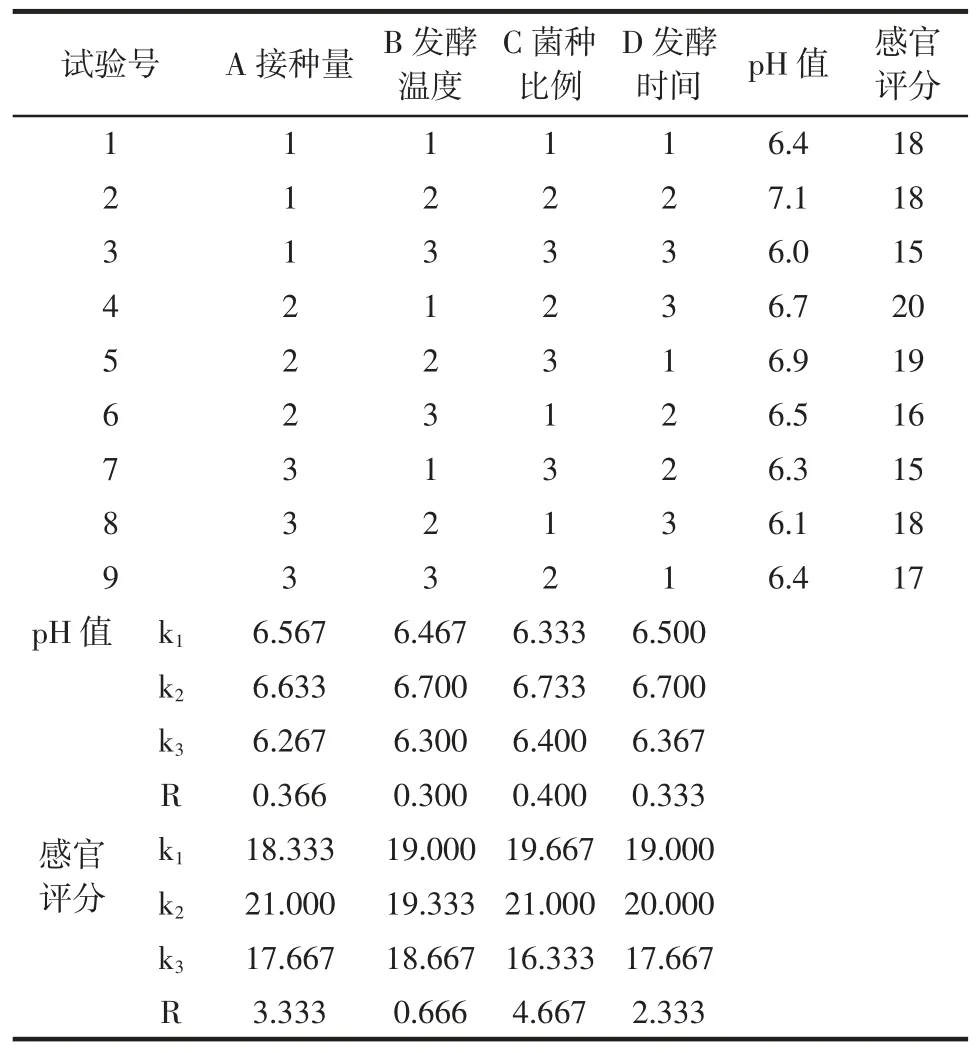
表4 益生菌发酵南瓜籽的正交试验设计与结果Table 4 Orthogonal design and test results
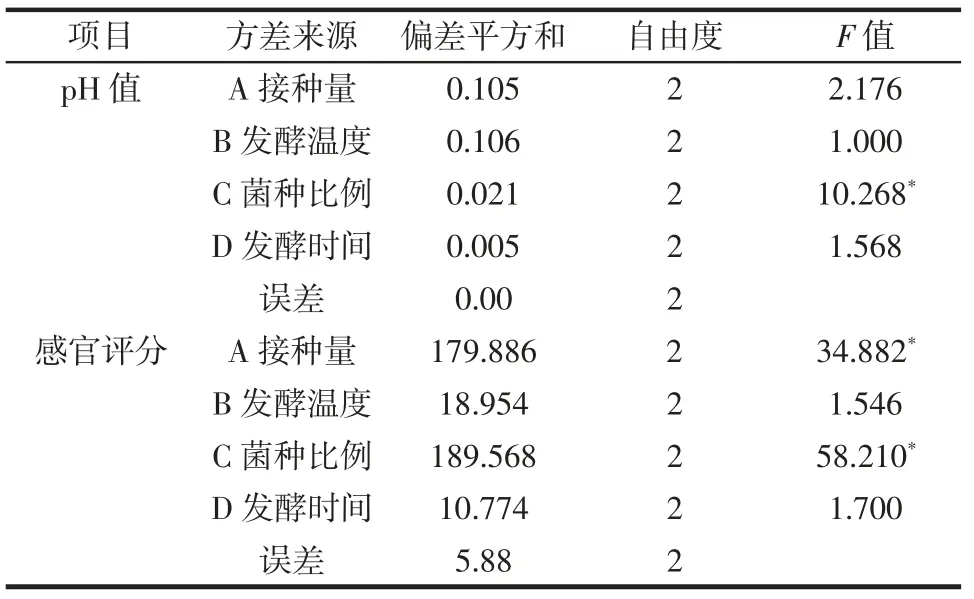
表5 方差分析Table 5 Analysis of variance
由表4 可知,影响益生菌发酵南瓜籽pH 值和感官评分的影响因素排序均为菌种比例(C)>接种量(A)>发酵时间(D)>发酵温度(B)。菌种比例是影响益生菌发酵南瓜籽pH 值和感官评分的重要因素。由表5 方差分析可知,菌种比例对发酵南瓜籽pH 值和感官评分的影响显著(P<0.05),接种量对发酵南瓜籽感官评分的影响极显著(P<0.05),发酵温度和发酵时间的影响结果不显著(P>0.05),但4 个因素影响程度的大小排序与表4 中极差分析结果一致,均为C>A>D>B。因此,经综合分析最佳益生菌发酵南瓜籽工艺为发酵温度36 ℃、发酵时间5 d、接种量5%、菌种比例1∶1∶1,益生菌发酵南瓜籽pH 值为7.1,感官评分达到最高,为20。
2.4 验证试验
根据正交试验结果,对组合A2B2C2D1进行验证试验,发酵结束后进行指标测定,发酵南瓜籽的pH 值和感官评分分别为7.0、20。pH 值水平略低于正交试验组中数据,总体优于正交试验结果。因而,以发酵温度36 ℃、发酵时间5 d、接种量5%、菌种比例1∶1∶1,作为南瓜籽发酵的最优条件。
2.5 益生菌发酵南瓜籽氨基酸组成和含量分析
益生菌发酵南瓜籽中不同种类氨基酸含量变化率见图2。

图2 益生菌发酵南瓜籽中不同种类氨基酸含量变化率Fig.2 Changes in content of amino acids in pumpkin seeds fermented with probiotics
如图2 所示,通过检测益生菌发酵南瓜籽中氨基酸的含量发现,相比于自然发酵,益生菌发酵南瓜籽中的天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、半胱氨酸、缬氨酸、组氨酸和蛋氨酸含量显著升高(P<0.05),亮氨酸、苯丙氨酸、精氨酸和异亮氨酸含量显著降低(P<0.05),酪氨酸和赖氨酸含量降低不显著(P>0.05)。其中苦味氨基酸(亮氨酸、赖氨酸、精氨酸、缬氨酸、组氨酸、苯丙氨酸、异亮氨酸)含量均呈现降低趋势,而甜味氨基酸(甘氨酸、丙氨酸、丝氨酸、酪氨酸、蛋氨酸)含量均升高,这与益生菌发酵过程中发酵剂植物乳杆菌和酿酒酵母增多,产生较多甜味氨基酸的有很大关系[18]。
2.6 益生菌发酵南瓜籽风味物质及相对含量分析
本试验通过顶空气相色谱-质谱对发酵南瓜籽挥发性物质进行测定,结果见表6。图3 为自然发酵与益生菌发酵风味物质含量分布。
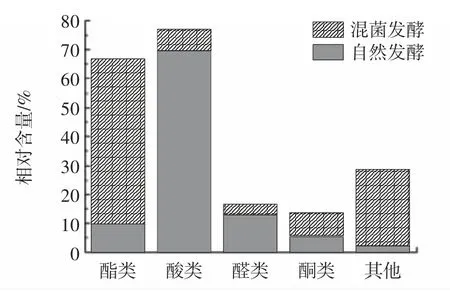
图3 自然发酵与益生菌发酵风味物质含量分布Fig.3 Relative content of flavor compounds

表6 发酵南瓜籽中风味物质及相对含量Table 6 Relative content of volatile flavor components identified in fermented pumpkin seeds
从表6、图3 可以看出,在自然发酵的南瓜籽中检测到24 种风味物质,包括4 种酯类、1 种醇类、3 种酸类、6 种醛类和7 种酮类。南瓜籽自然发酵过程中产生了大量的酸性物质,占69.404%,包括乙酸(39.273%)、正戊酸(30.131%),说明自然发酵过程主要以产酸性物质为主。
从表6、图3 可以看出,采用复合益生菌发酵南瓜籽共检测到27 种风味物质,其中酯类化合物6 种,醇类化合物5 种,酸类化合物4 种,醛类化合物3 种。其中乙酸丁酯(8.360%)、乙酸己酯(9.521%)、丁酸丁酯(5.262%)、2-甲基丙酸丙酯(7.201%)、乙醇(5.701%)、2,3-丁二醇(16.421%)、2-甲基吡嗪(15.341%)、2,5-二甲基吡嗪(6.742%)和正丁醚(4.131%)。微生物通过氨基酸代谢产生了一定量的醇类物质,酯类具有水果味的香气成分。由于它们比其他风味物质具有更低的风味阈值和更高的气味活性,因此,酯类对南瓜籽发酵风味的贡献更大。
2.7 益生菌发酵南瓜籽风味物质的因子分析
为确定益生菌中不同优势菌对发酵南瓜籽风味物质的影响,利用因子分析将主要风味物质归为少量的因子变量,以便确定益生菌中不同优势菌发酵的南瓜籽风味的差异[19],采用统计量检验(Kaiser-meyerolkin,KMO)和巴特利特球度检验(Bartlett's 检验)进行分析,分析结果见表7。各主成分因子的特征值及其方差贡献率计算结果见表8,旋转后主成分因子的成份矩阵见表9。

表7 KMO 和Bartlett's 检验Table 7 KMO and Bartlett's test
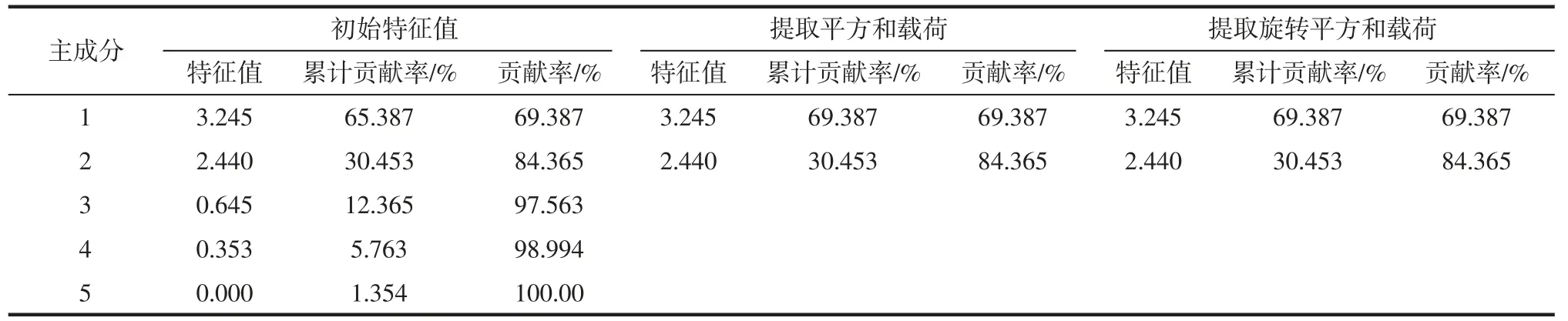
表8 益生菌发酵南瓜籽香气成分的特征值和方差贡献率Table 8 Eigenvalues and variance contributions of aroma components of infermented pumpkin seeds with probiotics
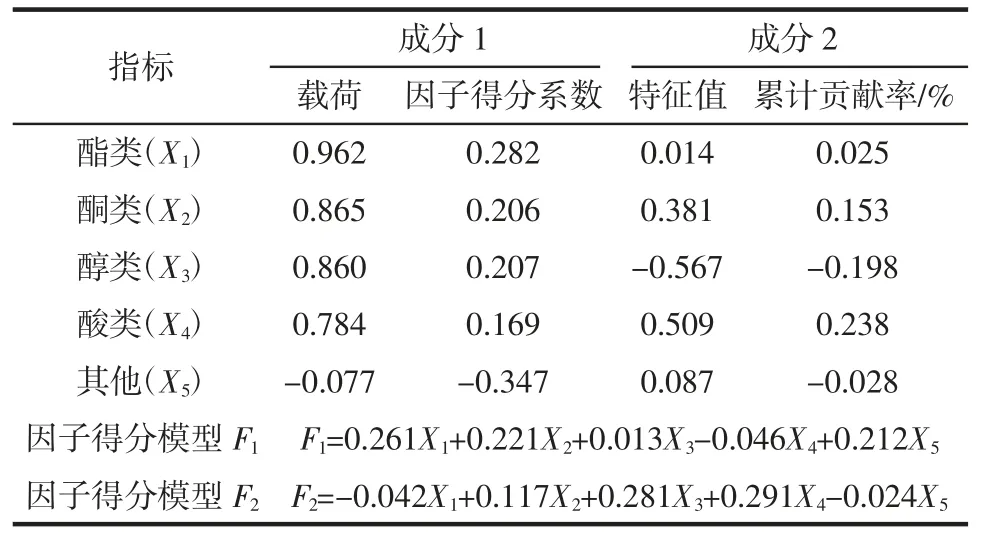
表9 旋转后的载荷矩阵和因子得分系数矩阵Table 9 The load matrix and factor score coefficient matrix after rotation
由表7 可知,KMO 值为0.745,在0.5~1 之间且接近于1,相关性较大,表明可进行因子分析。Bartlett 球形检验,P=0.000<0.005,说明数据满足正态总体分布。用SPSS 软件对数据进行因子分析,根据表8 可知,前2 个主成分的累计贡献率分别为69.387%、30.453%,达到99.840%,其涵盖了5 种香气成分的所有信息。前2 个因子不旋转时因子贡献率分别为69.387%和84.365%,累计贡献率>80%,特征值分别为3.245 和2.440 均大于1,说明这2 个因子包含5 类香气成分信息,因此,提取2 个公因子较为合适。
单独使用因子F1或因子F2并不能对益生菌中不同优势菌对发酵南瓜籽香气成分作出综合评价[20],因此,按各公因子对应的方差贡献率为权数计算综合统计量为F=0.431 36F1+0.238 97F2。最后根据所求F 值对益生菌中不同优势菌对发酵南瓜籽进行排序,见表10。
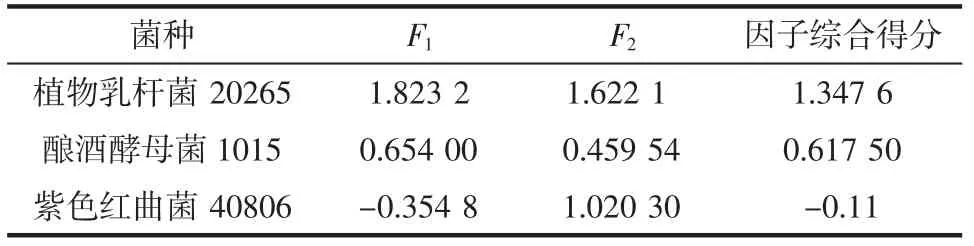
表10 因子综合得分Table 10 Composite scores of factors
由表10 可知,益生菌中不同优势菌对发酵南瓜籽所产香气因子分析排序为植物乳杆菌>酿酒酵母>紫色红曲菌。
3 结论
通过单因素和正交试验对益生菌发酵南瓜籽进行优化,并利用顶空固相微萃取、气相色谱-质谱联用对自然发酵和益生菌发酵南瓜籽的产氨基酸、风味特性进行对比分析。结果表明,益生菌发酵制备南瓜籽最优工艺条件为发酵时间5 d、接种量5%、菌种比例1∶1∶1,发酵温度为36 ℃,在此条件下发酵得到的益生菌发酵南瓜籽南瓜籽pH 值为7.1,感官评分为20;益生菌发酵南瓜籽苦味氨基酸含量均降低,而甜味氨基酸含量均升高;南瓜籽中共检测出27 种风味物质,与自然发酵相比益生菌发酵风味物质相对含量明显增加,经因子分析,植物乳杆菌和酿酒酵母对益生菌发酵南瓜籽酯的产生贡献较大。

