绵羊RFXANK基因多态性与肉用性状的关联分析
郭晨浩,孟 科,荣 轩,强 浩,聂 玮,陶毛孩,冯登侦
(宁夏大学农学院,银川 750021)
【研究意义】绵羊是人类社会最主要的经济动物,也是人类社会羊肉、羊奶、羊毛和毛皮的重要来源[1]。由于羊肉肉质鲜嫩,营养丰富,因此深受广大人民的欢迎。当前,如何改善肉制品的产量与品质,以满足人们对健康饮食的需要,已成为改良育种的重要依据[2]。滩羊是我国著名绵羊品种之一,其脂质均匀、风味独特、肉质优良[3]。杜泊羊原产于南非,是世界著名的肉羊品种,由于其生长速度快、瘦肉比例高,是杂交羊肉生产的优良终端父系[4]。小尾寒羊是我国本地品种,以早熟、高产而闻名,并对各种气候条件具有良好的适应性,是中国优良的绵羊选育母本[5]。选用杜泊羊、滩羊和小尾寒羊开展三元杂交,使杂交后代获得超越亲本的杂交优势[6]。随着分子育种技术的不断创新和发展,直接或间接地对绵羊肉用性状的遗传改良起重要作用[7]。而分子标记辅助选择是一种能够精确评估、预测动物育种与生产品质、节约成本、加快育种进程的新途径[8]。【前人研究进展】RFXANK(Regulatory factor X associated ankyrin containing protein)又被称为ANKRA1、BLS、F14150_1和RFX-B,是调节因子X (RFX)的亚基。其突变可能引起淋巴细胞综合症及MHC II分子变异[9]。目前,RFXANK基因的研究主要针对人体免疫学,而关于绵羊肉用性状的相关性研究则相对较少。Zhang等[10]应用Ovine SNP50芯片对329只绵羊的体重性状进行分析,检测到RFXANK基因对绵羊断奶后宰前活重的增加具有显著影响。RIPK2基因是调节先天和适应性免疫反应的重要基因,而RFXANK基因则通过调节蛋白的生成过程来控制MHC基因的活性[11]。褚敏[12]通过对牦牛脂肪组织microRNA的功能分析发现,RFXANK基因可以富集到与脂肪沉积相关的通路中,说明RFXANK基因可能参与脂肪沉积的调节。本研究利用DAVID(https: //david.ncifcrf.gov/)对RFXNAK基因进行功能分析,发现该基因作用在组蛋白脱乙酰酶和Rs蛋白信号传导通路上。组蛋白脱乙酰酶(Histone deacetylase,HDAC)是一种极为重要的胰蛋白酶,能修饰染色体结构,调控基因表达[13]。Feng等[14]研究发现Rev-erbα对HDAC3的基因组募集指导了正常肝脂质稳态所需的组蛋白乙酰化和基因表达的昼夜节律,组蛋白乙酰化的失调会严重干扰正常代谢,当HDAC3或Rev-erbα的含量在小鼠肝脏中彻底消耗,会导致小鼠肝脂肪变性。前人研究充分说明,RFXANK基因对肉用性状具有调控作用。【本研究切入点】以往有关RFXANK基因的研究多以人体免疫学为主,但RFXANK基因对绵羊肉用性状的影响则鲜有报道。【拟解决的关键问题】以杜泊羊、小尾寒羊和滩羊、杜滩寒三元杂交羊为研究对象,利用Squenom Mass ARRAY®SNP技术,分别检测3个RFXANK基因位点,并探讨RFXANK基因的多态性与肉用性状之间的关系,以期为绵羊肉用性状的分子标记提供理论参考。
1 材料与方法
1.1 试验动物
杜泊羊(30只)、滩羊(30只)和小尾寒羊(31只)共91只健康成年羊来自宁夏石嘴山威震肉羊繁育场(106.51038,38.97912)。
1.2 试验试剂
抗凝采血管购自宇力医疗器械(江苏)有限公司;动物基因组DNA提取试剂盒购自天根技术(北京)有限公司。
1.3 方法
1.3.1 样品采集 用抗凝采血管颈静脉采集91只试验羊的血样5 mL;随机采集杜滩寒三元杂交羊和滩羊(各8只,公母各半)、杜泊羊和小尾寒羊(各7只,3公4母),共30只绵羊的耳组织。置于75%酒精中,-20 ℃下保存。
1.3.2 基因DNA提取 采用动物血液基因组DNA提取试剂盒对绵羊血液样本DNA进行提取,利用超微量分光光度计和0.8%的琼脂糖凝胶电泳测定91只绵羊DNA的纯度和浓度。
1.3.3 液相捕获测序技术 通过Ensembl基因库(http://asia.ensembl.org/index.html)和NCBI数据库(https://www.ncbi.nlm.nih.gov/gene/)确定RFXANK基因的序列ID号。将91份样本交由康普森农业科技(北京)有限公司进行。
1.3.4 飞行质谱检测 飞行质谱检测交由康普森农业科技(北京)有限公司完成。试验步骤为:引物设计,引物信息详见表1;DNA质量检测;PCR扩增。
1.4 测定指标
1.4.1 屠宰性能测定 对飞行质谱检测的8月龄(30只)试验羊进行称重,称重后进行屠宰,按照颈动脉放血进行屠宰。宰前活重为宰前禁食12 h、禁水2 h测得,其余屠宰性能测定指标分别为胸围、胴体重、净肉重、GR值、背膘厚、屠宰率和净肉率。清除内脏周围的脂肪,用电子秤称重心脏、肝脏、脾脏、肺脏、肾脏、全骨[15-16]。
1.4.2 肉品质测定 屠宰后,采集第3肋骨到第12肋骨间的背最长肌,剪切力由嫩度仪测定;系水力由压力法测定;熟肉率测定由蒸煮法测定;pH选用普及型pH计测定;肌纤维直径、肌纤维密度由石蜡切片法观察测定。

表1 RFXANK基因3个SNP位点引物信息
1.4.3 肌肉营养物质测定 肌肉中氨基酸含量参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》测定;脂肪含量参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》测定;蛋白质参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》测定;胆固醇参照GB 5009.128—2016《食品安全国家标准食品中胆固醇的测定》测定。
1.5 数据处理
绵羊RFXANK基因3个位点的基因型频率、等位基因频率及多态信息含量(PIC)、纯合度(Ho)、杂合度(He)和有效等位基因数(Ne)由Microsoft Excel统计分析。用χ2进行哈代-温伯格平衡检验。用SPSS 26.0 软件对试验羊群基因型与肉用性状表型数据联合进行方差分析,所有结果均以平均值±标准差表示,以P<0.05为差异显著性判断标准。
采用的分析模型为一般线性模型:
Y=μ+G+m+e
式中,Y为性状测定值,μ为群体均值,G为基因型效应,m为性别效应,e为随机残差。
2 结果与分析
2.1 DNA检测结果
经0.8%的琼脂糖凝胶电泳检测(图1)可知,DNA条带清晰完整无拖带。
2.2 液相捕获测序结果与分析
在杜泊羊(D)、滩羊(T)和小尾寒羊(XH)共91只绵羊中,共检测到11个RFXANK基因突变位点,几乎全部试验羊均在rs160009883、rs420498050和rs405773959这3个位点发生了突变,与参考基因组(Oar_rambouillet_v1.0)存在较大偏差(表2)。
M:DL 2000 DNA Marker;1~8:试验羊群部分基因组DNA。
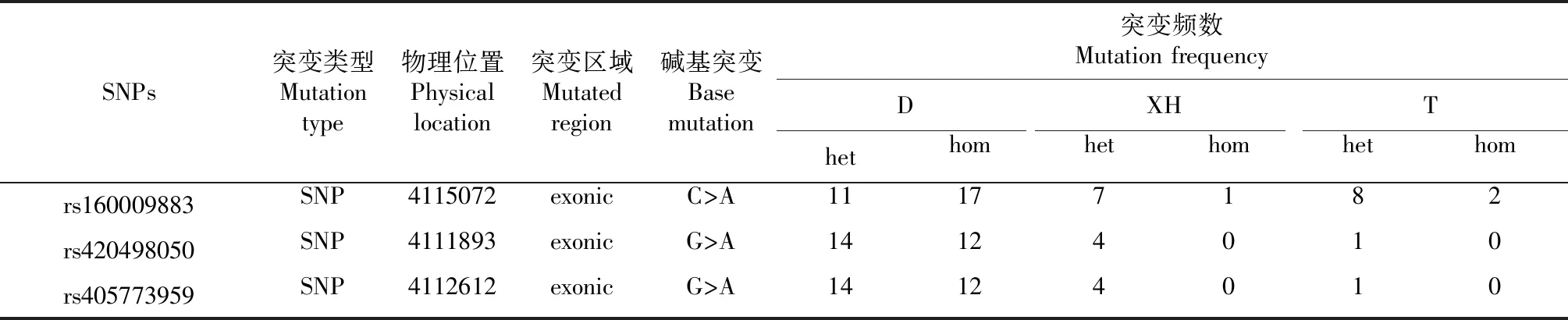
表2 RFXANK基因的突变区域和位点数
2.3 RFXANK基因多态性分析
根据测序结果计算基因型频率、基因频率和各项群体遗传指标(表3~4)。卡方独立性检验显示,3个位点品种间差异极显著;3个位点在D群体表现为中度多态(0.25
2.4 RFXANK基因分型分析
通过采用Sequenom Mass ARRAY®SNP技术检测30只绵羊的基因分型,由图2可知,RFXANK基因的rs160009883位点检测出3种基因型为:AA(4)、CA(7)和CC(19);RFXANK基因的rs420498050和rs405773959位点检测出3种基因型为:AA(3)、GA(7)和GG(20)。
2.5 RFXANK基因与绵羊肉用性状的关联分析
2.5.1RFXANK基因与屠宰性能的关联分析 对RFXANK基因3个位点的不同基因型与绵羊的屠宰性能进行关联分析,结果(表5)表明,rs160009883位点AA、CA基因型宰前活重、胴体重极显著高于CC基因型(P<0.01),AA基因型净肉重极显著高于CC基因型,AA基因型净肉率显著高于CC基因型(P<0.05),CA基因型净肉重显著高于CC基因型,AA、CA基因型与CC基因型全骨重差异分别为显著和极显著;rs420498050和rs405773959位点AA基因型宰前活重、屠宰率、净肉率和全骨重极显著高于GG基因型,AA基因型背膘厚显著高于GG基因型,AA、GA基因型胴体重、净肉重极显著高于GG基因型,AA基因型胴体重、净肉重、屠宰率和净肉率显著高于GA基因型。

表3 RFXANK基因3个位点基因型频率及基因频率
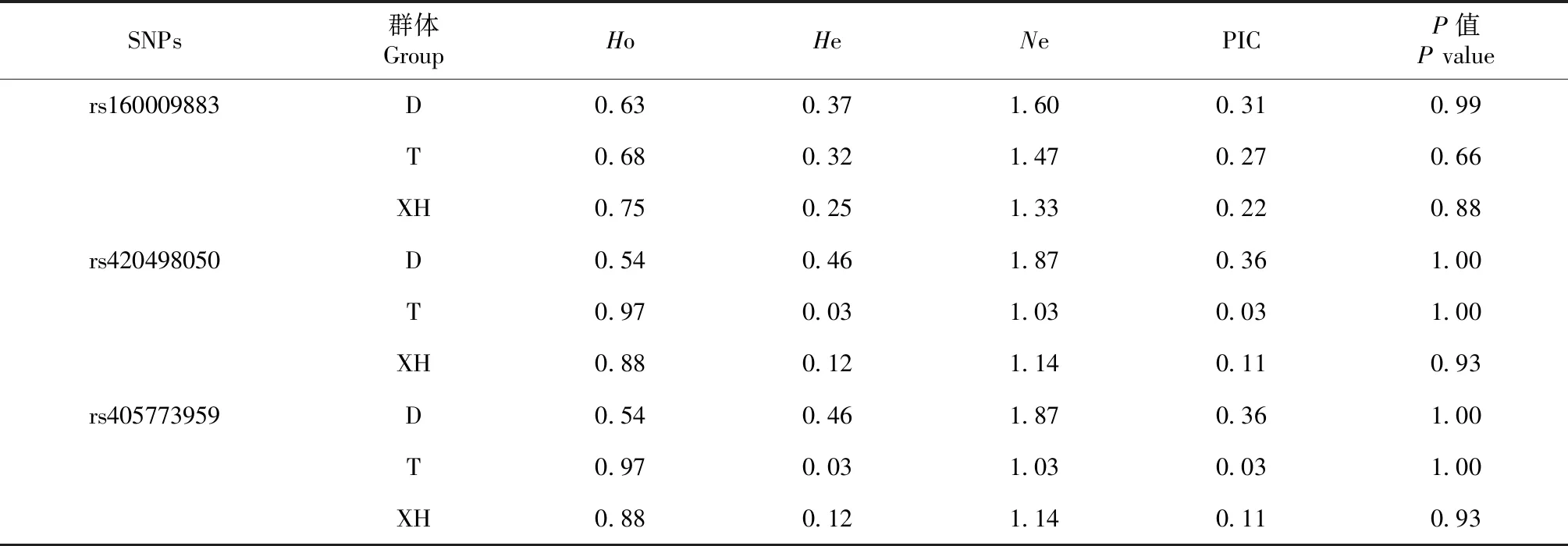
表4 RFXANK基因3个位点群体遗传多样性分析

图2 RFXANK基因3位点分型结果

表5 RFXANK基因3个位点不同基因型与绵羊屠宰性能的关联分析
2.5.2RFXANK基因与内脏器官重量和胸围的关联分析 由表6可知,rs160009883位点AA、CA基因型心脏重显著高于CC基因型(P<0.05),AA、CA基因型肝脏重、肾脏重极显著高于CC基因型(P<0.01),AA基因型与CA、CC基因型脾脏重的差异分别为显著和极显著,AA基因型胸围显著高于CC基因型,CA基因型脾脏重显著高于CC基因型,AA、CA基因型与CC基因型肺脏重差异分别为极显著和显著;rs420498050和rs405773959位点AA、GA基因型与GG基因型心脏重差异分别为极显著和显著,AA、GA基因型肝脏重、肺脏重和肾脏重极显著高于GG基因型,AA基因型胸围显著高于GG基因型,AA、GA基因型脾脏重极显著高于GG基因型,AA基因型脾脏重显著高于GA基因型。
2.5.3RFXANK基因与肉品质的关联分析 由表7可知,3个位点不同基因型间的pH、剪切力、熟肉率、失水率无显著差异;rs160009883位点AA基因型GR值显著高于CC基因型(P<0.05),CA基因型肌纤维直径显著高于CC基因型;CC基因型肌纤维密度极显著高于CA基因型(P<0.01);rs420498050和rs405773959位点AA基因型GR值显著高于GG基因型,GA基因型肌纤维直径显著高于GG基因型;GG基因型肌纤维密度极显著高于GA基因。
2.5.4RFXANK基因与肌肉养分的关联分析 由表8可知,rs160009883位点AA基因型蛋白质极显著高于CC基因型(P<0.01),CC基因型肌苷酸显著高于AA基因型(P<0.05),CA基因型丙氨酸、缬氨酸显著高于CC基因型;rs420498050和rs405773959位点AA基因型蛋白质极显著高于GG基因型,GG基因型肌苷酸显著高于GA基因型,GA基因型丙氨酸、缬氨酸显著高于GG基因型。

表6 RFXANK基因3个位点不同基因型与绵羊内脏器官重量和胸围的关联分析

表7 RFXANK基因3个位点不同基因型与绵羊肉品质的关联分析

表8 RFXANK基因3个位点不同基因型与肌肉养分的关联分析
3 讨 论
有效等位基因数、多态信息含量高说明群体遗传变异程度高、群体遗传多样性丰富,而群体遗传多样性丰富,表明该群体存在一定的遗传变异潜力[17]。本研究发现,RFXANK基因的rs160009883、rs420498050和rs405773959位点在杜泊羊群体呈中度多态(0.25 屠宰性能是评价肉用性状和经济效益的重要指标,肉品质是衡量肉用性状的关键[18]。肌纤维直径能反映动物的生长速度,从而对宰前活重产生影响,导致胴体性状差异[19]。本研究发现RFXANK基因CA、GA型的绵羊GR值、各项屠宰指标均高于CC、GG型的绵羊,表明C→A、G→A的突变对肉羊的生长发育有促进作用。目前,国内外有关RFXANK基因的研究主要集中于免疫缺陷病、肝细胞癌相关病理学和MHC II类分子的调控作用上[20-22]。然而,有关RFXANK基因多态性与绵羊肉用性状的相关性研究很少。Rade等[23]通过基因表达试验分析,在人类的骨骼肌中发现了RFXANK基因大量表达。骨骼肌是一种横肌肉,它是一种附着在骨骼上的肌肉,骨骼肌的发育与机体的生长和体重密切相关[24]。上述研究表明,RFXANK基因可能通过影响骨骼肌的发育对绵羊体重产生影响。本研究发现,RFXANK基因3个位点的不同基因型对绵羊胴体重和宰前活重的差异有显著性,这与Zhang等[10]的研究结果相吻合。相关研究发现,在绵羊基因组中存在着对生长性状和肉用性状有显著关联性的候选基因[25-26],其中MEF2B、RFXANK、RIPK2和GRM1等是绵羊生长性状和肉用性状的重要候选基因[27]。Trukhachev等[28]发现,外显子基因RFXANK高度保守,非编码区具有显著变异性,SNP位于外显子中,对动物肉用性状和免疫反应参数有显著影响,且在牛和小鼠中也发现了类似的突变。在家禽研究中,Li等[29]研究发现,在鸡胸肌8935个基因的筛选中,REXANK基因对肉鸡的生长有重要影响。本研究中,RFXANK基因3个位点的不同基因型对绵羊净肉重、背膘厚、屠宰率和净肉率均有不同程度的显著差异,进一步表明RFXANK基因对绵羊肉用性状有重要影响。刘贤等[30]通过对母牛胸围、管围和体重联合研究分析,发现随着母牛体重的逐渐增加,其胸围和管围的也随之发生明显增长,本研究结果与其相吻合。内脏器官在动物整个机体生长发育和对营养物质的消化吸收代谢中起着重要作用[31]。据报道,RFXANK基因对小鼠肢体和子宫形成发育起表达调控作用[32]。Lin等[33]发现,RFXANK基因在动物的胸腺细胞、肺脏和睾丸中均有表达。殷雨洋等[34]研究表明,随着湖羊体重的逐渐增长,湖羊心脏重量随之显著增加,其机体所需营养代谢也随之逐渐增加,从而心脏的增重与体增重处于平衡状态。黄帅等[35]研究发现羊体内脏发育与整个机体的上下生长发育相适应。本研究发现,RFXANK基因3个位点的不同基因型对绵羊各内脏器官重量和宰前活重均有显著差异,说明该基因对绵羊的生长发育具有重要影响,与上述研究结果相一致。 肉品质是评价肉质特性的主要依据,主要包括pH、剪切力、熟肉率、失水率和肌肉养分等。目前,有关绵羊RFXANK基因与肉品质相关性研究尚属空白。本研究通过GO功能分析发现RFXANK在组蛋白脱乙酰酶通路上起作用。组蛋白脱乙酰酶能在一定程度上调控组蛋白和非组蛋白乙酰化,从而影响脂肪组织的代谢和肥胖的发生发展趋势[36]。吴佳玉等[37]发现Rev-erb能够募集HDAC3并与之结合,从而使骨骼肌细胞在代谢过程提高葡萄糖的利用率,并能够将其转化为蛋白质或脂肪。蛋白质的含量对畜禽的肉产量、肉品质和营养价值等性能有重要影响[38]。氨基酸是蛋白质合成的重要物质,其成分及含量对肉的风味、营养价值及蛋白代谢有重要影响[39]。本研究发现,RFXANK基因3个位点不同基因型对蛋白质、丙氨酸和缬氨酸存在显著差异。因此推测,RFXANK基因可能对肌肉中蛋白质和脂肪含量产生影响,从而影响肉品质。肌纤维密度和肌纤维直径是肌纤维组织学特性的主要参考依据,对影响肉品质因素中十分重要[40]。本研究结果显示,RFXANK基因3个位点不同基因型对肌纤维直径和密度存在显著差异,进一步表明RFXANK基因对绵羊肉品质有重要影响。综上表明,RFXANK基因与绵羊肉品质有相关性,这些研究结果对绵羊肉品质研究具有参考价值。 本研究发现RFXANK基因的rs160009883、rs420498050和rs4057739593位点不同基因型在绵羊肉用性状上有不同程度的显著差异。说明RFXNAK基因可作为肉羊生长发育和肉用性状方面的候选基因。此外,RFXANK基因3个位点可以作为优质肉羊培育中肉用性状的潜在分子标记,为分子杂交育种提供理论参考,进一步促进肉羊品质改良。4 结 论

