左归丸通过FNDC5/Wnt3a/β-catenin通路治疗绝经后骨质疏松症的机制研究
黄展辉 魏其鹏 梁炜瑜 周季青 丁富平 张进*
1.广州中医药大学中西医结合基础研究中心,广东 广州 510006
2.广州中医药大学,广东 广州510006
3.广州中医药大学护理学院,广东 广州510006
绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)是以女性绝经后因雌激素分泌不足而导致的骨量降低、骨微结构损害、骨脆性增大为特征的一种全身代谢性骨病[1]。中国已经进入了中重度人口老龄化社会,进入绝经期后的女性数量增多带来PMOP高发性的危机。PMOP作为老年女性一种高发的疾病,现已成为一个严重的公共卫生问题,针对PMOP的预防和治疗是非常有意义的。
大量的临床观察性研究发现左归丸具有治疗PMOP的作用[2],但左归丸在治疗PMOP方面有着多效性、多方向的特性,其潜在的作用机制还未能完全明了。因此,目前临床上仅将左归丸作为一种替代疗法使用。中医药在治疗PMOP上有着便捷、费用低、安全性高的特点[3-4]。因此,研究左归丸治疗PMOP的潜在机制对于明确左归丸疗效以及扩大临床治疗使用有着重大意义。
FNDC5/Irisin作为新发现的运动因子,其与骨骼有着密切的联系。一项研究发现,外源性注射Irisin可以改善卵巢切除(OVX)小鼠的骨骼,Irisin能增加成骨细胞并减少破骨细胞的数量,从而维持OVX小鼠骨量和质量[5]。而Wnt信号通路是调节成骨分化的重要通路之一[6]。同时有研究发现左归丸能够通过调控Wnt/β-catenin信号通路影响去势骨质疏松模型大鼠[7]。但左归丸通过调节FNDC5进而调控Wnt/β-catenin信号通路治疗绝经后骨质疏松症尚未见报道。因此,本研究将通过小鼠体内外实验,对左归丸治疗绝经后骨质疏松症的相关作用机制进行探讨。
1 材料与方法
1.1 材料
1.1.1实验动物及细胞:雄性SD大鼠20只,体重为250~300 g,购自广州中医药大学实验动物中心;FNDC5基因敲除(KO)小鼠由赛业生物科技有限公司构建并提供F1代C57BL/6小鼠,后续由本课题组自行饲养繁育;野生型C57BL/6小鼠购于广州中医药大学动物实验中心。选用8周龄雌性野生型和KO小鼠各15只,体重为(20±1)g,在广州中医药大学动物实验中心的SPF级动物房饲养,循环昼夜光照12 h,温度(25±2)℃,湿度60 %~65 %,自由饮食饮水。每次实验都严格遵守动物实验伦理要求。小鼠MC3T3-E1细胞,购自中国医学科学院细胞库。
1.1.2药物及试剂:左归丸(熟地黄24 g、川牛膝9 g、山茱萸12 g、山药12 g、鹿角胶12 g、菟丝子12 g、枸杞子12 g、龟板胶12 g)购自广东省中医院。以上药物(除鹿角胶和龟板胶)加水至完全没过饮片,浸泡30 min,煎煮30 min后将鹿角胶和龟板胶烊化后加入水煎液中,过滤,浓缩,除菌,4 ℃冷藏备用。碱性磷酸酶试剂盒(A059-2-2,中国建成科技);碱性磷酸酶染色试剂盒偶氮偶联法(G1480-4,中国Solarbio);HE染色液试剂盒(G1120,中国罗基生物);RNA transmate转染试剂(E607402-1000,中国生工);β-甘油磷酸钠(G806967,中国Macklin);抗坏血酸(A92902,美国Sigma);EDTA脱钙液(G1105,中国Servicebio);组织RNA提取试剂盒(EZB-RN001-plus,中国EZB);彩色逆转录试剂盒(A0010CGQ,中国EZB),实时荧光定量试剂盒(EZB-Probe-R2-L,中国EZB);小鼠I型前胶原N端前肽(PINP)酶联免疫分析试剂盒(MM-43891M2,中国MEIMIAN)、小鼠血清雌二醇(E2)酶联免疫分析试剂盒(MM-0566M2,中国MEIMIAN)、小鼠Irisin酶联免疫分析试剂盒(MM-1119M2,中国MEIMIAN);BCA试剂盒(WLA004b,中国万类生物);GAPDH(D16H11,美国CST)、Wnt3a(C64F2,美国CST)、β-catenin(D10A8,美国CST);FNDC5抗体(DF13019,中国Affinity Biosciences);辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗(A0208,中国Beyotime)。
1.1.3仪器:双能X线骨密度仪,美国Hologic公司;紫外分光光度计,美国NanoDrop科技有限公司;实时荧光定量PCR仪(型号:CFX96),美国Bio-Rad公司;酶标仪,美国Thermo公司;多功能自动染色机、病理切片机、全自动组织脱水机,德国Leica公司;生物显微镜,日本Olympus公司。
1.2 方法
1.2.1动物分组:将SD大鼠随机分成空白对照组、左归丸低、中、高浓度四组,左归丸低、中、高浓度组大鼠按体重对应的每日灌胃剂量为10.5 g/kg、21 g/kg、42 g/kg,空白对照组大鼠灌胃等量生理盐水,连续灌胃7 d。灌胃后取各组大鼠含药血清。将8周龄野生型雌性C57BL/6小鼠,按每组5只随机分为三组:野生型对照组、野生型OVX组、野生型治疗组。将8周龄雌性KO小鼠,按每组5只随机分为三组:KO对照组、KO-OVX组、KO治疗组。野生型OVX组、野生型治疗组、KO-OVX组、KO治疗组行卵巢切除,野生型对照组和KO对照组仅切除卵巢周围脂肪。术后适应性喂养1周后进行灌胃,野生型治疗组和KO治疗组灌胃左归丸水提液[15.75 g/(kg·d)],其余各组灌胃等量生理盐水,连续给药12周。
1.2.2细胞培养及分组:用10 %血清+1 %链霉素-青霉素溶液+89 % α-MEM培养MC3T3-E1细胞,接种于无菌培养皿中。将MC3T3-E1细胞接种于12孔板上,细胞分组为空白对照组、成骨诱导组(OGI组)、成骨诱导+左归丸低浓度组(OGI-ZL组)、成骨诱导+左归丸中浓度组(OGI-ZM组)、成骨诱导+左归丸高浓度组(OGI-ZH组)、成骨诱导+转染组(siOGI组)、成骨诱导+转染+左归丸低浓度组(siOGI-ZL组)、成骨诱导+转染+左归丸中浓度组(siOGI-ZM组)和成骨诱导+转染+左归丸高浓度组(siOGI-ZH组),每一组使用对应的大鼠血清培养。
1.2.3细胞转染:在细胞长至40 %~50 %时进行转染。空白对照组、OGI组、OGI-ZL组、OGI-ZM组、OGI-ZH组加入10 μmol/L空载转染混合液,siOGI组、siOGI-ZL组、siOGI-ZM组和siOGI-ZH组加入含10 μmol/L FNDC5-SiRNA转染混合液。6 h后更换培养液,24 h后进行成骨诱导。
1.2.4成骨诱导:除空白对照组外其余各组的培养液里加入50 μg/mL VC+10 mmol/L β-甘油磷酸钠。每隔2 d换液一次。取第5、7、14天的细胞培养液进行细胞上清ALP活力检测。取第7天的细胞进行细胞ALP染色。
1.2.5骨密度检测:灌胃12周后,将各组小鼠放置于双能X线骨密度分析仪下检测骨密度(bone mineral density, BMD)。
1.2.6血清ELISA检测:灌胃12周后,通过眼球摘除方式收集小鼠全血1 mL,室温静置30 min后,在4 ℃条件下3 000 r/min离心15 min后,分离血清。具体操作严格按照相应的ELISA试剂盒说明书步骤进行。
1.2.7股骨切片和HE染色:分离小鼠股骨组织,在4 %多聚甲醛中充分固定24 h,EDTA脱钙液脱钙1个月。脱钙后进行组织脱水、浸蜡、包埋等制做石蜡切片。切片经脱蜡、苏木精-伊红染色、脱水、透明、封片等步骤后在显微镜下拍照采集图像。
1.2.8实时荧光定量聚合酶链式反应:使用RNA提取纯化试剂盒提取股骨组织RNA。使用彩色逆转录试剂盒合成cDNA,使用实时荧光定量试剂盒在PCR仪上进行实时荧光定量聚合酶链式反应(real-time PCR)。以β-actin为参照基因,用2-△△Cq法进行定量。引物序列:β-actin:上游CATTGCTGA CAGGATGCAGA,下游CTGCTGGAAGGTGGACA GTGA;FNDC5:上游GCTAGGCTGCGTCTGCTTCG,下游GCTAGGCTGCGTCTGCTTCG;Runx2:上游CATCGCTTTCAAGGTGGTGG,下游ATGGCTGCGGT AGCATTTCT;OPN:上游CTCCATTGACTCGAA CGACTC,下游CAGGTCTGCGAAACTTCTTAGAT;OCN:上游GACCTC ACAGATGCCAAGCCC,下游ATAGATGCGTTTGTAGGCGGTC;OSX上游AGC GACCACTTGAGCAAACAT,下游GCGGCTGATTG GCTTCTTCT。
1.2.9Western Blot:用蛋白裂解液提取股骨组织蛋白,BCA试剂盒定量蛋白浓度,在10 % SDS-PAGE凝胶上蛋白样品进行电泳后进行转膜,4 %脱脂奶粉封闭2 h,一抗[GAPDH (1∶5 000)、FNDC5 (1∶1 500)、Wnt3a (1: 5 000)、β-catenin(1∶1 500)] 4 ℃孵育过夜,二抗(1∶5 000)室温孵育2 h,ECL显色,全自动发光仪显影后使用ImageJ计算目的蛋白条带灰度值。
1.3 统计学方法
2 结果
2.1 左归丸对MC3T3-E1细胞成骨诱导后ALP含量的影响
第5、7、14天细胞上清ALP活力检测结果如图1所示。除了空白对照组外,其余各组的ALP含量都随着成骨诱导的时间而增加,且OGI组、OGI-ZL组、OGI-ZM组增加幅度较大。第14天各组细胞上清ALP活力检测如表1所示。与空白对照组对比,OGI组的ALP活力显著上升(P=0.001);与OGI组比较,OGI-ZL组稍有升高但无显著差异(P=0.402),OGI-ZM组ALP活力显著升高(P= 0.001),OGI-ZH组和siOGI组ALP活力显著下降(P<0.001)。与siOGI组相比,siOGI-ZL组、siOGI-ZM组和siOGI-ZH组都无显著差异。
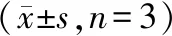
表1 第14天MC3T3-E1细胞上清ALP检测

图1 成骨诱导第5、7、14天各组细胞上清ALP浓度
对细胞进行ALP染色结果如图2所示,ALP活性部分出现在细胞质中呈蓝色。空白对照组未见蓝色染色区,OGI组可见散在的蓝色染色区,siOGI组也仅呈现较少的蓝染。OGI-ZL组和OGI-ZM组可以见到明显的蓝染区域,而OGI-ZH组则相对较少。siOGI-ZL组、siOGI-ZM组、siOGI-ZH组都仅有少量蓝染区。ALP细胞染色结果与细胞上清ALP检测结果呈一致的趋势。
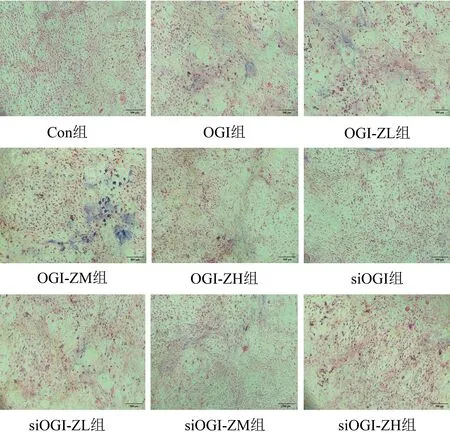
图2 成骨诱导第7天各组细胞ALP染色(40×)
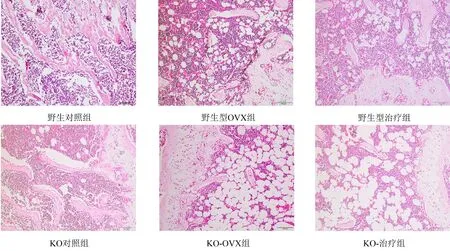
图3 各组小鼠股骨HE染色切片(200×)
2.2 小鼠股骨BMD检测
与野生型对照组小鼠相比,KO对照组小鼠BMD稍微下降(P=0.089),卵巢切除后的野生型OVX组小鼠的BMD显著下降(P<0.001);与野生型OVX组相比,野生型治疗组小鼠的BMD明显上升(P=0.002);与KO对照组小鼠相比,KO-OVX组小鼠的BMD显著下降(P<0.001);与KO-OVX组小鼠相比,KO治疗组小鼠无明显差异(P=0.162)。见表2。
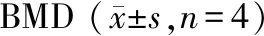
表2 各组小鼠股骨
2.3 小鼠股骨HE切片
在镜下野生型对照组和KO对照组的小鼠股骨骨小梁较为致密、结构完整、连续性好、骨小梁之间间距较窄。OVX组的小鼠股骨骨小梁稀疏变细,结构断裂,连续性差,间距变宽。KO-OVX组的小鼠股骨切片较KO对照组的小鼠也明显表得稀疏、断裂以及较大的间隙,同时股骨内的脂肪组织明显增加。较于野生型OVX组,野生型治疗组的小鼠股骨骨小梁面积变宽,结构较为完整、连续性改善,间距变小。而相较于KO-OVX组,KO治疗组的小鼠在左归丸的治疗下,股骨骨小梁依旧稀疏细短,结构断裂,连续性差,间距宽及较多脂肪组织。见图2。
2.4 小鼠血清ELISA检测
与野生型对照组相比,野生型OVX组的小鼠血清E2、PINP、Irisin含量显著减少;与野生型OVX组相比,野生型治疗组的小鼠血清E2、PINP、Irisin含量显著减少;与KO对照组相比,KO-OVX组血清E2、Irisn含量下降,但无显著差异,PNIP显著减少;与KO-OVX组相比,KO治疗组小鼠血清E2、PINP、Irisin无明显差异。见表3。
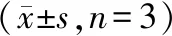
表3 小鼠血清ELISA检测
2.5 小鼠股骨组织成骨相关基因mRNA表达
与野生型对照组相比,野生型OVX组和KO对照组Runx2、OSX、OCN mRNA明显降低,KO-OVX组较KO对照组Runx2、OSX、OCN明显下降;野生型治疗组相较野生型OVX组Runx2、OSX、OCN显著升高,而KO-OVX组和KO治疗组无明显差异。在OPN方面,野生型OVX组较野生型对照组的OPN显著上升,野生型治疗组较野生型OVX组显著降低;而KO-OVX组较KO对照组显著降低,KO治疗组和KO-OVX组无显著差异。见表4。
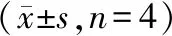
表4 股骨组织Runx2、OPN、OCN、OSX mRNA相对表达量
2.6 FNDC5 mRNA表达和FNDC5、Wnt3a、β-catenin蛋白表达
与野生型对照组相比,KO对照组小鼠的股骨FNDC5 mRNA表达明显降低(P=0.03);相比较于野生型OVX组,野生型治疗组FNDC5表达显著上升(P=0.004);而比较于KO-OVX组,KO治疗组FNDC5表达无明显差异(P= 0.840)。见表5。
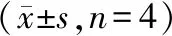
表5 小鼠股骨FNDC5 mRNA表达
与野生型对照组相比,野生型OVX组和小鼠股骨组织中FNDC5、Wnt3a、β-catenin蛋白表达显著减少(P<0.05),KO对照组中FNDC5、β-catenin蛋白表达显著减少。与野生型OVX组相比,野生型治疗组Wnt3a、β-catenin蛋白表达显著上升(P<0.05)。与KO对照组相比,KO-OVX组的FNDC5、Wnt3a、β-catenin蛋白表达显著减少(P<0.05);而KO治疗组与KO-OVX组的蛋白表达均无明显差异。见图4。
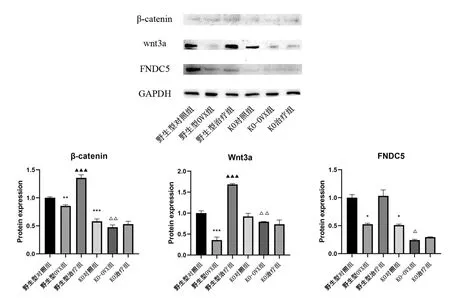
图4 各组小鼠股骨组织中β-catenin、Wnt3a、FNDC5蛋白表达
3 讨论
中医认为,肾主骨生髓,肾精的充盛程度与骨强弱关系密切。补肾壮骨的本质就是通过补肾促进骨形成,使骨形成大于骨吸收从,而达到壮骨的效果。左归丸作为经典的补肾方剂,在临床上一直以来都是治疗PMOP的重要方剂,但是其内在的作用机制一直尚未阐明。
本研究使用了siRNA转染技术沉默了MC3T3-E1细胞FNDC5的表达,进而从体外实验上探讨左归丸促进MC3T3-E1细胞成骨分化与FNDC5之间的关系。成骨诱导后,通过细胞上清ALP检测和细胞ALP染色,发现了低、中浓度的左归丸含药血清可促进MC3T3-E1细胞ALP表达,而转染FNDC5会抑制左归丸含药血清对ALP表达的促进。
体内实验结果发现左归丸可以显著改善野生型小鼠OVX术后导致的BMD降低以及股骨骨小梁的损害,左归丸的治疗并不能显著的缓解KO小鼠OVX后BMD的降低和骨小梁的损害。这说明左归丸发挥治疗PMOP的作用与FNDC5/Irisin有着潜在的关系。PINP是骨形成的重要标志[8],在骨转化的初期会显著提高,并且随着PINP含量降低,骨形成弱于骨吸收,骨量以及骨强度随之下降[9]。Runx2基因是调节成骨细胞分化和骨形成的重要靶基因,是Wnt/β-catenin通路影响成骨细胞分化所必需的靶基因[10]。OSX是一种可以促进骨形成进程的成骨相关转录因子,同时也是Runx2的下游靶基因[11]。OCN是一种钙结合蛋白,可以参与钙和骨转化代谢,能促进钙沉积,是骨形成的标志[12]。OPN是由破骨细胞和成骨细胞生成的一种多糖蛋白,在骨转化活跃的时候显著上升,可激发骨吸收[13]。OVX术后,小鼠血清雌激素E2下降,成骨相关的基因OPN增加,小鼠骨转化进入了活跃状态。野生型治疗组小鼠在左归丸的干预下,抑制了OPN的增加,缓解E2下降,并提高了血清PINP含量和Runx2、OSX、OCN等成骨分化相关基因的mRNA表达。而对比KO-OVX组,KO治疗组的E2、PINP、OPN、Runx2、OSX、OCN等指标均没有明显差异。此外本研究检测了FNDC5、Wnt3a、β-catenin的蛋白表达,结果显示左归丸可以上调Wnt3a和β-catenin的表达,但当FNDC5被敲除后这种上调效果被显著抑制。这些结果说明了左归丸可能通过FNDC5来激活Wnt3a/β-catenin信号通路,进而促进了Runx2、OSX、OCN的表达,抑制OPN,从而促进了成骨分化使骨形成大于骨吸收,改善了PMOP小鼠的骨代谢。
综上所述,左归丸可能通过增强成骨基因Runx2、OSX、OCN等的表达促进成骨分化来改善OVX小鼠的骨质疏松,或许是通过调控FNDC5/Wnt3a/β-catenin信号通路实现的,FNDC5很有可能是左归丸治疗的靶蛋白。

