益肾蠲痹丸干预相关通路介导细胞焦亡对膝骨性关节炎大鼠的影响
马富海 李廷栋 赵庆 唐晓栋 陈国栋 李昭成 白登彦
1.甘肃省中医院,甘肃 兰州 730050
2.甘肃省肿瘤医院,甘肃 兰州 730050
3.甘肃省第二人民医院,甘肃 兰州730030
膝骨性关节炎(knee osteoarthritis,KOA)是一种以膝关节滑膜组织退行性病理改变并伴发炎症因子水平异常增高的临床常见疾患,该病发病率呈逐年上升趋势。研究显示,KOA的发病多与自身免疫性病变、软骨退变等有关,近年研究发现,KOA发病与细胞炎症反应及细胞焦亡等有密切关系,但具体发病机制仍不明确[1]。相关研究指出,KOA发病时多伴有体内炎症因子异常表达、细胞焦亡等特异性表现[2-3]。NLRP3/NF-κB/Caspase-1是机体细胞焦亡的主要信号通路,该通路关键激酶的磷酸化过程会干预细胞的转录、增值、分化、凋亡及炎性反应过程,其中NLRP3是重要的炎症复合体,NF-κB主要负责调控炎症因子转录过程,NLRP3激活后会活化Caspase-1及NF-κB通道,诱导IL-1β、IL-18等多种促炎因子的释放,刺激软骨细胞和滑膜成纤维细胞降解基质,增加关节炎的氧化应激反应[4-5]。益肾蠲痹丸在临床上常用于治疗KOA[6-7],但益肾蠲痹丸能否通过调控细胞焦亡关键信号通路NLRP3/NF-κB/Caspase-1来治疗KOA未见实验证实。本实验以NLRP3/NF-κB/Caspase-1信号通路为切入点,通过益肾蠲痹丸干预治疗KOA模型大鼠,为临床治疗KOA提供理论指导。
1 材料与方法
1.1 试剂与仪器
益肾蠲痹丸(国药准字:Z10890004,江苏正大清江制药有限公司,规格:8 g);塞来昔布(优得宁)(国药准字:H20203097,石药集团);IL-1β、IL-18及血管内皮生长因子(vascular endothelial growth factor,VEGF)酶联免疫试剂盒(SP11237,SP12251,SP11235,武汉赛培生物科技公司);HE染色试剂盒(R23261,上海尚宝生物科技有限公司);TUNEL细胞焦亡检测试剂盒(P0012s,上海碧云天有限公司);免疫组化试剂盒(KGP4100,上海臻诺生物科技公司);NLRP3、NF-κB、Caspase-1抗体(13123,11412,15120,美国Cell Signaling Technology公司)。荧光倒置显微镜(日本奥林巴斯);酶标仪(瑞士TECAN公司);石蜡切片机、包埋机(德国Leica公司);KH22R型高速离心机(湖南凯达科学仪器有限公司);DKZ-1恒温震荡水槽(济南爱来宝仪器设备有限公司);FACSCalibur流式细胞仪(美国BD公司);游标卡尺(0.02 mm精度,东莞中特精密仪器公司);YLS-7C足趾容积测量仪(天津诺雷信达科技公司)。
1.2 动物分组与造模
SPF级雌性3月龄SD大鼠90只,体质量(250±20)g,由甘肃中医药大学动物实验中心提供[动物合格证:62001000000630,动物生产许可证号:SCXK(甘)2020-0021]。本研究经甘肃中医药大学伦理委员会审查并通过,实验伦理号:202001170。按随机数字法分为空白组、模型组、阳性对照组、益肾蠲痹丸低、中、高剂量组共6组,每组各15只。实验前后所有大鼠饲养条件一致。适应性喂养1周后开始实验造模,除空白组外,其他5组按照文献[8]采用改良Huith法建立膝骨性关节炎大鼠模型。造模方法:大鼠麻醉后仰卧位固定,右膝关节备皮消毒,暴露关节腔后依次剪断前交叉内侧副韧带,摘除半月板后消毒缝合。6周后进行关节软骨病理切片,如出现软骨表层纤维化糜烂、表面粗糙不平等病理性表现,则证实造模成功。本次实验KOA大鼠模型均造模成功。
1.3 给药
造模成功后进行灌胃治疗,其中5组治疗组按人鼠用药比例换算后药物溶于生理盐水,阳性对照组大鼠给予塞来昔布18 mg/kg干预治疗,益肾蠲痹丸低剂量组大鼠予益肾蠲痹丸25 mg/kg,中剂量组予50 mg/kg,高剂量组予100 mg/kg灌胃干预,空白组和模型组等剂量生理盐水干预,1次/d,连续干预6周。
1.4 取材
末次干预后,3 %的戊巴比妥钠腹腔麻醉大鼠,腹主动脉采血后4 500 r/min离心15 min取上清液冻存待测;取各组大鼠右膝关节软骨组织存于体积分数10 %甲醛溶液中备用。
1.5 实验方法
1.5.1膝关节直径及足趾容积测定:干预后,游标卡尺测量各组大鼠膝关节直径,足趾容积仪测量各组大鼠足趾容积,各指标分别测量3次取均值并记录。
1.5.2ELISA法检测IL-1β、IL-18及VEGF含量测定:取各组上清液,ELISA试剂盒检测各组血清中IL-1β、IL-18及VEGF含量水平变化。
1.5.3HE染色检测膝关节软骨组织病理学变化:取各组大鼠部分关节软骨组织固定,脱钙后进行水合、透明、石蜡包埋处理后,切片厚度约5 μm,在苏木素溶液中染色5 min,冲洗,盐酸乙醇溶液分化,加入伊红染色2 min,脱水,二甲苯封片,在光镜下观察组织病理学改变。
1.5.4流式细胞术检测细胞凋亡:取各组大鼠软骨部分组织细胞,加入AnnexinV-FITC/PI进行双标染色,用流式细胞仪检测各组细胞凋亡情况,激发波长488 nm。
1.5.5TUNEL染色法检测关节软骨组织细胞DNA损伤情况:将关节软骨部分组织乙醇脱水后切片、染色,置于100 %、95 %、85 %、75 %乙醇中逐级脱水后透明,TUNEL试剂盒中试剂1(TdT)和试剂2(dUTP)按照1∶10混合后,孵育各组细胞,在光镜下观察采集图像,每张切片截取等大5个视野,Image J软件分析统计阳性细胞,阳性细胞数/总细胞数×100 %=阳性细胞率。
1.5.6免疫组化法分析:将切片置于枸橼酸缓冲液中修复后加入3 %过氧化氢室温孵育30 min,再加入5 %山羊血清抗原封闭30 min,免疫组化染色观察骨软骨组织中Caspase-1蛋白表达情况。
1.5.7Western Blot法分析NLRP3/NF-κB/Caspase-1信号通路相关蛋白的表达:RIPA裂解缓冲液提取关节软骨组织中的总蛋白,BCA蛋白测定试剂盒测定各组总蛋白质的浓度,蛋白变性后加入到SDS-PAGE凝胶中,电泳后在PDVF膜上进行转膜,添加一抗(1∶1 000)及二抗(1∶1 000),添加ECL显色剂,Image J软件分析蛋白表达量。
1.5.8qRT-PCR法分析NLRP3/NF-κB/Caspase-1信号通路相关mRNA的表达:Trizol试剂盒提取关节软骨组织中总RNA,反转录试剂盒合成cDNA,设计引物后参考mRNA模板反转录cDNA进行实时荧光定量PCR的扩增,引物序列:NLRP3上游引物5′- AGGTATAGTCGCAAACTA,下游引物5′-GTGAGAG AATTGAGTG;NF-κB上游引物5′- CCTGTAA CGCCGAATA,下游引物5′- CTGATCCGA CATTGTCGC;Caspase-1上游引物5′-GGAGAAGT GAAAATTG,下游引物5′-ATCTCTTGCGCTTTGC;β-actin上游引物5′-CACAGCCACTGAATTACACC,下游引物5′-CCTTTGCTGCTTCGCGTTC。扩增条件:提取物90 ℃预变性5 min,90 ℃30 s,循环50次,溶解曲线60 ℃~95 ℃,每15 s升温0.3 ℃,β-actin作为内参,2-ΔΔCt法分析计算mRNA的相对表达量。
1.6 统计学方法

2 结果
2.1 膝关节直径及足趾容积变化
与空白组比较,模型组大鼠膝关节直径明显增长(P<0.05),足趾容积明显增高(P<0.05);干预后,与模型组对比,阳性对照组及益肾蠲痹丸干预组膝关节直接明显降低(P<0.05),足趾容积显著减小(P<0.05),其中益肾蠲痹丸高剂量组显著优于低剂量组(P<0.01)。见表1。
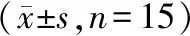
表1 各组大鼠膝关节直径及足趾容积变化比较
2.2 IL-1β、IL-18及VEGF含量变化
与空白组比较,模型组大鼠血清IL-1β、IL-18及VEGF含量明显升高(P<0.05);干预后,与模型组对比,阳性对照组及益肾蠲痹丸干预组血清IL-1β、IL-18及VEGF含量明显降低(P<0.05),其中益肾蠲痹丸高剂量组显著优于低剂量组(P<0.01)。见表2。

表2 各组大鼠IL-1β、IL-18及VEGF含量变化
2.3 膝关节HE染色变化
染色结果显示,空白组大鼠膝关节软骨细胞组织形态完整,细胞排列有序,细胞核充盈完整;模型组大鼠膝关节软骨组织结构改变,细胞排列紊乱,细胞核破损,出现炎性浸润;干预治疗后,阳性对照组及益肾蠲痹丸低、中、高剂量组大鼠膝关节软骨组织细胞逐渐恢复,细胞排列趋向整齐,炎性浸润逐渐减轻。见图1。

图1 膝关节HE染色
2.4 骨细胞凋亡情况
空白组、模型组、阳性对照组及益肾蠲痹丸低、中、高剂量组细胞凋亡率分别为(11.77±1.76)%、(47.56±2.82)%、(18.71±3.53)%、(36.56±1.14)%、(29.57±4.08)%、(22.63±3.11)%,与空白组相比,各组造模后骨细胞凋亡率显著增加(P<0.05);干预治疗后,各治疗组骨细胞凋亡率明显降低,其中益肾蠲痹丸高剂量组显著优于低剂量组(P<0.01)。
2.5 骨细胞DNA损伤情况
TUNEL染色提示,绿色荧光代表细胞损伤。与空白组比较,模型组大鼠软骨细胞TUNEL染色阳性细胞率明显升高(P<0.05),提示存在细胞核DNA损伤;与模型组比较,干预治疗后,各治疗组骨细胞TUNEL染色阳性凋亡率明显降低,其中益肾蠲痹丸高剂量组显著优于低剂量组(P<0.01)。见图2、3。

图2 各组大鼠骨细胞DNA损伤情况比较
图3 各组大鼠骨细胞DNA损伤情况
2.6 骨细胞中Caspase-1蛋白表达
空白组大鼠关节软骨组织中仅有少量Caspase-1蛋白表达。模型组大鼠软骨组织中Caspase-1蛋白出现大量表达。经过干预治疗后,阳性对照组及益肾蠲痹丸低、中、高剂量组大鼠骨组织Caspase-1蛋白表达明显降低。见图4。

图4 各组大鼠关节软骨组织Caspase-1蛋白表达情况
2.7 关节软骨组织中NF-κBp65、p38MAPK、Caspase-1蛋白表达
与空白组比较,模型组大鼠关节软骨组织中NF-κBp65、p38MAPK、Caspase-1蛋白表达量明显上升(P<0.05);干预后,与模型组比较,阳性对照组及益肾蠲痹丸低、中、高剂量组大鼠NF-κBp65、p38MAPK、Caspase-1蛋白表达量明显下降(P<0.05),其中益肾蠲痹丸高剂量组显著优于低剂量组(P<0.01)。见表3、图5。

图5 关节软骨组织中NF-κBp65、p38MAPK、Caspase-1蛋白表达量
表3 各组大鼠关节软骨组织中NF-κBp65、p38MAPK、Caspase-1蛋白表达量比较
2.8 关节软骨组织中NF-κBp65、p38MAPK、Caspase-1mRNA表达
与空白组比较,模型组大鼠关节软骨组织中NF-κBp65、p38MAPK、Caspase-1mRNA表达量明显上升(P<0.05);干预后,与模型组比较,阳性对照组及益肾蠲痹丸低、中、高剂量组大鼠NF-κBp65、p38MAPK、Caspase-1mRNA表达量明显下降(P<0.05),其中益肾蠲痹丸高剂量组显著优于低剂量组(P<0.01)。见表4。
表4 各组大鼠关节软骨组织中NF-κBp65、p38MAPK、Caspase-1mRNA相对表达量比较
3 讨论
KOA最初见于《黄帝内经·素问·脉要精微论·篇十七》:“膝者筋之府,屈伸不能,行则偻附,筋将惫矣”。中医学将其归为“骨痹”“痹症”范畴,认为其病在筋骨。《张氏医通》指出:“膝为筋之府,膝痛无有不因肝肾虚者,虚则风寒湿气袭之。”《类证治裁痹证》及《医林改错》皆有瘀血致痹之说。以上说明KOA发病是由于肝肾亏损、气血不足导致气机不畅、邪实入侵,进而瘀血内阻,使筋骨失养,不荣则痛。目前临床无治疗KOA的特效药物,因此探究更有效的防治手段成为目前临床工作者的研究热点。益肾蠲痹丸在临床常用于治疗KOA,该方包含熟地黄、淫羊藿、当归、全蝎等20余味药。研究发现,益肾蠲痹丸对于调节骨代谢,抑制炎症因子,减少骨代谢标志物的形成有良好效果[9]。
现代医学表明,KOA发病时常伴有炎症细胞生命周期异常现象,其中淋巴细胞、内皮细胞、单核细胞及成纤维细胞等在免疫应答时会产生过量炎症介质,本研究结果也显示,大鼠在造模后出现明显软骨组织细胞炎性浸润病变,血清中IL-1β、IL-18、VEGF等相关炎症因子含量出现明显增加,表明血液中炎性因子含量增高并损伤软骨组织[10-12]。这与朱玉辉等[13]研究结果一致。细胞焦亡是巨噬细胞依赖细胞质中特殊的含半胱氨酸的天冬氨酸蛋白水解酶Caspase-1介导的特殊程序性细胞死亡。研究表明,细胞焦亡与KOA发病存在密切联系[2]。当NLRP3/NF-κB/Caspase-1信号通路被激活时,NLRP3与细胞质中的凋亡相关斑点样蛋白氨基酸转运蛋白结合,并与Caspase-1形成炎症小体,同时激活NF-κB炎症通路,切割非活性前体(pro-IL-1β)及(pro-IL-18),成为活性的IL-1β和IL-18并引发持续性炎症反应,从而提高机体抵抗内源性和外源性刺激[14-16]。本研究也发现,大鼠造模后,细胞凋亡及DNA损伤明显增加,NLRP3/NF-κB/Caspase-1信号通路相关蛋白及mRNA的表达均增高,这说明KOA发病时,机体中的细胞焦亡通路被激活并发生异常表达,该结果与喻溢楠等[17]一致。相关研究发现,在KOA大鼠中,NLRP3过表达可诱导VEGF表达的增加,而且VEGF会正反馈刺激NLRP3 和IL-18含量的增长[18-19]。本研究也发现,造模后大鼠体内VEGF含量伴随NLRP3/NF-κB/Caspase-1信号通路的表达明显升高。本研究还发现,KOA大鼠在经过益肾蠲痹丸干预后,体内细胞凋亡率明显减弱,软骨细胞组织炎性浸润明显好转,IL-1β、IL-18及VEGF含量显著降低,说明益肾蠲痹丸在改善KOA导致的膝关节软骨退变及炎性损伤方面有明显效果;而且不同浓度的益肾蠲痹丸干预下,KOA大鼠体内NLRP3/NF-κB/Caspase-1信号通路相关蛋白及基因的表达明显降低,说明益肾蠲痹丸能够下调细胞焦亡关键通路的表达,抑制NLRP3/NF-κB/Caspase-1信号通路激活,从而改善KOA导致的炎症反应及组织损伤。
综上所述,益肾蠲痹丸能够有效减轻KOA大鼠关节软骨组织病理改变,抑制细胞凋亡和炎症因子过表达,其机制可能与益肾蠲痹丸调控NLRP3/NF-κB/Caspase-1信号通路改善细胞焦亡反应有关。后续课题组将继续深入探究益肾蠲痹丸治疗KOA的相关证据,以期指导临床。

