乳及乳制品中黄曲霉毒素检测技术研究进展
杨 帆,黄建辉,陈 琛,关书会,刘广鹏,张 岩*
(河北省食品安全重点实验室,国家市场监管重点实验室(特殊食品监管技术),特殊食品安全与健康河北省工程研究中心,河北省食品检验研究院,河北 石家庄 050227)
黄曲霉毒素是一种来源于自然界中霉菌的毒素,已经被证明可导致人类癌症。近年来,健康饮食观念随着生活水平的提高逐渐深入人心,乳及乳制品由于富含维生素、钙、钾以及蛋白质等营养成分成为人民青睐的健康食品,但部分存在黄曲霉毒素污染问题,这对国民健康构成极大威胁,因此加强黄曲霉毒素残留的检测对于把控乳及乳制品质量安全具有十分重要的意义。目前常用的测定黄曲霉毒素残留方法有薄层色谱(thin layer chromatography,TLC)法、液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)法、光谱法、电化学法、快速检测试纸条法等。本文就黄曲霉毒素来源及危害、国内外限量标准、检测方法等方面进行综述,为进一步开展乳及乳制品中黄曲霉毒素检测技术发展提供思路。
1 黄曲霉毒素的来源与对人体的危害
黄曲霉毒素是黄曲霉菌和寄生曲霉等某些菌株产生的双呋喃环类毒素,是Ⅰ类致癌化学物质[1]。1960年,英国10 万只火鸡死于一种不为人知的疾病,经过研究证实当时用作火鸡饲料的花生饼在其种植、贮藏、加工或运输环节可能被黄曲霉菌污染,其产生的“黄曲霉毒素”造成火鸡的死亡,自此,黄曲霉毒素受到科学家的特别关注[2]。
黄曲霉毒素基本结构为二呋喃环和香豆素,物理化学性质相当稳定,难溶于水,对光和弱酸稳定,强碱或270 ℃高温下才会发生分解[3]。黄曲霉毒素在湿热环境中最为常见,易存在于土壤和动植物中,尤其是富含脂肪酸的稻谷、玉米、豆类、坚果、牛乳及乳制品、食用植物油制品等。目前已经发现了20多种黄曲霉素素,一般分为B族(黄曲霉毒素B1(aflatoxin,AFB1)、AFB2)、M族(AFM1、AFM2)和G族(AFG1、AFG2),其中AFB1、AFB2、AFG1、AFG2在农产品中较为常见,它们的分子结构相似,可根据自身荧光颜色分类,B代表蓝色,因为暴露于紫外线时会发出蓝色荧光;G代表绿色,因其在紫外光下发出黄绿色荧光而得名[4];M的意思即是“牛乳”,贮存条件不当的饲料最易被黄曲霉毒素破坏,奶牛在长期摄食污染黄曲霉毒素的饲料后,极易出现抵抗力降低和营养不良的现象,给奶农造成严重损失[5],少部分会分别转化为AFM1和AFM2进入乳汁。
黄曲霉毒素具有致突变性,由于本身不能引起突变,必须在机体内经过代谢活化后才具有致突变作用,称为间接致突变物,能使人成纤维细胞发生程序外DNA合成,动物实验可见染色体畸变、断裂和缺失[3]。
黄曲霉毒素是一种剧毒的致肝癌物质,毒性远高于氰化物、砷化物和有机农药,有很强的急性毒性,也有显著的慢性毒性[6],其中AFB1在污染食品中含量最高,毒性和致癌性也最强,对人体健康危害最大,可引起细胞错误修复DNA,导致严重的DNA诱变,还可抑制DNA和RNA的合成,从而抑制蛋白质的合成[7]。人摄入大剂量的黄曲霉毒素后可出现肝实质细胞坏死、胆管上皮细胞增生、肝脂肪浸润及肝出血等急性病变,前期症状为发烧、呕吐、厌食、黄疸,继而出现腹水,下肢浮肿并很快死亡[6]。慢性中毒表现为生长障碍。肝脏出现亚急性或慢性损伤,体质量减轻,诱发肝癌[8]。AFM1会以含有AFB1新陈代谢物的方式加入生乳和乳制品中,而AFB1效应的重要靶脏器为肝脏,是引起肝癌最重要的原因之一[9]。2017年10月27日,世界卫生组织国际医学研究机构发布的致癌物清单开始汇总使用,黄曲霉毒素首次被列入致癌物清单。
2 黄曲霉毒素国内外限量标准研究
在食品安全越来越被重视的当下,黄曲霉毒素限量的安全性也引起国内外高度关注,各个国家和地区对于乳与乳制品中黄曲霉毒素的限量都有明确法律规定(表1)。

表1 部分国家或地区黄曲霉毒素限量标准对比Table 1 Aflatoxin limit standards in some countries and regions
通过我国与欧盟、日本、美国等其他国家的限量标准比较可以看出,欧盟是制定标准最为严苛的地区[10]。我国黄曲霉毒素限量标准根据产品类别不同设置各自的限量数据,此种做法更为严谨,也更符合我国居民食物消费量和健康保护水平。并且我国黄曲霉毒素的限量水平是以保护消费者健康作为首要目标,与国际食品法典委员会和美国标准水平保持一致,尤其是婴幼儿食品和乳制品[10]。
近年来黄曲霉毒素越来越被重视,各个国家和地区对其标准要求趋于严格,更应关注限量变化动态,及时跟进与评估。
3 黄曲霉毒素检测方法研究
黄曲霉毒素的分析方法已被广泛开发应用,主要分析方法有以下几种:TLC、LC-MS、光谱法、电化学法、快速检测试纸条法等,寻找高特异性和强实用性的检测方法是未来的发展方向。不同方法适用于各自特定情况,因此需要综合考虑测定目的、条件和要求再选择合适的方法:例如,黄曲霉毒素的天然或诱导荧光有助于其检测,在TLC法中会与扫描仪器结合,根据荧光光斑强弱测定黄曲霉毒素含量;HPLC与MS或其他技术结合的方法,是实验室常规使用的测定方法;快速检测试纸条法通常使用黄曲霉毒素的特异性抗体,在现场检测领域有着十分重要的应用。
3.1 TLC
TLC是黄曲霉毒素分析中最广泛使用的检测方法之一,高效薄层色谱法(high performance thin layer chromatography,HPTLC)是最有效和精确的检测方法之一,二者在国标方法中都有使用。TLC的原理是将经过前处理的样品在薄层分离后,再根据其自身受光照后荧光的强弱来测定其含量。
Hamed等[11]利用高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection,HPLC-FLD)开发了同时测定乳与乳制品中8 种黄曲霉毒素的方法,实验发现,该方法在优化条件下对AFB1、AFB2、AFG1和AFG2均取得良好的定性及定量效果,方法回收率为82%~104%。Shuib等[12]利用免疫亲和柱去除样品中的AFB1、AFB2、AFG1和AFG2,随后又使用Hypersi gold C18柱分离AFM1,结果表明,当甲醇作为流动相后,AFM1的峰面积增加67%,当采用柱后光化学衍生法测定AFM1时,检出限由0.013 µg/L降到0.002 µg/L,线性范围为0.004~0.500 µg/L。随后Shuib等[13]又建立了一种同时测定AFB1、AFB2、AFM1、AFM2的方法,该法使用Hypersil gold C18色谱柱在40 ℃环境下对黄曲霉毒素进行分离,4 种黄曲霉毒素可在35 min内完全分离,检出限分别为0.005、0.003、0.004、0.004 ng/mL,回收率为73.0%~109.6%。
TLC法的优点是可以在单个测试样品中同时检测几种类型的黄曲霉毒素,但检验过程对技术人员的操作熟练程度有要求,同时检测设备昂贵、测定时间过长、复杂样品预处理繁琐、低浓度峰形不好等都限制了TLC法在实验室的应用,同样也不适用于现场检测。
3.2 LC-MS
LC-MS法检测精度高、灵敏度高、再现性好,是实验室测定黄曲霉毒素的常规定量方法。GB 5009.24—2016《食物中黄曲霉毒素M族的测定方法》和GB 5009.22—2016《食物中黄曲霉毒素B族和G族的测定方法》都使用了LC-MS检测黄曲霉毒素。LC-MS借助黄曲霉毒素的同位素内标物实现对黄曲霉毒素的精准分析,合适的前处理方法和提取剂可以提高精准度。
宗万里等[14]研究了一种无需使用免疫亲和柱的前处理方法,直接在牛乳中添加乙腈,直接将涡旋振荡离心后的上清液用质谱测定,该法简便、快速、成本低,应用于大批量样品中AFM1的快速测定。Zhang Yi等[15]开发了一种特异性好的诱导剂功能化的吸附剂,其与AFM1特异性结合,再经过萃取和洗脱后便可质谱检测。华宇等[16]通过甲醇提取牛乳样品上清液,并使用MycoSepTM226 AflaZon+Multifunctional净化柱,再通过同位素内标进行基质校准,迅速完成净化过程,大大提高检测效率。Du Lijing等[17]将二氧化硅微粒和甲醇用作吸附剂和解吸溶剂来净化、富集乳中的AFM1和AFB1,再通过质谱对AFM1和AFB1含量加以测定,获得了良好的效果。Mehta等[18]使用含有体积分数2%甲酸的低温乙腈来提取乳中黄曲霉毒素残留,并对其进行水浴、低温冷藏、离心、干燥、复溶等步骤,再利用LC-MS测定残留含量。曹叶中等[19]研究了一种快速、成本较低的前处理方案,首先使用含0.5%乙酸的乙腈溶液用作提取剂,再使用硫酸镁和氯化钠溶液来促使分层,最后用LC-MS测定残留量。张俊等[20]将甲醇用作提取液,经离心、稀释后使用免疫亲和柱净化,最后将待测液洗脱优化后测定,检验结果满足灵敏度要求。
此外,黄曲霉毒素还可采用间接方法进行测定。Perez等[21]开发了一种基于间接生物素化抗体的免疫分析方法,当牛乳中含有AFM1时,金纳米颗粒就会游离出来被电感耦合等离子体质谱检测,由此间接测定残留含量。
上述各方法的指标参数见表2。
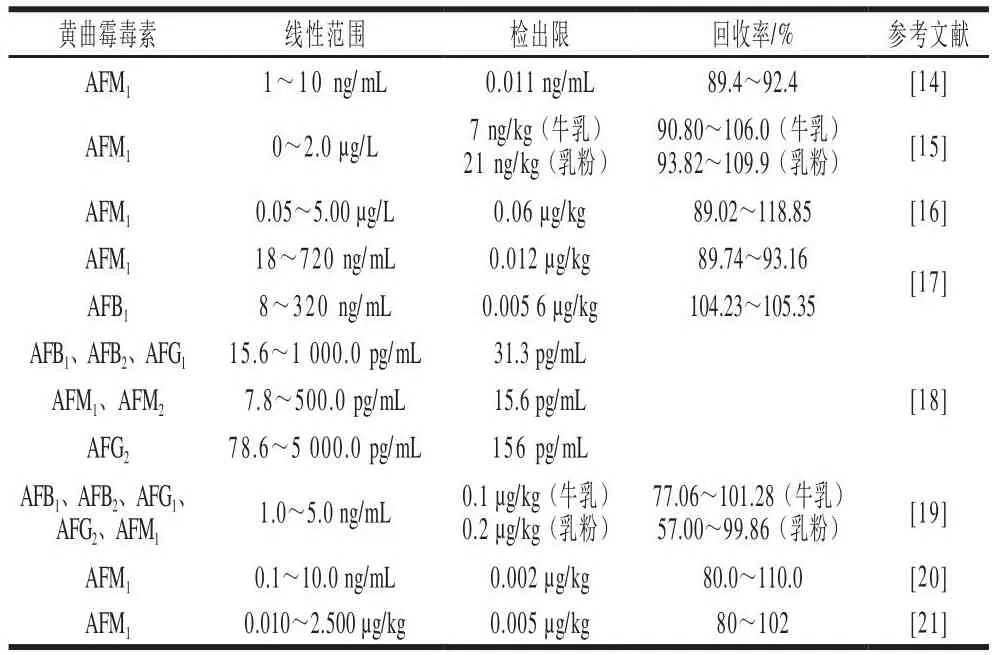
表2 各检测方法的线性范围、检出限和回收率Table 2 Linear ranges, detection limits and recoveries of LC-MS for AFTs
LC-MS的优点是具有精确的检测结果,但因为其使用免疫亲和柱和黄曲霉毒素同位素内标物,成本昂贵,因此只适用于定量检测,不适用于大批量样品检测。LC-MS未来发展方向应该着重放在开发外标方法及研究新的普通固相萃取柱或磁性吸附材料。
3.3 光谱法
目前有研究机构正在利用光谱法测定食物中的黄曲霉毒素,包括荧光光谱法、红外光谱法和其他光谱法,这些方法在测定牛乳中的黄曲霉毒素时取得了较好的效果。光谱法具有特异性高、检测速度快等优势,但也因适配体传感器制备过程复杂、必须使用DNA试剂等因素制约了自身的发展应用。
3.3.1 荧光光谱法
Li Guangming等[22]利用水热法制备出高发光率氮掺杂的碳点,将其与碱性磷酸酶联合使用研制出一种基于碳点内滤效应的无标记免疫传感器,高量子产率的碳点大大提升了传感器的灵敏度,牛乳中AFM1的检出限低至0.018 6 ng/mL。郭婷等[23]将羟基荧光素修饰的适配体用作识别器,将具有猝灭性和磁分离性的Fe3O4纳米材料用作荧光猝灭剂,适配体在遇到AFM1时会从Fe3O4表面脱附,荧光信号就会增强,以此测定样品中的AFM1,检出限为0.02 µg/L。Li Hui等[24]通过晶种生长法制备了尺寸为33 nm的钯纳米颗粒,通过其与5-羧基荧光素间的荧光共振能量转移建立新方法,优化条件后的AFM1检出限为1.5 pg/mL。Jia Yongmei等[25]使用季胺化四苯基乙烯盐、氧化石墨烯和AFB1适配体制备一种无标记的荧光适配体传感器,此方法无需荧光素进行标记,简化流程,提升效率,测定AFB1的检出限为0.25 ng/mL。Guo Xiaodong等[26]使用羟基荧光素标记核酸适配体,再加入氧化石墨烯猝灭其荧光,同时氧化石墨烯还可保护适配体不被核酸酶裂解,当适配体与AFM1结合后会从氧化石墨烯表面脱离,且在酶的作用下裂解,核酸适配体重新放光,从而实现对AFM1的定量测定,检出限为0.05 µg/kg。Niazi等[27]将时间分辨荧光纳米颗粒用作信号针,将石墨相氮化碳纳米片用作荧光猝灭剂,利用滚环扩增技术实现样品中AFM1测定,即便同时存在AFB1和AFB2,其结果也不会被干扰。Zhou Yaofeng等[28]将量子点珠用作竞争抗原的载体,因为尺寸为150 nm的量子点珠能够降低竞争抗原对抗体的亲和力,荧光信号强度得以增强,在检测时首先用AFB1-牛血清蛋白在量子点珠表面标记,再结合酶联免疫技术和荧光法测定乳及乳制品中AFM1含量。Qiao Qinqin等[29]使用羧基荧光素修饰的核酸适配体,并使用羧基四甲基罗丹明猝灭基团修饰与适配体互补的DNAs,二者杂交后DNAs的猝灭基团将导致核酸适配体荧光猝灭,当样品中含有AFM1时,AFM1优先与核酸适配体结合导致荧光信号再现,最佳条件下检出限为0.5 ng/mL。
3.3.2 红外光谱法
红外光谱法检测黄曲霉毒素时只需将样品制片,不需要复杂的前处理过程;与色谱仪和质谱仪相比,红外光谱仪成本更低。Jha等[30]首先使用傅里叶变换红外分光光度计和化学计量学建立牛乳样品中AFB1的定量检测方法,然后使用同样方法测定牛乳中的AFM1也取得了良好效果,在650~1 800 cm-1和3 499~3 689 cm-1波数范围内光谱图峰形显著,检出限低至0.02 µg/L。
3.3.3 其他光谱法
Lerdsri等[31]基于局域表面等离子体共振原理,结合纳米金颗粒(AuNPs)开发了一种无标识的比色传感器,氯化钠的存在会促使该传感器利用适配体与AFM1和AuNPs产生聚集效应,由聚集AFM1的体系表面等离子体共振峰移导致溶液由红色转变为紫色甚至深蓝色,从而实现比色法测定AFM1含量。Jalalian等[32]将AuNPs和适配体分别用作比色剂和探针,将基于链霉亲和素包裹的二氧化硅纳米颗粒、AuNPs与适配体制备成互补链传感器,当被测样品中AFM1浓度高时呈红色,反之呈紫色。Tsounidi等[33]利用白光反射光谱研发了一种微型光学免疫传感器,该传感器由测量装置和生物芯片构成,测量装置包括反射探针、光源和光谱仪,生物芯片是将AFM1-牛血清蛋白结合物固定在SiO2的硅芯片,该传感器可测定各种品种乳中AFM1,并且样品无需稀释和处理。
3.4 电化学法
电化学法在检测领域被广泛使用,其优点为成本低、测定迅速、灵敏度高。电化学法通常间接测定黄曲霉毒素含量,方法一是利用适配体与黄曲霉毒素结合产生的复合物阻碍电极表面电子传递,通过电化学传感器的电阻变化来实现黄曲霉毒素的定量检测[34];方法二是黄曲霉毒素可将事先固定在电极表面的物质置换出来,通过该物质的氧化还原反应来间接检测黄曲霉毒素[35]。
Ahmadi等[36]在铅笔芯电极表面固定还原氧化石墨烯和金纳米颗粒,再将其浸泡在乙硫醇改性的适配体溶液1 h后得到特异性传感器,因为AFM1会使电化学传感器电阻变大,便可通过电化学阻抗法间接测定AFM1。Smolko等[37]将玻碳电极放置在含中性红、硝酸钾和十羧基苯甲酸基柱芳烃溶液中扫描19.5 周,最后用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/N-羟基琥珀酰亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride/N-hydroxysuccinimide,EDC/NHS)技术将AFM1适配体固定在电极表面,制成一种特异性测定AFM1的电化学传感器。Shadjou等[38]把石墨烯量子点、α-环糊精和银纳米微粒固定到玻碳电极表面,当AFM1含量增加时,电流值也随之上升,测定成效也令人满意。Hamami等[39]在丝网印刷电极表层固定AuNPs,再固定二茂铁四乙二醇配体,最后通过EDC/NHS对其修饰后,便可利用电化学阻抗法灵敏测定AFM1。Rahmani等[40]利用电沉积将AuNPs固定到由静电纺丝碳纳米纤维制作的新型衬底电极表面,再将单链DNA修饰到电极表面制得特异性传感器。Aissa等[41]利用丝网印刷电极和二茂铁和硅纳米粒子构成的适配体制备的电化学传感器,在使用循环伏安法和电化学阻抗法测定乳中AFM1时灵敏性优异。Karczmarczyk等[42]将巯基丙酸固定在覆金的丝网印刷电极表面,再通过EDC/NHS作用固定牛血清蛋白-AFM1结合物,最后将其浸泡在乙醇胺溶液中净化,该传感器在测定乳中AFM1时效果良好。
电化学法具有灵敏度高、线性范围广、检出限低、损耗低等优势,但其在稳定性和再现性上表现不佳,很难实现多种黄曲霉毒素的同时测定。
3.5 快速检测试纸条法
快速检测试纸条法具有操作简单、成本较低等优势,因此在现场检测领域发挥着极其重要的作用。试纸条法适用于现场大批量样品快速检测,一旦发现阳性样本则取样带回,利用实验室定量检测方法对结果进行核实,大大提高检测效率,降低检测成本。
Su Zixian等[43]利用可标记AFM1单克隆抗体的材料制备免疫层析检测试纸条,以此进行牛乳中AFM1的测定,检出限低至0.1 pg/mL,灵敏度较高。Han Miaomiao等[44]制备了独特的单克隆抗体和受体,其与AuNPs结合形成8 对抗体-受体偶联物和相应半蛋白偶联物的组合,从而实现1 支试纸条同时测定8 种黄曲霉毒素残留,此方法AFM1的检出限为0.016 ng/mL。此外还有Li Miao等[45]制备了时间分辨荧光微球免疫层析试纸条,蔡芬等[46]制备了胶体金单克隆抗体复合物试纸条,Kasoju等[47]利用微流控制分析装置制备了免疫试纸条,以上检测方法在最佳实验条件下测定牛乳中的AFM1时,检出限最低为0.019 ng/mL。
试纸条法在检测中不需专用仪器,不需复杂前处理,整体用时较短,操作简便易学,对检测人员需求少、要求低,所以非常适用于大批量样本的现场快速检测。但试纸条法只适合于定性检测,其检测精度低,有效性差,再现性差,在定量检测上性能明显不足。
4 结 语
本文比较了国内外各国黄曲霉毒素限量标准的差异,汇总了乳及乳制品中黄曲霉毒素的各项检测技术,阐述了近年来主要应用的TLC、LC-MS、光谱法、电化学法、快速检测试纸条法等检测技术最新研究进展,分析了各类检测技术的优点及其存在的问题,并对今后测定乳与乳制品中黄曲霉毒素检测技术的发展方向做出以下预测:1)特异性好、成本低廉的快速检测试纸条法非常适宜用作大批量样本快速筛查手段,配合读数仪便可迅速获得定性结果和含量数据,实现乳与乳制品中黄曲霉毒素的在线检测,此种检验方法将在生产企业原料验收或食品抽检监测等现场快速检测时发挥重要作用;2)定量检测的未来导向是开发简便、适宜的前处理方法,例如,不需要免疫亲和柱的方法,无需复杂操作就可快速分离、富集样本中的黄曲霉毒素,再配合使用自动化程度较高的质谱法或色谱法,就能够实现大批量样本快速、简便、精准的定量检验;3)其他检测方法的未来导向主要有以下两方面:光谱法的发展方向是开发特异性强、性能稳定、制备简便的适配体传感器;电化学法的发展方向是开发各种高灵敏度修饰电极。这2 种检测方法都能够有效提升检测效率,保证检测稳定性和灵敏度,同时明显节约检测成本。

