白坚木皮醇分子印迹电化学传感器的构建
王芳,刘子超,张鑫,郄浩然,胡培毅,白玉洁,郭建峰*
(1.中北大学化学工程与技术学院,山西太原 030051)(2.中国露酒植物提取与健康山西省重点实验室,山西汾阳 032200)(3.山西杏花村汾酒厂股份有限公司,山西汾阳 032200)
白坚木皮醇,即左旋肌醇甲醚、2-甲氧基-L-(-)-肌醇(Quebrachitol,QCT),是一种广泛存在于植物中的天然光学活性肌醇,具有自由基清除、治疗骨质疏松、减少胃损伤和抗糖尿病等多种生物活性[1-4]。作为手性合成起始材料,可广泛应用于制备多种有价值的旋光性肌醇衍生物,在生物、医药方面受到越来越多的关注[5]。白坚木皮醇在自然界中有5种不同的几何同分异构体[6],但它们的药效学、药动学和毒理学可能存在很大的差异。目前检测的方法包括气相色谱法、高效液相色谱法-二极管阵列法、高效液相色谱法-蒸发光散射法等[7,8]。以上方法显示出高灵敏度和准确性,但也存在一些限制,如需要繁琐的提取和纯化步骤、昂贵的仪器和耗时的衍生化过程,以及不能分辨旋光性[9,10]。因此,灵敏、方便且能特异性的区分左旋结构的白坚木皮醇的分析方法仍然是生物分析和生产提取的关键挑战。
电化学传感器具有快速响应、使用方便、仪器简单等优点,越来越多地用于痕量药物分析[11-13]。已有多项研究应用石墨烯、多壁碳纳米管、纳米金粒等修饰玻碳电极用作开发痕量药物检测的传感器[14-16]。其中,碳纳米管因具有优异的电化学行为、高化学稳定性、生物相容性和高比表面积而受到广泛关注[17,18]。壳聚糖(CS)与多孔纳米材料的化学结合产生了新的特征和功能,可以控制最终材料的组成成分、尺寸大小、形态特征、表面积和表面化学,提高电化学传感技术纳米材料的电传感能力[19]。纳米金粒子(AuNPs)可以通过放大电极表面、增强电活性物质之间的电子转移过程和催化电化学反应来提高电化学传感器的灵敏度[20,21]。
分子印迹聚合物(Molecular Imprinting Polymers,MIPs)是一种通过在模板分子周围聚合功能单体和交联剂而开发的人工仿生抗体,与抗体、酶和适配体相比,它具有更经济、更稳定的优点[22-25]。戴芳芳等[26]以邻氨基酚为功能单体,以间苯氧基苯甲酸为模板分子,采用循环伏安法在玻碳电极(GCE)表面聚合形成可用于检测间苯氧基苯甲酸的分子印迹膜,结合电化学技术用于水中间苯氧基苯甲酸的检测研究,该传感器可30 s准确完成对环境中间苯氧基苯甲酸的检测。An等[27]以甲基丙烯酸(MAA)为功能单体,三聚氰胺为模板分子,采用电聚合法在铁基有机骨架化合物MIL-53(Fe)和普鲁士蓝修饰的电极上合成了具有特定识别位点的三聚氰胺分子印迹聚合物薄膜。该MIP传感器具有良好的重现性和稳定性,可实现低成本、高效地用于液态牛奶样品中三聚氰胺的实际分析。因此,本实验结合MIP和电化学传感器技术构建一种高度特异性且灵敏的方法来检测白坚木皮醇。
1 材料与方法
1.1 仪器与试剂
CHI660E电化学工作站,上海辰华仪器公司;ZEISS MERLIN Compact扫描电子显微镜,德国蔡司公司;410HT超声波清洗机,深圳市洁拓超声波清洗设备有限公司;E27红外干燥灯,深圳市光轩科技有限公司;电化学测量采用三电极系统:工作电极为玻碳电极(GCE)(直径3 mm),对电极为铂电极,参比电极为Ag/AgCl电极(3 mol/L KCl)。
羧基化多壁碳纳米管,南京先丰纳米材料科技有限公司;氯金酸(分析纯),国药集团化学试剂有限公司);白坚木皮醇(色谱纯),上海安谱实验科技股份有限公司;邻苯二胺(o-PD),上海易恩化学技术有限公司其他试剂均为分析纯,实验用水为去离子水。PBS缓冲溶液使用Na2HPO4·12H2O和NaH2PO4·2H2O配制,并使用H3PO4调节pH值。
1.2 实验方法
1.2.1 羧基化多壁碳纳米管/壳聚糖复合材料的制备
将5 mg羧基化多壁碳纳米管(MWCNTs-COOH)细粉分散在含有0.5 mg CS的5 mL醋酸溶液(1%,V/V)中。样品超声处理120 min后,得到均质化羧基化多壁碳纳米管/壳聚糖纳米复合材料,4 ℃保存备用。
1.2.2 白坚木皮醇分子印迹电极及非印迹电极的制备
将玻碳电极采用粒径为1.0、0.5、0.3、0.05 μm的氧化铝粉末打磨,再在乙醇和超纯水中超声洗涤后,用N2吹干。取10 µL羧基化多壁碳纳米管/CS纳米复合材料滴涂在电极表面,在红外灯下干燥后,制备得到MWCNTs-COOH/CS/GCE电极。将MWCNTs-COOH/CS/GCE电极置于0.5 mol/L H2SO4的1 mmol/L氯金酸(HAuCl4)溶液中,在-0.2~1.2 V的电位区间内进行循环伏安扫描,扫描速度为50 mV/s,扫描圈数为7圈,扫描完成后将电极使用乙醇和二次蒸馏水洗净,然后用氮气吹干后制得电极AuNPs/MWCNTs-COOH/CS/GCE。将该电极置于含有1.5×10-5mol/L邻苯二胺1×10-7mol/L白坚木皮醇和1 mol/L KCl的0.1 mol/L pH值7 PBS溶液中,然后通过循环伏安法(CV)进行电聚合,电位区间为-0.1~1 V,扫描速度为100 mV/s,扫描圈数为25圈,在电极上形成白坚木皮醇印迹膜。将聚合后的电极置于甲醇-乙醇混合溶液(V/V=2/3)中洗脱12 min,去除模板分子,即获得白坚木皮醇分子印迹电化学传感器(MIPs/AuNPs/MWCNTs-COOH/CS/GCE)。非印迹电化学传感器(NIPs/AuNPs/MWCNTs-COOH/CS/GCE)按上述同样步骤制备,但不加白坚木皮醇。
1.2.4 沙棘测试样品的预处理
沙棘样品的预处理参考文献[7],具体如下:分别精密称取2 g干燥的沙棘叶和沙棘果肉,进行适当破碎,加入30 mL体积分数为50%的乙醇溶液,在50 ℃条件下超声30 min,抽滤分离过滤液留存,定容后制得样品检测液。
1.3 数据统计分析
本文中设计的数据统计分析和绘图均采用Origin 2019软件完成。
1.2.3 电化学测试
在含有作为支持电解质的0.1 mol/L KCl和作为氧化还原探针的5×10-3mol/L [Fe(CN)6]3-/4-溶液中对电极进行循环伏安法和差分脉冲伏安法(DPV)测试[28],实验电位范围分别为0~1 V和-0.2~0.6 V,扫描速率为100 mV/s。
2 结果与讨论
2.1 MIPs/AuNPs/MWCNTs/CS/GCE的制备与表征
图1展示了MIPs/AuNPs/MWCNTs/CS/GCE的制备流程,可概括为以下三个方面:(1)将MWCNTs-COOH/CS复合材料滴涂到电极表面后,电沉积纳米金粒子,制备可放大电化学信号并形成高表面积的敏感印迹平台;(2)在修饰电极上电聚合分子印迹膜;(3)用甲醇和乙醇组成的洗脱液除去白坚木皮醇模板分子。在电聚合过程中发现,在0.35和0.52 V附近出现邻苯二胺的氧化峰(图2),随着聚合圈数的增加,AuNPs/MWCNTs-COOH/CS/GCE电极在聚合溶液中的氧化峰电流越来越小,直至没有氧化峰。其原因为邻苯二胺聚合聚合物为非电活性物质,随着白坚木皮醇分子印迹聚合膜的形成,分子印迹聚合膜的厚度逐渐增加,阻碍了修饰电极对电子的传递,使得峰电流值逐渐减小,同时也证明了白坚木皮醇分子印迹膜成功修饰在AuNPs/MWCNTs-COOH/CS/GCE电极上。

图1 MIPs/AuNPs/MWCNTs-COOH/CS/GCE的制备流程图Fig.1 Flow chart of preparation of MIPs/AuNPs/MWCNTs-COOH/CS/GCE

图2 分子印迹膜在AuNPs/MWCNTs-COOH/CS/GCE上的电聚合过程Fig.2 Electropolymerization process of molecularly imprinted membrane on AuNPs/MWCNTs-COOH/CS/GCE
通过扫描电镜对修饰过程中电极的形貌进行表征分析,其结果如图3所示。从MWCNTs-COOH/CS/GCE电极的SEM图(图3a)可看出,MWCNTs-COOH相互交织修饰在GCE表面,其管状结构增加了传感器的比表面积;电沉积纳米金后制备出AuNPs/MWCNTs-COOH/CS/GCE电极(图3b),从图中可以看出在多壁碳纳米管的表面附着金纳米粒子(AuNPs),制备得到AuNPs/MWCNTs-COOH/CS/GCE电极。继续在该电极表面电聚合制备白坚木皮醇MIP,聚合后电极表面如图3c所示,在AuNPs/MWCNTs-COOH/CS/GCE表面形成了粗糙的分子印迹聚合膜。

图3 MWCNTs-COOH/CS/GCE(a),AuNPs/MWCNTs-COOH/CS/GCE(b)及MIP/AuNPs/MWCNTs-COOH/CS/GCE(c)的SEM图Fig.3 SEM images of MWCNTs-COOH/CS/GCE (a),AuNPs/MWCNTs-COOH/CS/GCE (b) and MIP/AuNPs/MWCNTs-COOH/CS/GCE (c)
2.2 MIPs/AuNPs/MWCNTs-COOH/CS/GCE的电化学表征
采用CV和DPV法在[Fe(CN)6]3-/4-溶液中研究不同改性电极的电化学行为[29]。在图4A中,裸电极GCE显示了一对清晰对氧化还原峰(曲线a)。在修饰MWCNTs-COOH/CS复合材料后,氧化峰电流值较裸电极增加了94 µA(曲线b)。而在MWCNTs-COOH/CS/GCE电极上沉积AuNPs后,其氧化峰电流值较MWCNTs-COOH/CS/GCE电极增加了92 µA(曲线c),表明修饰的二种纳米材料均显著提高了电极的导电性能。通过电聚合在电极表面修饰分子印迹聚合膜后,电极的氧化峰电流明显降低(曲线d)。因为MIP是绝缘材料,阻碍了氧化还原探针与电极表面之间的电子转移。在去除模板QCT分子后,氧化还原峰电流再次增加(曲线e)。说明去除模板QCT分子后形成了模板形状的印迹位点,使氧化还原探针[Fe(CN)6]3-/4-能够通过形成的模板孔隙进入电极表面,从而使氧化还原峰电流值增大。当MIP/MWCNTs-COOH/CS/GCE浸入含有QCT的溶液吸附一段时间后,印迹腔可以选择性地重新结合QCT分子,导致电子转移通道堵塞,氧化还原峰电流再次下降(曲线f)。图4B通过DPV法研究不同修饰的电极得到了相同的结果。

图4 不同修饰电极的循环伏安图(A)和差分脉冲伏安图(B)Fig.4 Cyclic voltammograms (A) and differential pulse voltammograms (B) of different modified electrodes
2.3 分子印迹传感器制备条件的优化
定义一个ΔI值,即洗脱后MIPs/AuNPs/MWCNTs/CS/GCE的峰电流值减去同一电极吸附1×10-7mol/L白坚木皮醇的峰电流值,以此表示MIPs/AuNPs/MWCNTs/CS/GCE的吸附能力。模板分子和功能单体的摩尔比会影响分子印迹膜的有效识别位点的数量,进而决定了MIP传感器的灵敏度[29]。选择o-PD作为功能单体,模板分子白坚木皮醇的浓度定为1×10-4mol/L,研究了模板分子和功能单体的摩尔比、扫描周期、扫描速率、洗脱时间、吸附时间以及检测pH值对ΔI的影响,结果见图5。图5a显示了模板分子与功能单体对白坚木皮醇印迹效率的影响,结果表明其最适摩尔比为1:10。扫描周期会影响MIP膜的厚度,过薄的MIP膜携带的印迹位点较少,而过厚的MIP膜可能包含过深的MIP网络的印迹位点,从而阻碍模板白坚木皮醇分子的抵达识别位点。图5b显示了MIP电聚合扫描周期对白坚木皮醇印迹效率的影响。当扫描周期为25时获得最大ΔI值。MIP电聚合扫描速率会影响MIP薄膜的致密度,并进一步影响白坚木皮醇向印迹位点的传质过程。从图5c中可以看出,当扫描速率为100 mV/s,时,得到最高的ΔI值。
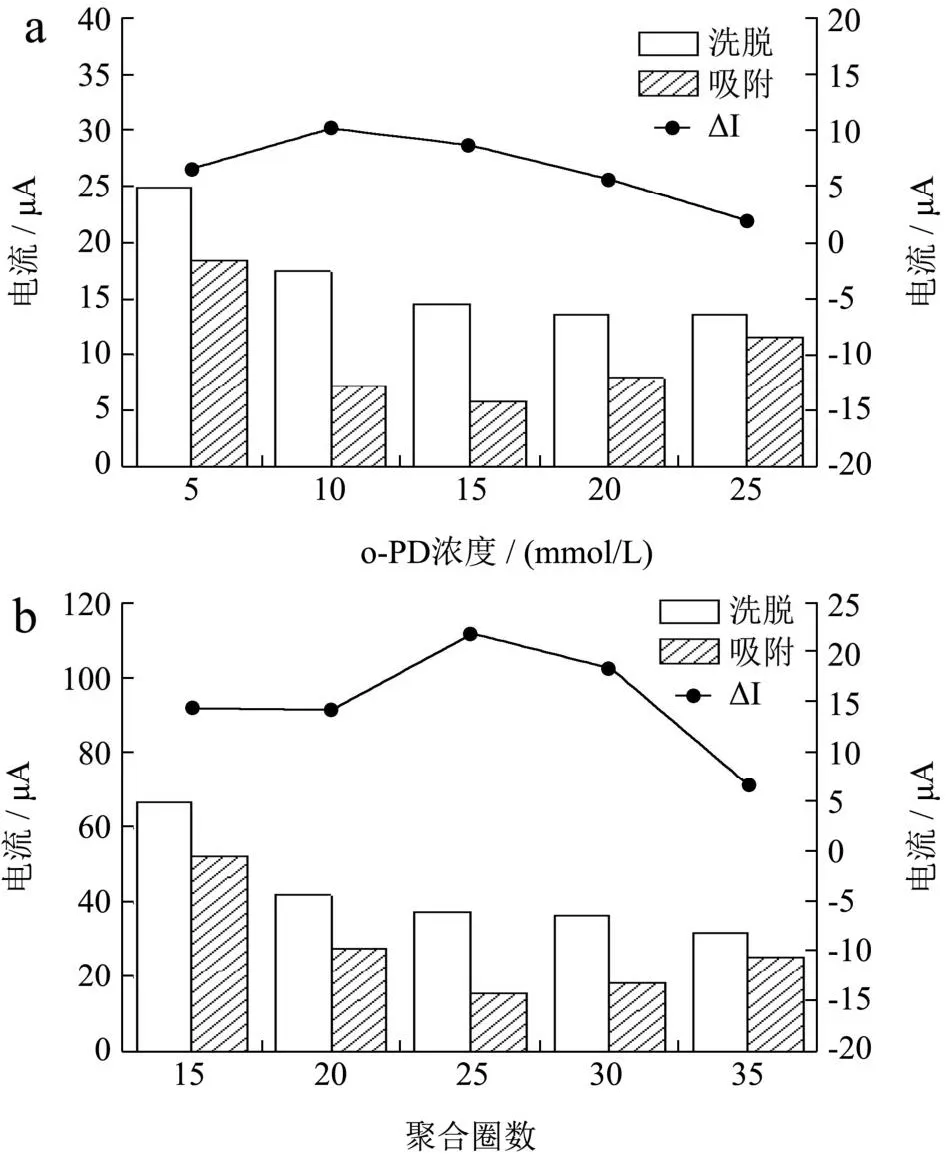
图5 实验条件的优化Fig.5 Optimization of experimental conditions
白坚木皮醇模板分子的去除是通过将分子印迹电极置于甲醇-乙醇混合溶液(V/V=2/3)中洗脱一定时间。洗脱时间的优化结果如图5d所示,随时间的增加,ΔI值逐渐增大,到12 min后ΔI值趋于稳定,所以选择的最佳洗脱时间为12 min。吸附时间的优化如图5e所示,随着富集时间的延长,8 min后趋于稳定。吸附溶液的pH也是影响分子印迹电化学传感器对QCT检测的关键因素之一,实验结果如图5f所示,当吸附溶液的pH值为7时,峰电流值最大。
2.4 MIPs/AuNPs/MWCNTs/CS/GCE传感器的峰电流和白坚木皮醇浓度的关系
在最佳实验条件下,将MIPs/AuNPs/MWCNTs/CS/GCE置于不同浓度的白坚木皮醇溶液孵育12 min后,在含0.1 mol/L KCl的5.0×10-3mol/L K3[Fe(CN)6]溶液中进行DPV测试。从图6a中可以看出,随着白坚木皮醇浓度的增加,电流响应逐渐变小。原因是更多的白坚木皮醇分子占据了印迹腔并阻碍了[Fe(CN)6]3-/4-的电子转移。为探究白坚木皮醇浓度与分子印迹电化学传感器的峰电流关系,定义一个ΔI值,即洗脱后MIP/AuNPs/MWCNTs-COOH/CS/GCE的峰电流值减去同一电极吸附不同浓度白坚木皮醇的峰电流值。图6b显示随着白坚木皮醇的浓度从1.0×10-9mol/L增大到1.0×10-6mol/L,ΔI值逐渐增大,二者有着良好线性关系,拟合的线性回归方程为:
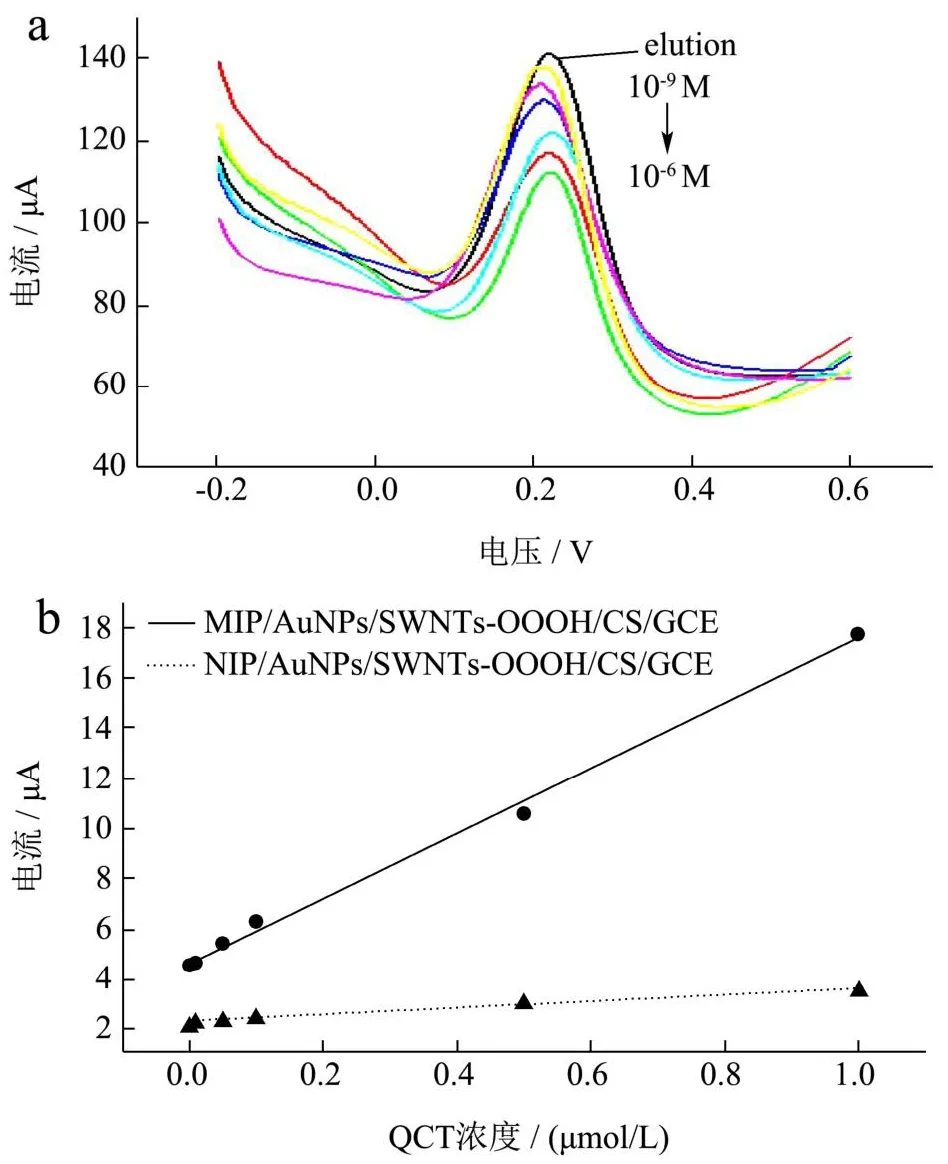
图6 MIP/AuNPs/MWCNTs-COOH/CS/GCE吸附不同浓度白坚木皮醇后的DPV响应图(a);MIP/AuNPs/MWCNTs-COOH/CS/GCE和NIP/AuNPs/MWCNTs-COOH/CS/GCE吸附不同浓度白坚木皮醇前后峰电流值差值ΔI与白坚木皮醇浓度之间的线性关系(b)Fig.6 DPV response graph of MIP/AuNPs/MWCNTs-COOH/CS/GCE after adsorption of quercetin at different concentrations (a); MIP/AuNPs/MWCNTs-COOH/CS/GCE and NIP/AuNPs/MWCNTs-COOH/CS The linear relationship between the difference ΔI of peak current values before and after adsorption of different concentrations of quebrachol by/GCE and the concentration of quebrachol (b)
式中:
ΔI——洗脱后MIP/AuNPs/MWCNTs-COOH/CS/GC的峰电流与同一电极吸附不同浓度白坚木皮醇后的峰电流的差值,µA;
c——白坚木皮醇浓度,µmol/L。
公式(1)的R2=0.996,传感器检测限低至1.6×10-10mol/L(S/N=3)。在相同条件下,作为对照,使用非分子印迹电化学传感器进行检测,结果表明,NIP/AuNPs/MWCNTs-COOH/CS/GCE传感器的线性回归方程斜率较小,线性回归方程为公式(2):
式中:
ΔI——洗脱后NIP/AuNPs/MWCNTs-COOH/CS/GCE的峰电流与同一电极吸附不同浓度白坚木皮醇后的峰电流的差值,µA;
c——白坚木皮醇浓度,µmol/L。
以上结果表明,与非分子印迹传感器相比,分子印迹传感器对白坚木皮醇的响应值更高,因而检测灵敏性更高。
2.5 MIPs/AuNPs/MWCNTs/CS/GCE的选择性、重现性和稳定性分析
为了评估MIP/AuNPs/MWCNTs-COOH/CS/GCE传感器的选择性,通过DPV法检测相同浓度条件下的结构类似物:莽草酸、葡萄糖、肌醇和D-松醇的电流响应值[30,31]。图7展示了MIP/AuNPs/MWCNTs-COOH/CS/GCE浸没在不同干扰物质的溶液中的ΔI值。与白坚木皮醇的响应峰电流相比,干扰物的响应峰电流分别降低了87.93%(D-松醇)、70.91%(肌醇)、90.73%(葡萄糖)、89.43%(莽草酸),表明该传感器对白坚木皮醇分子具有良好的选择性,其原因为AuNPs/MWCNTs-COOH纳米复合材料提供了一个大的表面印迹平台和具有与白坚木皮醇的结构和功能相匹配的高比例印迹空腔。

图7 使用差分脉冲伏安法检测1.0×10-8 mol/L白坚木皮醇及其结构类似物的电流响应图Fig.7 The current response of 1.0×10-8 mol/L quercetin and its structural analogs detected by differential pulse voltammetry
分子印迹传感器的重现性和稳定性是评价其实用性的重要指标。使用相同的方法制备5支修饰电极并分别用来检测5个含有1×10-8mol/L QCT的样品,相对标准偏差为4.43%(表1)。连续7 d检测日间DPV值,每次均在室温下重复检测含1×10-8mol/L QCT的样品,相对标准偏差为5.44%(表2)。此外,传感器存储寿命也是需要考虑的一个重要参数。将MIP/AuNPs/MWCNTs-COOH/CS/GCE传感器置于PBS(pH值7.0)溶液中,4 ℃保存30 d,该传感器仍保持原始响应的94.3%。从以上结果可知该传感器具有良好的重现性和稳定性。
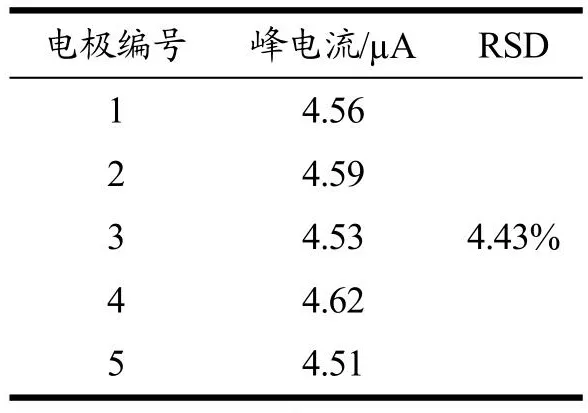
表1 5 MIP支/AuNPs/MWCNTs-COOH/CS/GCE传感器检测QCT的结果Table 1 5 MIP branch/AuNPs/MWCNTs-COOH/CS/GCE sensor detection results of QCT
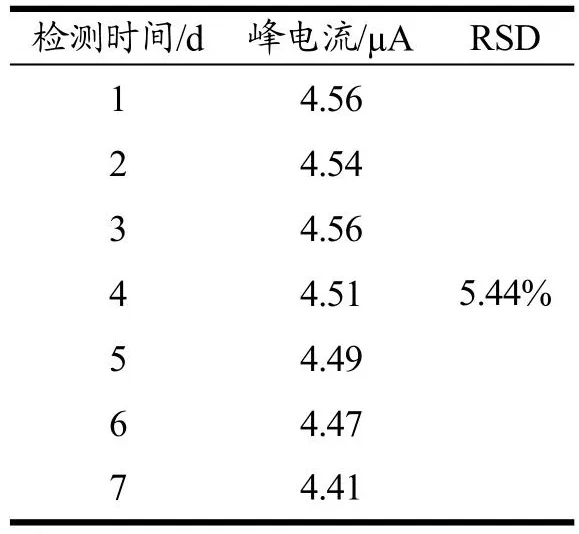
表2 连续7 d日间DPV检测结果Table 2 Daytime DPV detection results for 7 consecutive days
2.6 沙棘实际样品的检测
为了评估MIP/AuNPs/MWCNTs-COOH/CS/GCE传感器的实用性,将该传感器用于沙棘叶(干叶)和沙棘果(鲜果)中白坚木皮醇的检测,检测结果如表3所示,沙棘叶和沙棘果检测液中QCT加标回收率在97.44%~106.19%之间,沙棘叶和沙棘果QCT含量分别为61.23 mg/g和5.3 mg/g,与文献[32]报道一致。以上结果表明传感器在实际应用中有着良好的应用前景。

表3 MIP/AuNPs/MWCNTs-COOH/CS/GCE传感器对实际样品中QCT的检测结果Table 3 Detection results of QCT in real samples by MIP/AuNPs/MWCNTs-COOH/CS/GCE sensor
3 结论
本研究中,构建了一种基于纳米金、羧基化多壁碳纳米管和壳聚糖的新型分子印迹电化学传感器平台,具有较大的比表面积以及优良的传感器性能。优化了实验条件,得出模板分子与功能单体的最佳摩尔比为1:10,最佳电聚合圈数为25圈,最佳电聚合速度为100 mV/s,最适洗脱时间为12 min,最适吸附时间为8 min,构建出白坚木皮醇分子印迹电化学传感器。在此基础上,采用简便的电聚合法通过优化制备条件来控制分子印迹膜的厚度,合成白坚木皮醇分子印迹聚合物,获得了高特异性分子识别位点。该传感器在1×10-6~1×10-9mol/L范围内白坚木皮醇的浓度与响应电流呈良好的线性关系,检测限低至1.6×10-10mol/L,为白坚木皮醇的测定和分子印迹电化学传感器在生物医药分析领域的应用开发了一种新途径。

