驴Zfy基因干扰载体的构建及验证
李梦雨,孙玉江,李超程,吕毅航,范洪先,郑新宝,肖海霞,贾斌*
(1 石河子大学动物科技学院,新疆 石河子 832003;2 青岛农业大学生命科学学院,山东 青岛 266109;3 新疆畜牧科学院畜牧研究所,新疆 乌鲁木齐 830000)
阿胶和驴乳产业的飞速发展,使驴皮和驴乳出现供不应求的现状,驴繁殖力低成为制约驴产业发展最直接的问题[1]。因此,研究驴的性控技术,扩大繁殖母驴数量,实现高效快速扩繁种群,定向培育母畜群体势在必行。
睾丸决定因子TDF(testis-determining factor)的发现,使胚胎阶段的性别分化成为研究热点。研究发现在Y染色体短臂上存在可以调控精细胞转化为精子的基因[2],分别是睾丸决定因子SRY、精原细胞增殖因子Eif2s3y[3]和影响精子成熟的转录因子Zfy2[4]。多种研究表明,Zfy基因是C2H2锌指蛋白转录因子(ZNFs)的家族成员之一,当敲除Zfy的双等位基因发现细胞生长和增殖出现缺陷[5]。随后研究发现,Zfy基因通过“锌指”结构域来调控其他基因的表达,影响精子的发生过程[6]。RNAi技术作为疾病靶向基因治疗的新手段,已被用于各种疾病的治疗。应用RNAi技术沉默Zfy基因表达,使精子在生精阶段相关基因表达量变化,从而影响Y精子活力、畸形率等,Y精子与卵子结合的几率降低,而X精子不受影响,从而达到精子发生阶段控制性别的目的。
本研究应用RNAi技术针对驴Zfy基因编码区设计RNA干扰片段,构建shRNA串联载体,通过睾丸注射技术,干扰Zfy基因表达,使精子在发生阶段Zfy基因表达下降,从而影响Y精子的发育,降低受精几率,最终实现多产母驴的目标。为快速扩繁种群提供理论依据。
1 材料与方法
1.1 试验试剂及仪器
无内毒素质粒大提试剂盒、血液基因组DNA提取试剂盒(北京天根生化有限公司);胎牛血清、DMEM/F12(美国Gibco公司);胰岛素、FSH、睾酮、视黄酸、转铁蛋白、胶原酶Ⅳ、透明质酸酶、维生素A、C、E(美国杰华科技有限公司);丙酮酸、胰蛋白酶、DNase(北京索莱宝科技有限公司);脂质体2000(invitrogen);TBGreen®PremixExTaqTMⅡ(TaKaRa);QI Aamp DNA Mini and Blood Mini Hand book(凯杰生物工程有限公司)。核酸蛋白检测仪(德国Thermo公司);荧光定量PCR仪(美国Bio-Rad公司)。
1.2 试验动物
驴睾丸组织采自新疆石河子九昌驴业有限公司屠宰的青年健康新疆驴新鲜睾丸。
种公驴、空怀母驴由新疆喀什泽普县金胡杨牧业有限公司提供,6头4~6岁青年健康德州公驴,若干头经产健康新疆母驴。经石河子大学医学院第一附属医院医学伦理委员会批准,伦理批准号分别为2020-051-01、2019-061-01,自觉遵守试验动物福利伦理原则,保障动物福利及安全。
1.3 主要试验方法
1.3.1 设计shRNA序列
根据NCBI提供的驴Zfy基因与Zfx基因的CDS区序列,选择两者碱基差异较大区域设计4段siRNA。分别添加loop(颈环)、靶点反义序列及终止密码子合成shRNA干扰片段,为每段shRNA添加U6启动子。将设计好的序列交由上海吉凯生物技术有限公司合成。siRNA序列信息如表1所示。

表1 siRNA序列信息
1.3.2 构建shRNA串联干扰载体
选择4.7 kb质粒载体CV250,将合成好的shRNA片段与载体重组,构建CV250-2shRNA串联干扰载体,并分别命名为CV250-1、CV250-2。shRNA序列和串联载体构建如图1所示。
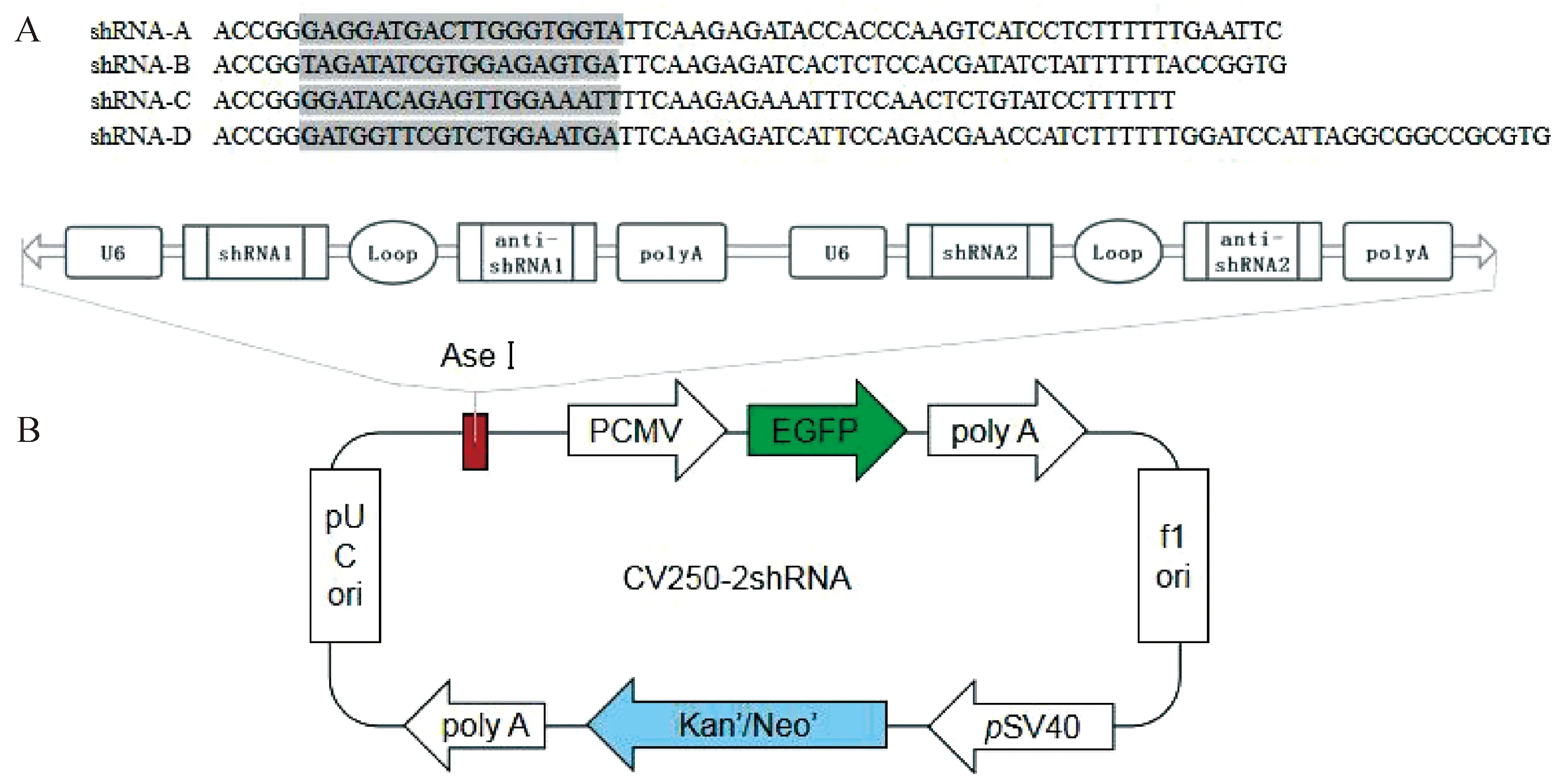
图1 shRNA序列和CV250-2shRNA串联载体构建
1.3.3 细胞水平验证串联干扰载体
采集成熟驴睾丸组织,采用两步酶消化法分离出睾丸支持细胞和生精细胞,并放入完全培养液[7]中在35 ℃、5% CO2、湿度为95%的条件下培养24 h,用脂质体2 000作为转染试剂将1.3.2中保存的载体转染到生精细胞中,每组重复3次。转染58 h后提取生精细胞的总RNA,设计qRT-PCR引物,以驴GAPDH基因为内参基因,以重组载体转染的细胞为试验组,未进行转染的细胞为对照组,检测重组串联干扰载体转染生精细胞后,Zfy基因的相对表达量,计算重组串联干扰载体的干扰效率,选择高效重组串联干扰载体。试验所用引物如表2所示。
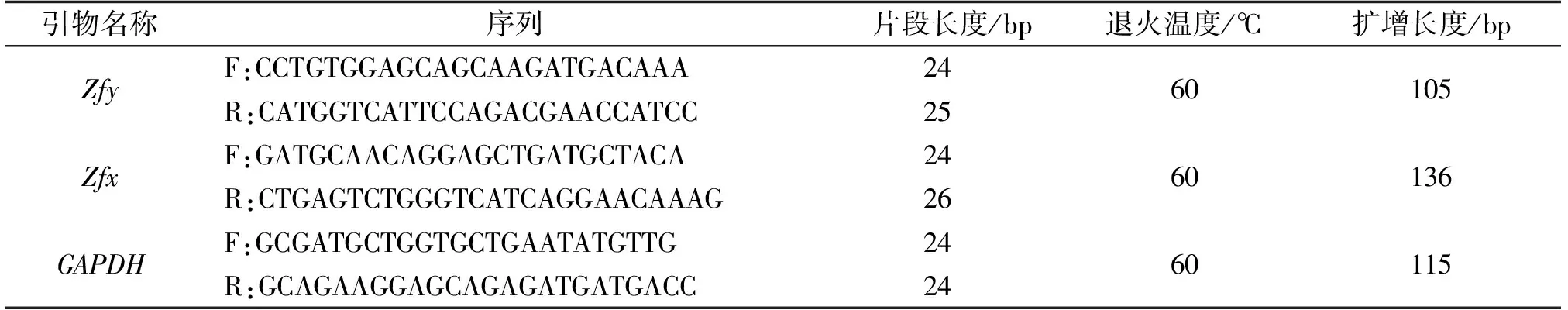
表2 Zfy、Zfx、GAPDH引物设计序列
1.3.4 体内验证串联干扰载体
将1.3.3中经细胞水平筛选的高效重组载体CV250-1用于动物体内干扰试验。根据驴睾丸体积使用睾丸注射法将质粒注射进入驴睾丸组织中,共注射3针,每隔10天注射1次,每头驴每侧睾丸每次注射3 mg质粒,第3针结束后间隔6天进行人工授精。
因驴的妊娠期时间约365 d,妊娠周期较长。因此,为加快试验进程,参照前人的研究[7],选择18周孕驴外周静脉血血浆进行胎儿游离DNA性别鉴定,统计后代性别,得到重组干扰载体干扰后代的雌性率。设计牙釉蛋白引物,以对照组(阳性对照:种公驴DNA;阴性对照:空怀母驴DNA)和试验组(怀孕母驴)的胎儿游离DNA为模板,进行PCR扩增及电泳检测。牙釉蛋白引物见表3。

表3 AMEL引物序列信息
1.4 数据处理与统计分析
本试验采用Excel整理初始数据,qRT-RCR数据采用2-△△CT进行计算,采用SPSS 26.0软件对数据进行单因素方差分析(AVONA),统计结果以平均数±标准误(Mean±SD)表示,“*”表示(P<0.05)差异显著,“**”表示(P<0.01)差异极显著。
2 结果与分析
2.1 shRNA串联干扰载体的构建
菌液PCR电泳结果如图2所示,得到重组载体CV250-1质粒经菌液PCR扩增出1 101 bp阳性克隆转化子,CV250-2质粒扩增出1 110 bp阳性克隆转化子,测序结果与菌液PCR结果一致,表明干扰载体构建成功。
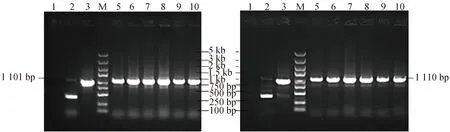
1:ddH2O;2:空载自连组;3:GAPDH;M:Marker;5-10:1-6号阳性克隆菌。图2 菌液PCR电泳结果图
2.2 干扰载体在生精细胞中的功能验证
体外共培养生精细胞和支持细胞,在显微镜下观察到贴壁生长的支持细胞和附着于支持细胞上的生精细胞,生精细胞多呈圆形,中间可明显观察到黑色细胞核。用2个重组干扰载体和1个空白组转染生精细胞24 h后,观察到转染干扰载体组有绿色荧光,表明干扰载体成功转染进入细胞,在转染组荧光表达量达到最高58 h时,使用荧光显微镜激发绿色荧光,结果如图3所示。

A:刚分离出来的生精细胞;B:转染58 h生精细胞(20倍);C:转染58 h生精细胞(40倍);D:转染58 h生精细胞荧光观察。图3 驴生精细胞转染串联干扰载体荧光图
以未转染细胞为对照组、转染干扰载体的细胞为试验组,将提取的mRNA反转录成cDNA,qRT-PCR检测结果如图4所示,与对照组细胞mRNA的相对表达量103.04±11.68%相比,CV250-1干扰组的相对表达量下调了76.37±6.36%,差异极显著(P<0.01);CV250-2干扰组的相对表达量下调了67.73±4.94%,差异显著(P<0.05)。CV250-1和CV250-2经细胞水平筛选,皆可有效干扰细胞内Zfy基因表达,可用于驴体内试验。由于CV250-1具有更好的干扰效果,后续选择CV250-1用于动物体内试验。
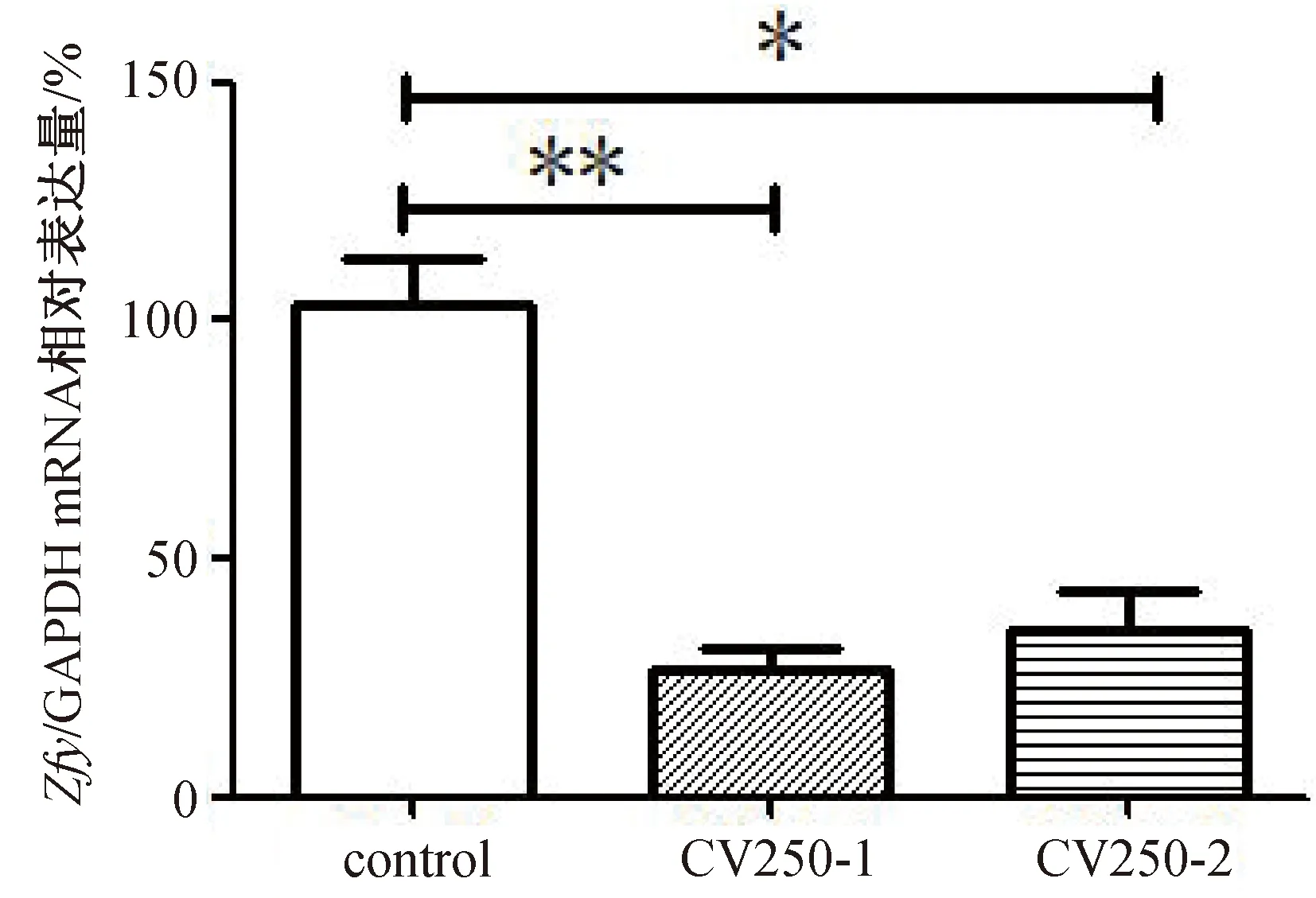
肩注*表示差异显著(P<0.05),同行肩注**表达差异极显著(P<0.01);下同。图4 驴对照组、试验组生精细胞Zfy基因mRNA相对表达量
2.3 串联干扰载体的体内检测效果评估
性控精液(睾丸注射Zfy基因串联干扰载体)、非性控精液(空白处理组)人工授精后B超检查受胎结果如表4所示,性控组的受胎率为61.72%,非性控组的受胎率为67.4%。

表4 性控精液与非性控精液受胎率统计表
使用阳性对照(种公驴)、阴性对照(空怀母驴)血液DNA、性控组怀孕母驴血浆提取的胎儿游离DNA为模板,PCR扩增AMEL基因,结果如图5所示。1号泳道公驴阳性对照扩增出2条带,2号泳道为空怀母驴阴性对照扩增出1条带,符合预期,3号泳道为无酶水空白对照扩增结果无条带。从性控组结果可明显看出泳道5、8与公畜阳性对照相同,确定子代为雄性;泳道4、6、7、9、10、11与母畜阴性对照相同,确定子代为雌性。
统计胎儿性别鉴定结果,并分析后代性别比例,结果如表5所示:CV250-1干扰载体性控组子代雌性率为71.05%(P<0.05)。

表5 性控与非性控子一代性别数据统计
3 讨论
锌指蛋白转录因子Zfy基因曾作为睾丸决定因子的候选基因而备受关注[8]。在随后的研究中发现有两个Y染色体的基因足以使生殖细胞在辅助受精中起作用并产生活的后代[9],即睾丸决定因子SRY和精原增殖因子Eif2s3y。随着SRY基因的功能被不断挖掘,Zfy基因被逐渐的遗忘了,花了20多年时间才重新出现,扮演新的生精角色。Yamauchi[10]的研究表明,小鼠的Y染色体上Zfy2促进精子形态发生,提高圆形精子细胞注射(ROSI) 的成功,并且是形成精子的必要条件,能够在卵母细胞胞质内注射后产生活的后代。Zfy2基因的存在使圆形精子细胞能够启动和经历头部形态发生和完整的尾部发育。通过研究发现添加Zfy2基因到雄性 Y 染色体缺陷的个体中,发现圆形精子细胞阶段减数分裂后停滞,证明了Zfy2在辅助受精中负责精子功能的形成[4]。在本研究中,当干扰Zfy基因后,发现子一代的性别相比于对照组发生明显偏移,影响了圆形精子细胞的正常发育,使Y精子的受精几率降低,X精子不受影响,与理论相符。但在后续的研究中还需验证注射干扰载体后,对下游基因表达产生的影响。在驴中,Y 染色体上只有一个单一的Zfy基因,没有Zfy突变的描述,因此,关于Zfy基因在精子发生中的生物学功能可能引发研究员们对性控研究的重新评估。
汪存利[11]的研究表明,体外培养生精细胞会随着支持细胞功能的衰落而退化,要想稳定的培养生精细胞还需探寻与支持细胞功能相近的存活时间长的饲养层细胞。本试验培养驴的生精细胞,在这些研究的基础上进行改进,在支持细胞贴壁后即进行转染试验,以防止生精细胞退化影响试验结果。但无法进行生精细胞的生长传代,在后续的研究中还需要探索生精细胞的生长及传代的方法。
睾丸注射是将外源基因整合到雄性生殖系细胞中,从而获得转基因精子的方法[12-13]。Amaral等[14]在研究中发现,使用睾丸注射法生产转基因小鼠,会导致小鼠生殖器官损坏,生精细胞的数量降低,曲细精管的功能损坏。李福兵[15]的研究认为睾丸间质注射是注射过程中影响了曲细精管完整性,侵染质粒通过缺口进入生精细胞,或者是通过睾丸组织体内的体液循环和渗透作用进入生精细胞完成侵染。Bichun等[16]将pEGFP-N1质粒注入鸡睾丸,从30个受精卵中随机筛选出23只雏鸡,成功地得到13只转基因鸡(检出率56.5%)。He等人[17]成功获得了转基因羊应用睾丸注射转基因技术(阳性率2.0%)。在本研究中发现,睾丸间质注射法对睾丸组织产生了一定影响,引起睾丸肿胀,严重会引起睾丸组织出血等状况,需要精密的技术支持。在本研究中,注射干扰载体对驴睾丸组织产生可恢复性损伤,在注射干扰载体8个月后,对种公驴进行精液品质检测,结果发现,精液活力降低、睾丸肿胀及精液中带血等问题皆已恢复,精子活力及身体状况恢复正常水平。
4 结论
研究结果表明,成功构建出驴Zfy基因重组载体CV250-1、CV250-2,CV250-1能更好的抑制种公驴睾丸组织Zfy基因的表达,细胞水平干扰效率为76.37%,体内试验子一代雌性率为71.05%,可显著影响子代雌性率。

