软枣猕猴桃茎黄酮的分离纯化及其片剂制备
王斯彤,张雨欣,高英旭,刘怡菲,赫 亮,黄 夏,陈 罡
(1.辽宁省林业科学研究院,沈阳 110032;2.辽宁大学轻型产业学院,沈阳 110036)
软枣猕猴桃(Actinidia arguta)为猕猴桃科,猕猴桃属多年生落叶攀缘藤本植物[1]。其果实中富含大量的维生素及活性成分,且根茎也是良好的药材,具有较好的药用价值[2]。黄酮是黄酮类化合物的总称,是软枣猕猴桃的主要生物活性成分之一,广泛存在于自然界中,不仅对植物的生长发育中起着重要的作用,还具有多种药用价值[3-5],如抗氧化[6]、抗炎[7]、抗癌[8]和免疫调剂[9]等。许多研究发现,水果蔬菜中的黄酮类化合物能够抑制炎症蛋白的表达和炎症细胞因子的分泌,是天然的炎症抑制剂[10]。除果实内含有大量的黄酮,张雨欣等[11]在软枣猕猴桃茎中提取到了黄酮,并发现茎中黄酮含量与果实相差不大。因此,可以充分利用果树的枝条进行黄酮的提取,增加原材料的来源,达到植物资源综合利用的目的。
但提取后的茎黄酮中存在大量的可溶性糖和蛋白质等杂质,大孔吸附树脂在中草药化学成分的纯化中有独特的优势和作用[12]。大孔吸附树脂具有多孔网状结构,利用被分离物质与大孔吸附树脂的亲和力不同,再用合适的洗脱剂吸附在树脂上的目标组分洗脱下来[13],并且大孔吸附树脂成本低易再生,被广泛应用于类黄酮等活性成分的富集[14-15]。片剂是目前临床应用比较广泛的剂型之一,选择适宜的辅料和辅料配比决定是否能够压出合格的片剂[16]。因此,本研究探讨大孔吸附树脂对软枣猕猴桃茎黄酮粗提液进行分离纯化的最佳条件,并比较不同辅料及黄酮的添加量对片剂的影响,通过正交试验优化片剂制作工艺,以期为软枣猕猴桃茎黄酮资源的开发与利用提供理论参考。
1 材料与方法
1.1 材料
软枣猕猴桃茎黄酮纯化的试验材料来自张雨欣等[6]通过响应面法从软枣猕猴桃茎中提取的黄酮粗提液。经过纯化的黄酮用于片剂的制备。
1.2 方法
1.2.1 试剂制备 将黄酮粗提液旋蒸至较小体积,加入3倍无水乙醇,经过静置、离心取上清液,以去除杂质。上清液旋蒸、冷冻干燥后备用。
1.2.2 AB-8大孔吸附树脂的预处理 新树脂使用前须进行反复清洗,先从柱底进水,顶部排出,清洗1 h后关闭进水阀,反洗结束。静置30 min后,待树脂落下后可进行正洗,从柱顶进水(流速同反洗时流速),从柱底排出,时间为1 h,清洗干净后树脂处于待用状态。水洗后再经酸-碱-醇处理,处理步骤参照王晋[17]的报道进行处理。
1.2.3 AB-8大孔吸附树脂的静态吸附与解析试验 取AB-8大孔吸附树脂3.0 g于三角瓶中,再加入50 mL黄铜粗提液,将三角瓶置于摇床中震荡4~10 h,每30 min取1 mL黄酮液测定浓度,绘制静态吸附曲线,公式参考1.5。将上述吸附饱和后的大孔吸附树脂与黄酮粗提液通过抽滤分离,将大孔吸附树脂加入三角瓶中,再加入50 mL80%乙醇溶液,将三角瓶置于摇床中震荡4~10 h,每过30 min取1 mL黄酮液并测定其浓度,绘制静态解析曲线[18],公式参考1.5。
静态吸附和解析方法参照金科旭等[18]的方法进行试验。
1.2.4 AB-8大孔吸附树脂的动态吸附与解析条件的确定 动态泄漏曲线:将AB-8大孔吸附树脂置玻璃层析柱中,取0.63 mg·mL-1的样品溶液以3 mL·min-1的流速进行上样,收集流出物,并测量其总黄酮浓度。当浓度达到样品的1/10时,达到泄漏点,根据流出物化合物浓度绘制动态泄漏曲线。
动态洗脱曲线:方法同动态泄漏曲线,上样完毕后用水洗脱,再用80%乙醇洗脱树脂上的黄酮。每10 mL流出液测定黄酮含量及解析率。制作解析率随洗脱体积变化的图像,得到最佳洗脱量。
水洗剂用量的确定:先进行上样,上样完毕用水洗脱,绘制黄酮损失量随水洗体积变化的图像,当黄酮损失量为0时的水洗量为最佳水洗剂用量。
使用同样的方法,在其他条件相同的情况下,对比不同上样浓度(0.43,0.53,0.63,0.72,0.82 mg·mL-1)、上样流速(1,2,3,4,5 mL·min-1)、上样液pH 值(2,3,4,5,6,7,8)、洗脱液流速(2,3,4,5,6 mL·min-1)、洗脱液浓度(乙醇浓度分别为40%、50%、60%、70%、80%、90%)等对黄酮吸附和解析率的影响,并绘制变化曲线。
1.3 高效液相色谱鉴定
色谱条件和标准品溶液的制备参照何艳等[19]的方法,分别取一定量的粗黄酮样品和纯化后的黄酮样品用甲醇溶解,再用0.45 μm微孔滤膜过滤即得样品溶液。
1.4 软枣猕猴桃茎黄酮片剂的制备
1.4.1 片剂的制备方法 使用粉末直接压片法制作片剂。
1.4.2 片剂各指标的测定方法 分别对片剂的外观、片重、硬度、崩解时限进行测定,测定标准参照《中国药典》(2020年版)[20]四部制剂通则项下规定。
1.4.3 片剂辅料的选择 本研究添加的辅料为填充剂(淀粉、微晶纤维素)、崩解剂(羧甲基纤维素钠、羧甲基淀粉钠12%)、润滑剂(硬脂酸镁、滑石粉),在其他条件相同的情况下进行两两比较,筛选合适的辅料。
1.4.4 片剂各成分添加量的确定 在其他条件相同的情况下,分别选择不同比例的黄酮(28%、33%、38%、43%、48%)、淀粉(28%、33%、38%、43%、48%)、羧甲基纤维素钠(8%、10%、12%、14%、16%)、硬脂酸镁(0.3%、0.5%、0.7%、0.9%、1.1%)、甘露醇(6%、11%、16%、21%、26%)加入片剂中,按照综合评价标准的项目与评分进行打分。
1.4.5 片剂的评分标准 根据片剂的外观、片重差异、硬度、崩解时限表现进行评分,其中,外观总分为4分、片重差异总分为4分、硬度总分为6分、崩解时限总分为6分,最终总分为20分。分数越高代表片剂的质量越好。
1.5 计算公式
式中:C0为黄酮粗提液浓度(mg·mL-1);C1为树脂吸附后三角瓶中黄酮的浓度(mg·mL-1)。
式中:C0为黄酮粗提液浓度(mg·mL-1);C1为树脂吸附后三角瓶中黄酮的浓度(mg·mL-1);C2为树脂吸附后三角瓶中黄酮的浓度(mg·mL-1)。
2 结果与分析
2.1 AB-8大孔树脂对软枣猕猴桃茎黄酮的静态吸附与解析曲线
通过在AB-8 大孔树脂对软枣猕猴桃茎黄酮的静态吸附与解析的实验研究中发现,随着吸附和解析时间的延长,吸附率和解析率都逐渐增大,达到饱和点后又趋于恒定。静态吸附曲线在0~2 h时由于内外物质浓度差较大,树脂表面的吸附位点较多,黄酮类化合物迅速被树脂吸附,吸附曲线较陡(图1)。2 h后随着树脂接近吸附饱和状态,表面可吸附位点减少,吸附速率增长缓慢,当吸附时间达到4 h 后,吸附率接近恒定,达到61.35%。静态解析曲线随着时间的延长解析速率逐渐增大(图2),3.5 h 后趋于恒定,最大解析液浓度为70.64%。通过分析发现,AB-8大孔吸附树脂对软枣猕猴桃茎黄酮的吸附与解析能力均较好,适合用于软枣猕猴桃茎黄酮类物质的纯化。
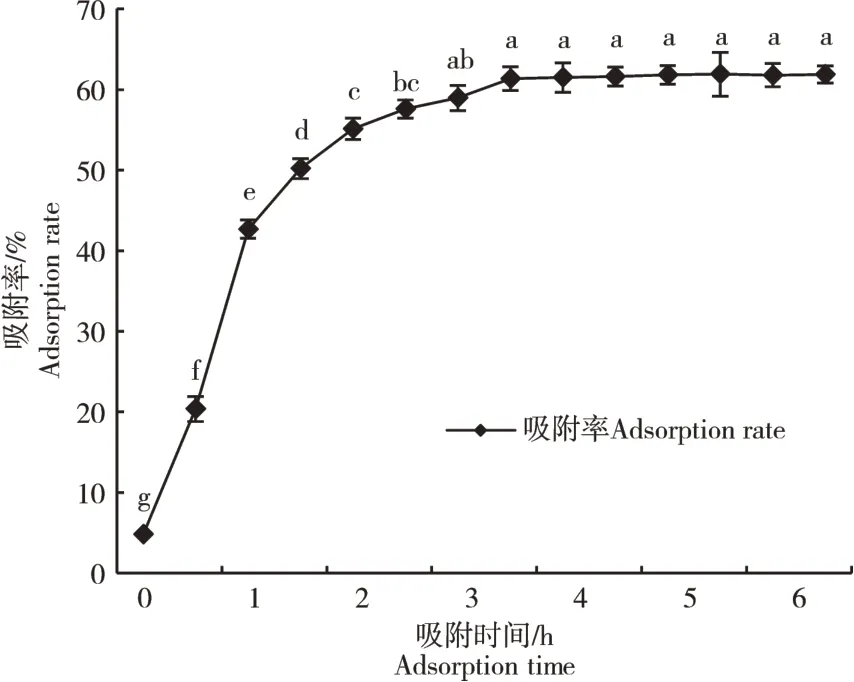
图1 AB-8大孔吸附树脂的静态吸附曲线Figure 1 Static adsorption curve of AB-8 macroporous adsorption resin
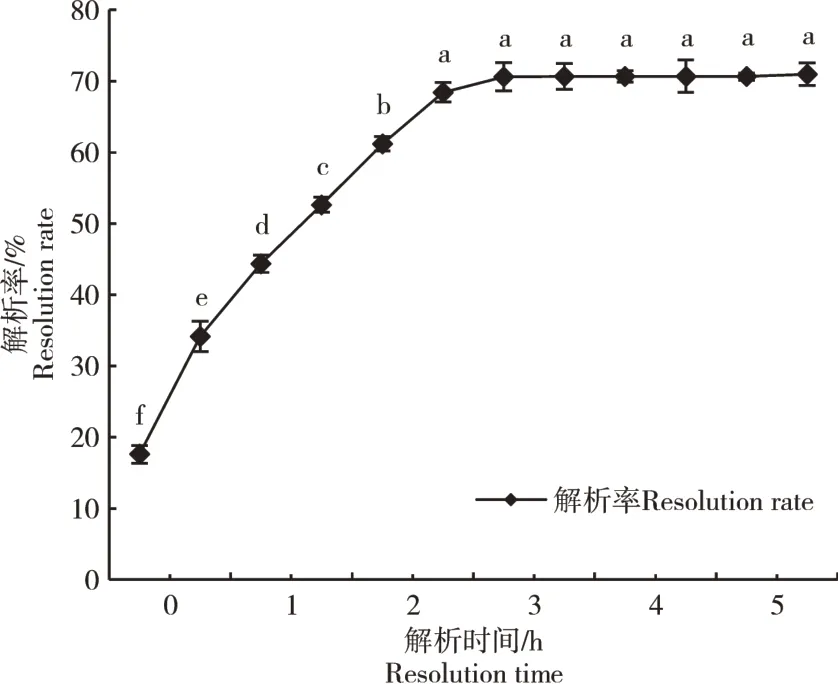
图2 AB-8大孔吸附树脂的静态解析Figure 2 Static analytical curve of AB-8 macroporous adsorption resin
2.2 AB-8大孔吸附树脂对软枣猕猴桃茎黄酮的动态吸附与解析试验
2.2.1 动态泄漏曲线的绘制 由图3可知,样品体积从0~20 mL的过程中,流出液中黄酮类化合物的浓度趋近于0,说明样品溶液中的黄酮类化合物可以被树脂完全吸附。当样品体积为25 mL时,流出黄酮浓度达到0.063 mg·mL-1,是样品浓度的1/10,达到AB-8大孔吸附树脂的泄漏点。因此,选择25 mL作为最终样品体积。
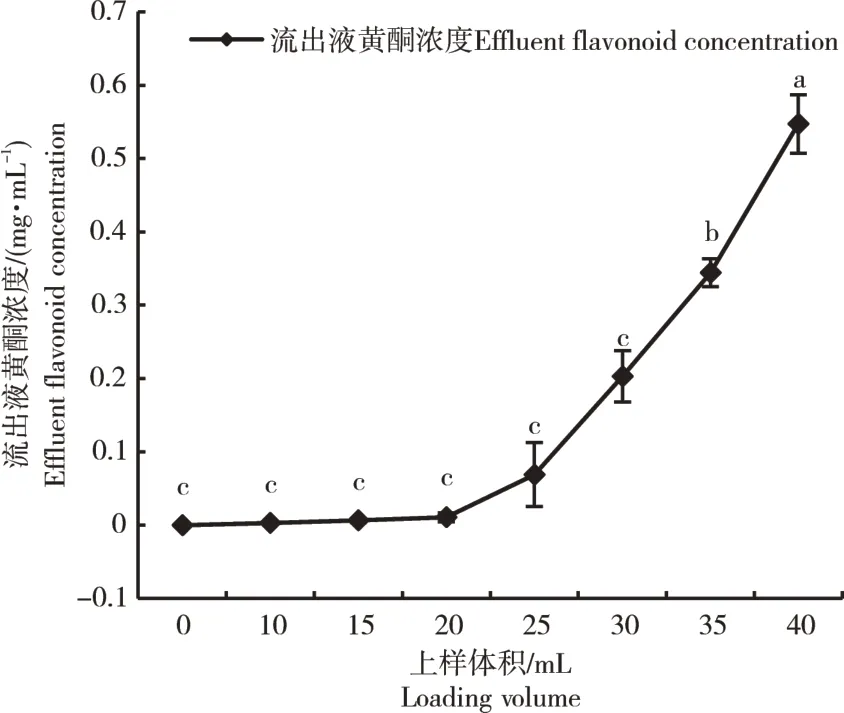
图3 AB-8大孔吸附树脂的动态泄漏曲线Figure 3 Dynamic leakage curve of AB-8 macroporous adsorption resin
2.2.2 上样浓度的确定 随着样品浓度的逐渐增加,AB-8大孔吸附树脂吸附率呈现先升高后降低的趋势(图4)。样品溶液的浓度为0.43~0.63 mg·mL-1时,黄酮类化合物与树脂的接触面积不断增加,吸附速率逐渐增长,当样品浓度达到0.63 mg·mL-1时,树脂的吸附率最大,为75.43%。因此,0.63 mg·mL-1为样品溶液最佳浓度。
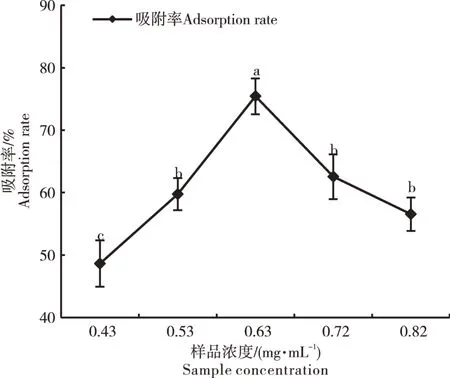
图4 样品浓度对AB-8大孔吸附树脂吸附率的影响Figure 4 Effect of sample concentration on adsorptionrate of AB-8 macroporous adsorption resin
2.2.3 上样液流速的确定 不同样液流速会影响树脂对黄酮类化合物的吸附率。由图5可知,随着样液流速的增加,吸附率呈先增长后降低的趋势,在样液流速为3 mg·mL-1时,树脂吸附率最高,说明此时的样液能够与树脂充分接触和吸附。样液流速过快会造成样液中的黄酮类化合物未被吸附完全就流出,也有可能是流速过快造成树脂吸附性能降低。因此最佳上样液流速为3 mg·mL-1。
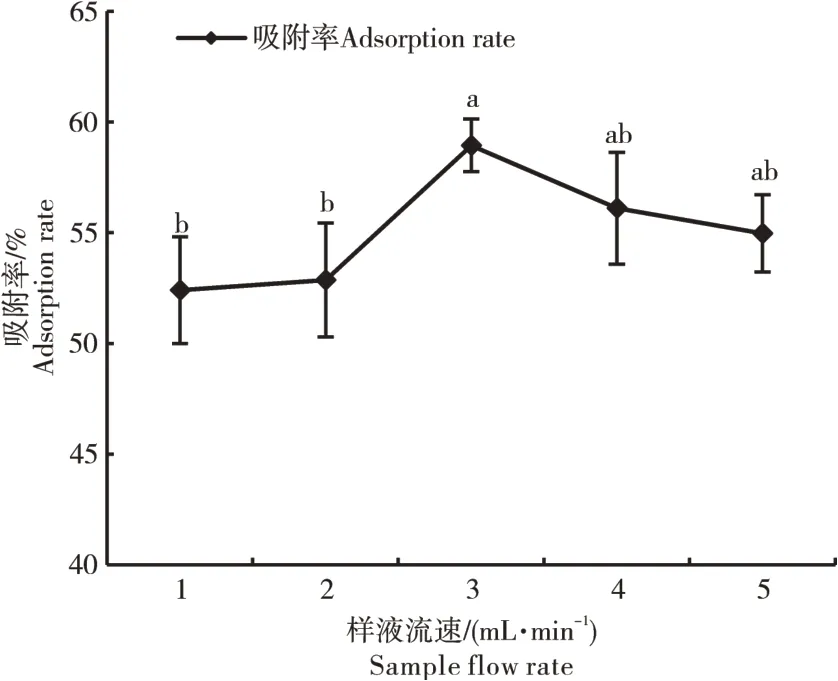
图5 样液流速对AB-8大孔吸附树脂吸附率的影响Figure 5 Influence of sample liquid flow rate on adsorption rate of AB-8 porous adsorption resin
2.2.4 上样液pH值的确定 上样液pH值是影响树脂吸附率的关键因素。由图6可知,随着上样液pH值从2逐渐增高至8,吸附率呈现先升高后降低的趋势,在pH值增至5时,树脂的吸附率达到75.43%,为最高吸附率,因此,上样液pH值设置为5最佳。
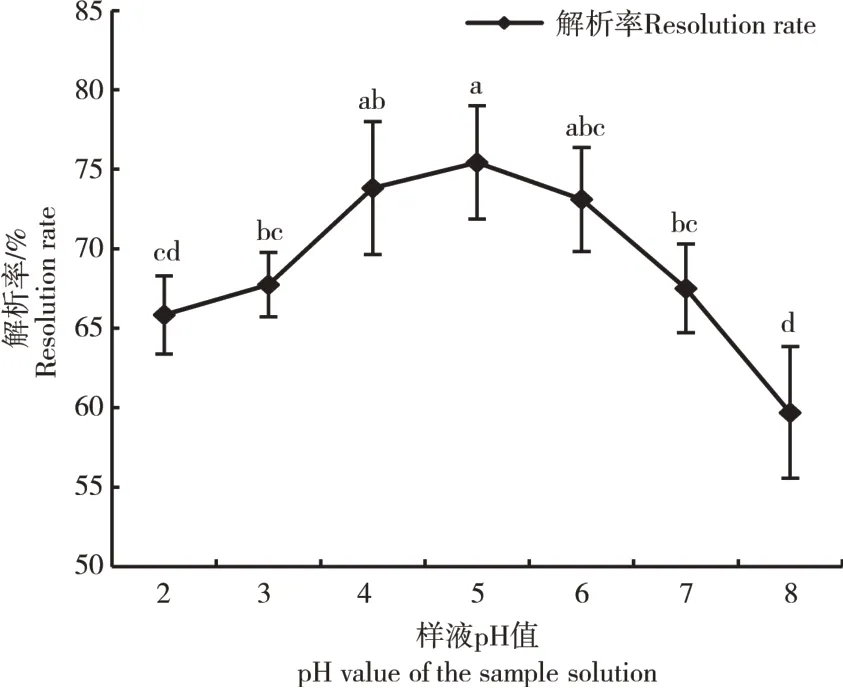
图6 样液pH值对AB-8大孔吸附树脂吸附率的影响Figure 6 Effect of pH value of sample solution on adsorption macroporous adsorption resin rate of AB-8 macro
2.2.5 动态洗脱曲线的绘制 由图7可知,黄酮的解析过程是随着洗脱剂体积的增加,解析率先升高后趋于恒定。洗脱剂体积在0~20 mL时,黄酮解析率快速增加,在洗脱剂达到30 mL或更多时,解析率趋于恒定,因此,最佳洗脱剂体积为30 mL,解析率为65.60%。
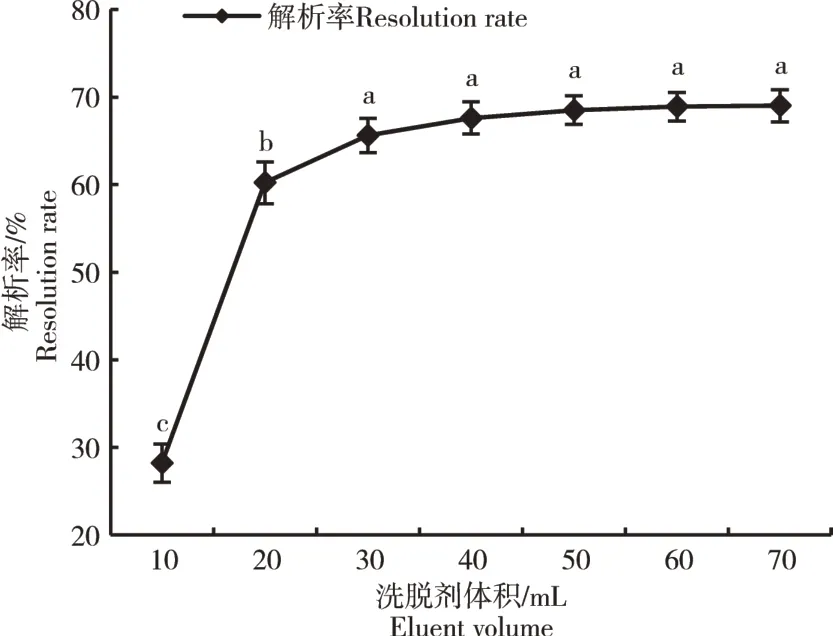
图7 动态洗脱曲线Figure 7 Dynamic elution profile
2.2.6 水洗剂用量的确定 为去除树脂间存在的少量水溶性杂质和未能吸附上的黄酮,需要通过水洗将杂质洗脱下来。在本研究中,随着水洗剂体积的增加,黄酮损失量逐渐降低,当水洗剂体积达到40 mL时,黄酮损失量趋近于0(图8),因此,最佳水洗剂体积为40 mL。

图8 水洗体积的确定Figure 8 Determination of washing volume
2.2.7 洗脱剂流速的确定 洗脱剂流速是影响黄酮解析率的关键因素。由图9可知,随着洗脱剂流速的加快,解析率先升高后降低,在洗脱剂流速为3 mL·min-1时解析率最大,为60.82%。因此,最佳洗脱剂流速为3 mL·min-1。
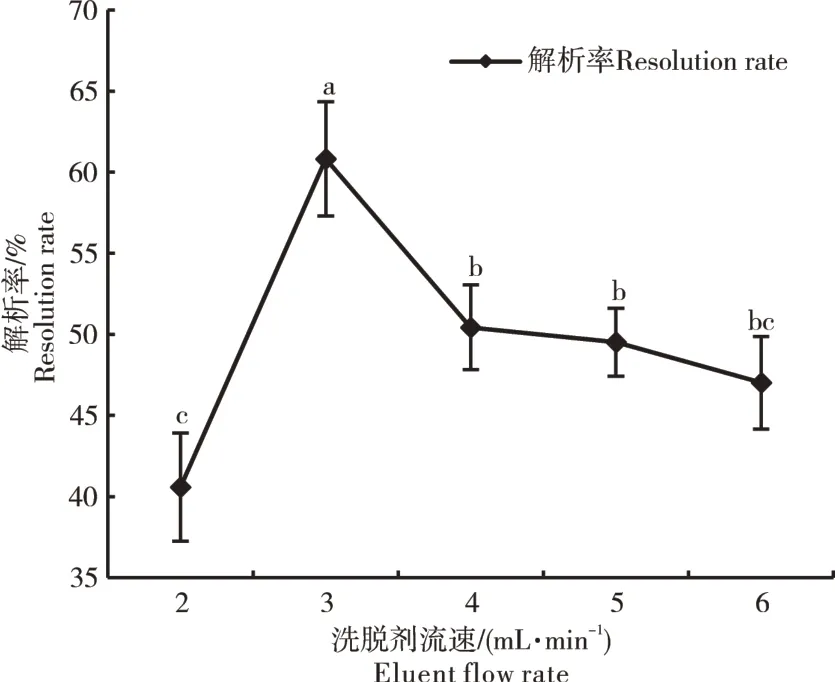
图9 洗脱剂流速对AB-8大孔吸附树脂解析率的影响Figure 9 Influence of flow rate of eluent on the resolution rate of AB-8 rous adsorption resin
2.2.8 洗脱剂浓度的确定 洗脱剂的浓度高低,会影响大孔吸附树脂的解析效率。由图10可知,随着洗脱剂浓度的逐渐加大,解析率逐渐升高,在浓度达到80%时,解析率最高为60.82%,之后随着洗脱剂浓度的增大,树脂解析率迅速下降。因此,洗脱剂最佳浓度为80%。
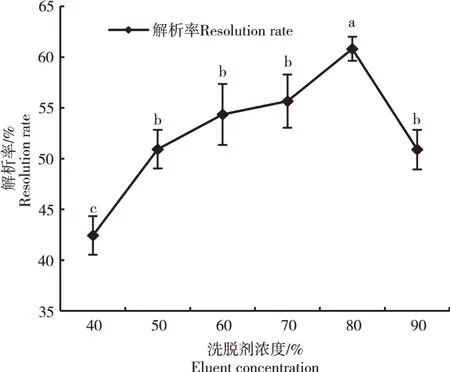
图10 洗脱剂浓度对AB-8大孔吸附树脂解析率的影响Figure 10 Effect of eluent concentration on resolution macroporous adsorption resin rate of AB-8 macropo
2.3 软枣猕猴桃茎黄酮纯化物的鉴定
2.3.1 高效液相色谱分析 本研究通过对软枣猕猴桃茎黄酮纯化前后进行高效液相色谱分析,对比发现纯化前(图11b)比纯化后(图11c)的黄酮内杂质减少。本试验对芦丁和槲皮素标准品进行了液相色谱分析,在所设定的试验条件下,芦丁峰值出现时间为16.614 min,槲皮素峰值出现时间为34.347 min(图11a)。这与纯化后的软枣猕猴桃茎黄酮液相色谱中的16.631 min时出现的峰值重合,存在的误差在允许范围内,与芦丁标准品出峰时间基本相同,说明软枣猕猴桃茎黄酮内含有芦丁,在32.531 min处可见有小吸收峰出现,与槲皮素标准品峰值出现的时间较为相近,说明软枣猕猴桃茎黄酮内含少量槲皮素。
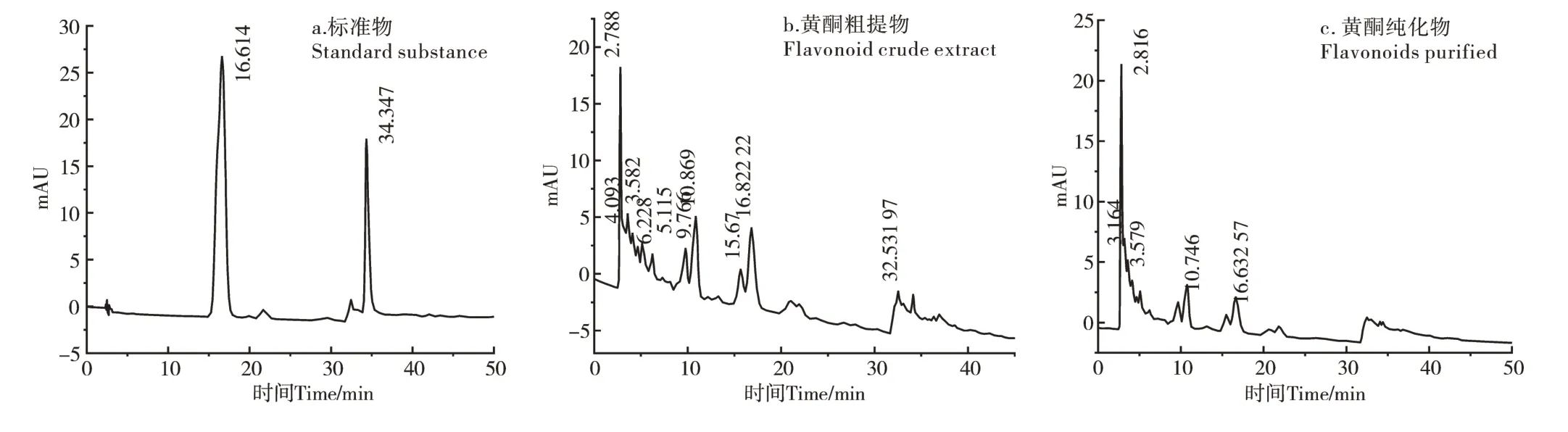
图11 软枣猕猴桃茎黄酮纯化前后以及标准物的高效液相色谱图Figure 11 High performance liquid chromatogram of before and after purification and the standard substance from Actinidia arguta
2.4 软枣猕猴桃茎黄铜片剂的制备
2.4.1 辅料的选择及用量的确定 辅料是维持片剂稳定性的重要组成部分,其种类和用量的选择能够优化片剂口服效果。通过对比不同填充剂对片剂的影响,发现淀粉的综合评分高于微晶纤维素(表1)。在淀粉添加量对片剂影响的研究发现,当淀粉添加量在38%时(图12a),片剂的综合评分最高,且片剂的外观良好、片重差异较小、硬度适中、崩解时间较短。对比崩解剂羧甲基纤维素钠与羧甲基淀粉钠的作用效果,发现两者外观相差不大,但羧甲基淀粉钠硬度在20~30 N之间,片剂硬度不够,不符合片剂硬度的相关规定。当羧甲基纤维素钠添加量在10%时(图12b),片剂的综合评分最高,此时片剂的外观优良、片重差异低、硬度和崩解时限都处于较佳水平。在润滑剂的选择上,硬脂酸镁和滑石粉的外观、硬度表现差异不大,但硬脂酸镁对人体无害且能够有效降低片剂的粗糙性,更适合添加到片剂当中。由图12c可知,当硬脂酸镁的添加量在0.50%时,片剂的外观最佳。甘露醇添加量对片剂的综合评分影响不大,考虑片剂的口感和硬度、崩解时限,选择甘露醇添加量为16%时最好(图12d)。
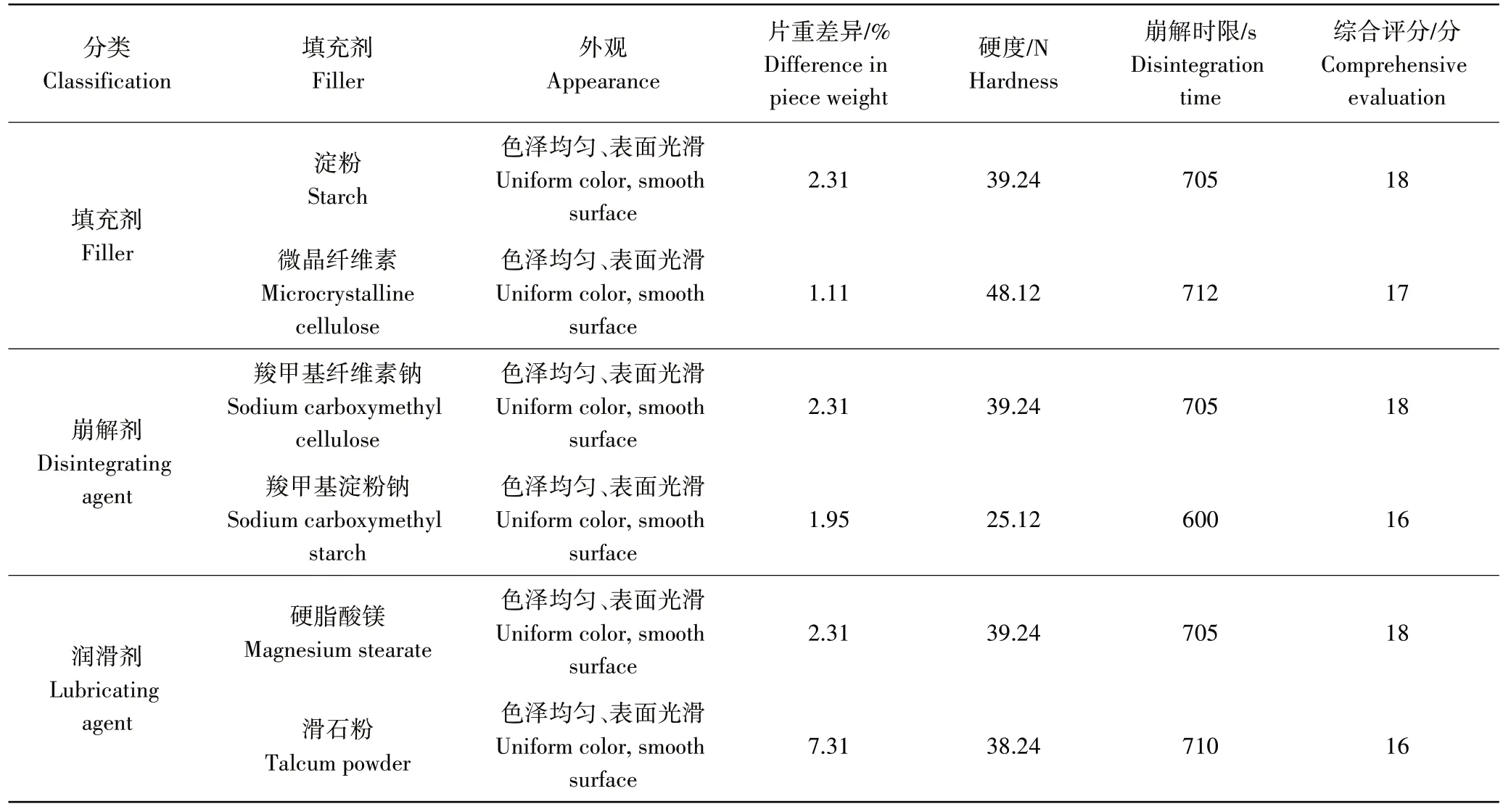
表1 软枣猕猴桃茎黄酮片剂制备辅料的选择Table 1 Selection of excipients for preparation of Actinidia arguta stem flavone tablets
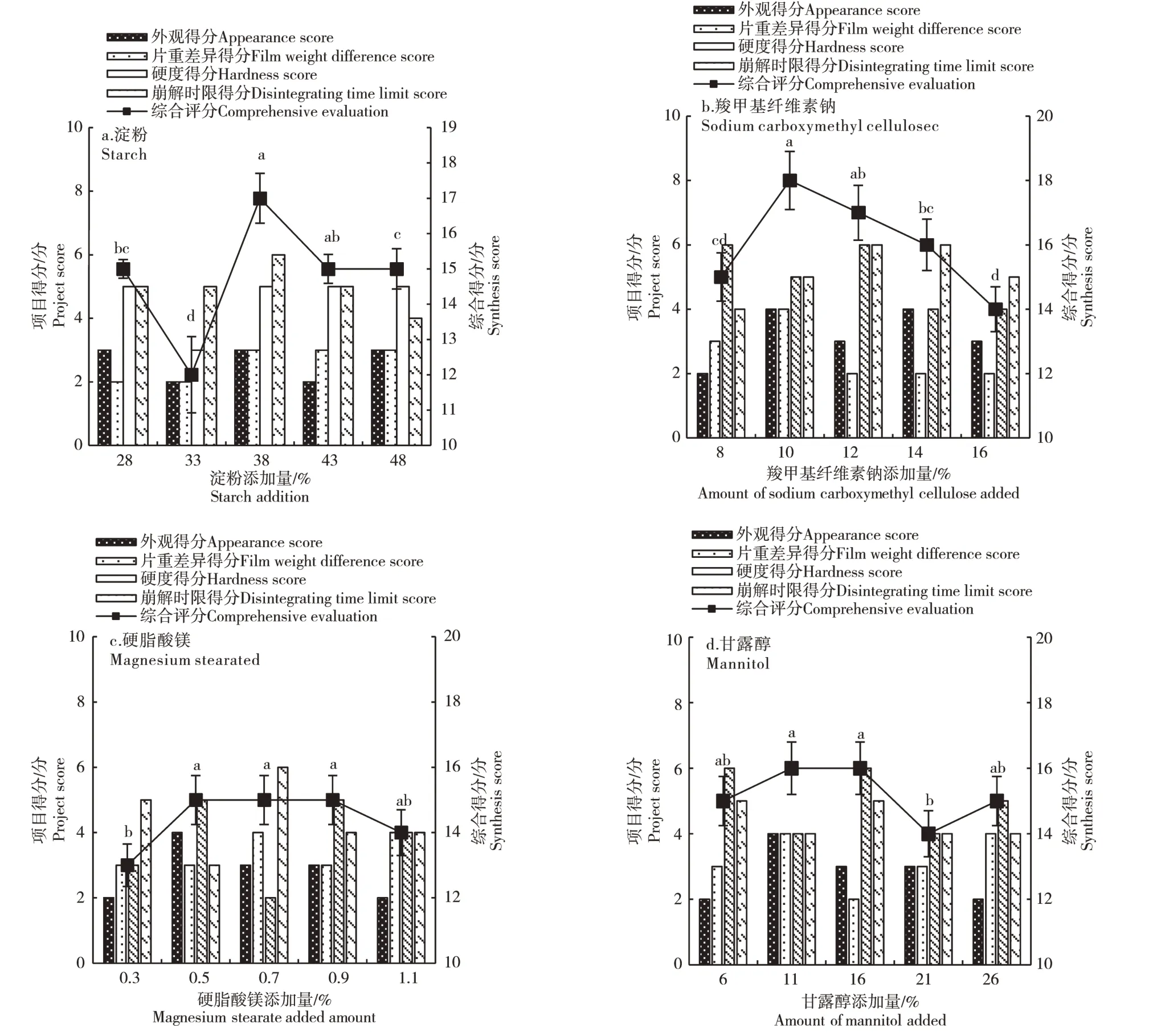
图12 辅料添加对片剂综合评分的影响Figure 12 Effect of excipients on the overall score of tablets
2.4.2 软枣猕猴桃茎黄酮添加量的确定 为确定不同黄酮添加量对片剂的影响(图13),对比发现软枣猕猴桃黄酮含量在33%时,片剂的硬度和崩解时限最佳,且综合评分最高,适合用于片剂的制备。
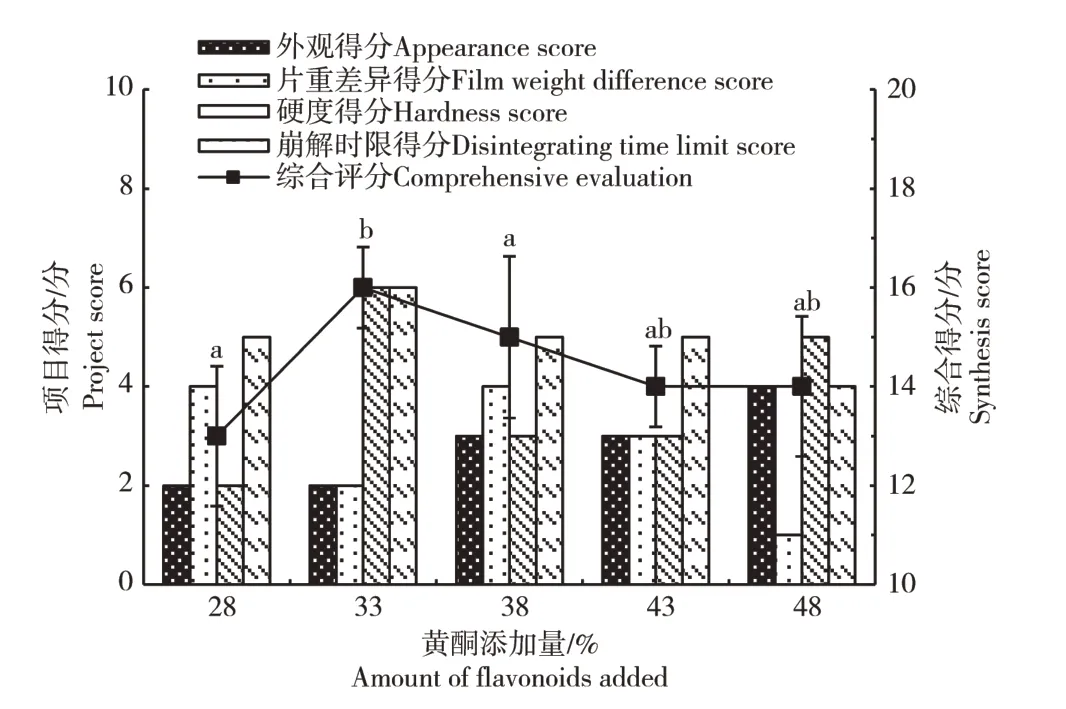
图13 黄酮添加量对片剂综合评分的影响Figure 13 Effect of the amount of raw material added on the comprehensive score of the tablet
2.4.3 正交试验设计结果 为确定软枣猕猴桃茎黄酮片剂的最佳处方,利用正交试验法,对其中3个因素进行L9(33)三因素三水平的正交试验。通过综合评分确定其各原料的添加量。由表2可知,3个影响因素对片剂的影响程度依次为C>B>A(即羧甲基纤维素钠的添加量>淀粉的添加量>软枣猕猴桃茎黄酮),且片剂的最佳处方A2B1C1,即软枣猕猴桃茎黄酮添加量为38%,淀粉添加量为38%,羧甲基纤维素钠的添加量为8%。
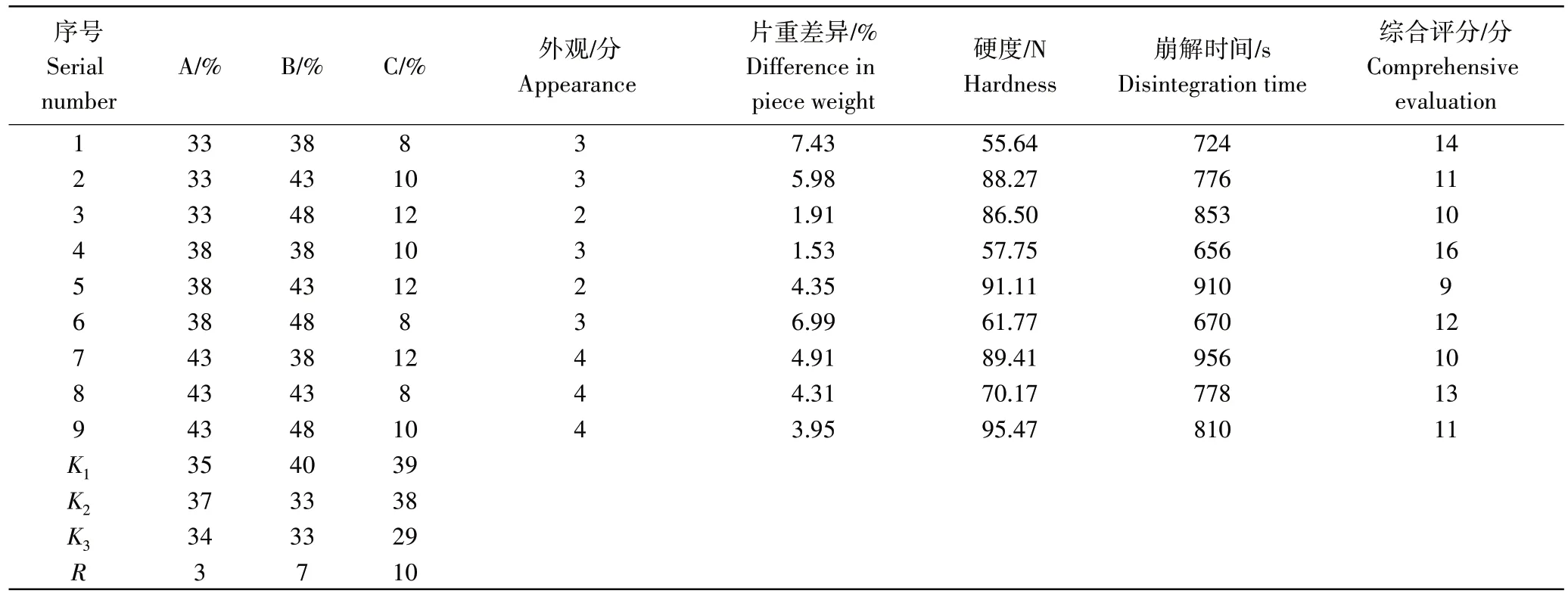
表2 正交试验结果Table 2 Orthogonal experimental results
2.2.4 软枣猕猴桃茎黄酮片剂的质量测定 本研究分别从外观、重量、硬度、蹦极时限等方面对片剂的质量进行了测定。由图14可知,片剂呈圆形浅棕色,表面完整光滑、色泽均匀,并无可见杂质。在对重量检测中发现(表3),平均片重为0.243 0 g,片重差异为1.19%,不合格片数为0。在随机抽取的10个片剂中发现(表4),平均硬度为45.01 N,硬度均在40~50 N之间,硬度适中,不合格片数为0。在对片剂进行崩解时限检测中发现(表5),崩解时限均在720 s(12 min)内,平均崩解时限为659 s,不合格片数为0。以上检测结果均符合《中国药典》(2020年版)的相关规定。

表3 重量差异检查结果Table 3 Weight difference check results

表4 硬度检查结果Table 4 Hardness check result

表5 崩解时限检查结果Table 5 Disintegration time limit inspection results

图14 软枣猕猴桃茎黄酮片剂Figure 14 Actinidia arguta stems flavonoids tablets
3 讨论与结论
黄酮类化合物的来源主要是从天然植物中提取,再进行纯化[21]。黄酮类化合物纯化方法很多,其中大孔树脂吸附法是目前常用的方法。大孔树脂吸附法是提取分离中药成分的一种有效方法[22],该方法具有较高的物理化学稳定性,吸附和解析性好,再生简单并且能够降低纯化成本[23]。树脂吸附法的关键是确定被分离纯化物质的体积大小,进而选择合适的大孔树脂孔径,根据分子中的酚羟基、羧基等来确定树脂型号以及分离条件[24],不同的化合物因其理化性质不同其纯化条件也各有差异[25]。万鹏聪等[26]通过大孔吸附树脂纯化沙棘异功方中总黄酮纯度提高了9.49 倍,且抗氧化能力有明显提高。周桃英等[27]在对比6 种大孔吸附树脂对荷叶总黄酮的吸附研究中发现AB-8 大孔树脂吸附速度快、解析率高,是理想的树脂类型。洗脱剂的使用可根据树脂的极性和化合物类型进行选择,对于非极性树脂,选择极性小的洗脱剂洗脱能力强,对于极性大的树脂和化合物,使用极性强的溶剂更好分离[28]。
高效液相色谱法(high performance liquid chromatography,HPLC)相比于经典液相色谱法具有分析时间短、效率高、稳定性强等特点[29]。在对毛竹叶中总黄酮的含量测定研究中发现相比于分光光度法,HPLC 法相对干扰少,测定的结果精确可靠[30]。在对山楂黄酮含量测定的研究中发现,建立外标法定量测定的结果重复性高,稳定性好[31]。片剂的制备首先要考虑其处方筛选和制备工艺是否能够压出合格的片剂,其次是服用方便、疗效确切、毒副作用小,尽最大可能发挥黄酮对人体的药理作用[32]。
影响大孔吸附树脂对软枣猕猴桃茎中黄酮的纯化效果因素较多,包括树脂的选择、上样液的浓度、pH 值、流速以及洗脱剂的选择和流速,经过筛选获得纯化的最佳条件,纯化后的黄酮纯度可达71.25%。利用高效液相色谱法对比纯化前后吸收峰出现的时间,说明软枣猕猴桃茎黄酮内含有芦丁。纯化后的黄酮再添加一定的辅料制成片剂,利用单因素和正交试验优化片剂的最佳处方,制作出来的片剂各项指标均符合相关规定,可为黄酮片剂的推广和应用提供参考,将有助于进一步开发黄酮类化合物在抗癌、心血管保护等作为治疗药物和食品保健方面的应用前景,带来更大的社会效益和经济效益。

