影响老年维持性血液透析患者继发冠状动脉钙化的相关因素分析
康 显
(漳浦县医院,福建 漳州 363200)
冠状动脉钙化是维持性血液透析(MHD)患者的常见并发症,是慢性肾脏病矿物质及骨异常的临床表现,患者病理表现以冠状动脉的中膜钙化为主[1,2]。慢性肾脏病患者一旦发生血管钙化,几乎无可能逆转,由于MHD 会持续性影响患者血流动力学,患者冠状动脉钙化进程会在时间及其他因素下持续进展。有临床研究证实,冠状动脉钙化可用于预测心血管事件,而心血管疾病又属于慢性肾脏病患者的主要死亡原因,易导致不良预后结局[3]。近年来,随着影像学技术的发展,计算机断层扫描(CT)被用于检查冠状动脉钙化,且属于无创性检查,临床已将其作为检测心血管钙化的金标准。因此,本研究旨在探究影响老年MHD 患者继发冠状动脉钙化的相关因素,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2020年5月至2022年3月本院收治的91 例老年MHD 患者的临床资料,根据患者计算机断层扫描(CT)的定量血管钙化评分(CACS)分为钙化组(n=59)、非钙化组(n=32)。纳入标准:(1)于本院持续进行血液透析时间>1年者;(2)年龄>60岁者;(3)均行CT 检查,并进行冠状动脉钙化评估;(4)临床资料完整者。本研究为回顾性分析,已豁免知情同意及伦理审批。排除标准:(1)临床资料缺失者;(2)合并感染性疾病者;(3)严重贫血者;(4)合并甲状腺疾病、肝功能异常者;(5)合并恶性肿瘤者;(6)急性肾损伤者;(7)合并其他影响血磷代谢的疾病者;(8)合并低蛋白血症者;(9)合并心律不齐、慢性心功能不全等严重心血管疾病者;(10)存在冠脉支架置入史者。
1.2 方 法
记录患者年龄、性别、合并基础疾病、透析时间、使用药物等资料。进行血液透析前收集患者空腹静脉血5 mL,使用全自动生化分析仪检测血清磷水平,使用放射免疫法检测全段甲状旁腺激素水平。患者使用CT 进行冠脉钙化检查,使用Agatston 评分[4]作为定量血管钙化评分(CACS)对患者是否发生冠脉钙化进行评估。Agatston 评分记录患者斑块面积、最大CT 值,根据最大CT 值范围将其转化为Hu 系数(CT 值转化标准:CT 值133-199=1,200-299=2,300-399=3,≥400=4),以斑块面积与最大CT 值之积作为钙化评分,总钙化评分为个斑点钙化评分之和。以总钙化评分>0 为发生冠脉钙化。
1.3 观察指标
比较两组患者临床资料(年龄、性别、合并基础疾病、透析时间)、血清磷、全段甲状旁腺激素、使用药物等差异,将存在显著差异的因素进行多元Logistic 回归分析。
1.4 统计学方法
本研究采用统计学软件SPSS 19.0 对数据进行分析处理,临床资料(年龄、性别、合并基础疾病、透析时间)、血清磷、全段甲状旁腺激素、使用药物均以n(%)表示,使用卡方检验,将存在显著差异的因素进行多元Logistic 回归分析,P<0.05 为差异有统计学意义。
2 结 果
2.1 老年MHD 患者继发冠状动脉钙化的相关因素比较
全部患者中男性53 例,女性38 例,年龄为60-84 岁,平均年龄为(70.4±4.7)岁。钙化组、非钙化组患者之间的年龄、合并糖尿病、血清磷、全段甲状旁腺激素比较,差异有统计学意义(P<0.05),性别、合并高血压、透析时间、使用药物比较,差异无统计学意义(P>0.05),见表1。

表1 老年MHD 患者继发冠状动脉钙化的相关因素比较[n(%)]
2.2 老年MHD 患者继发冠状动脉钙化的logistic回归分析
影响老年MHD 患者继发冠状动脉钙化的单因素代入多因素Logistic 回归分析方程中发现,年龄≥80 岁(95%CI=1.241-3.373,OR=2.046,P=0.005)、合并糖尿病(95%CI=1.121-2.435,OR=1.652,P=0.012)、血清磷≥1.78 mmol/L(95%CI=1.085-3.302,OR=1.893,P=0.025),全段甲状旁腺激素≥600 pg/mL(95%CI=1.107-3.267,OR=1.902,P=0.020)是影响老年MHD 患者继发冠状动脉钙化的独立危险因素,见表2。
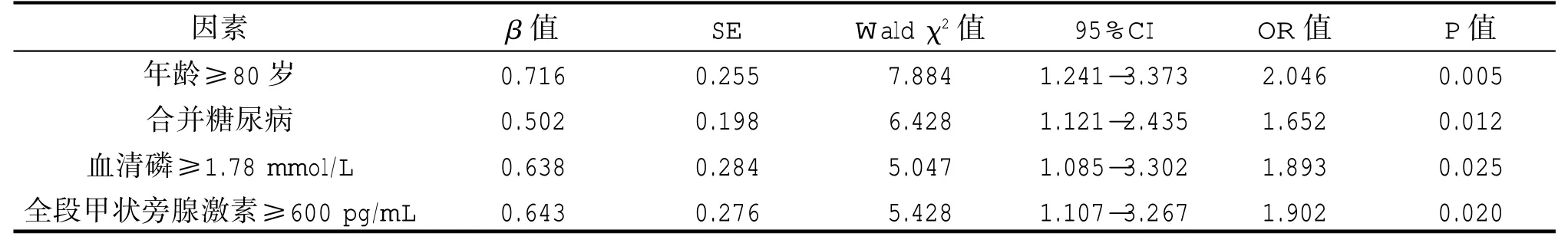
表2 老年MHD 患者继发冠状动脉钙化的Logistic 回归分析
3 讨 论
近年来,随着现代医学技术的发展,MHD 患者的寿命不断延长,但心血管疾病仍是威胁MHD 患者生存的主要因素之一。现代研究证实,血管钙化与心血管事件存在紧密联系,可用于预测心血管病死率[5]。MHD 患者血管钙化的主要表现为血管僵硬度增加,顺应性降低,但对血管内径一般无影响,其发生的病理机制为成骨细胞相关蛋白基因表达上调,使血管平滑肌细胞或血管壁内血源性细胞在钙化因子的作用下转变为成骨细胞[6,7]。国内一项调查结果显示,我国透析患者普遍存在钙化,其中大部分MHD 患者存在心血管钙化[8]。因此,关注MHD 患者血管钙化情况对患者预后十分重要。
本研究依据CACS 将MHD 患者分为钙化组与非钙化组,并对两组患者之间的临床资料、血清磷、全段甲状旁腺激素、使用药物等进行比较,结果显示,两组患者之间的年龄、合并糖尿病、血清磷、全段甲状旁腺激素差异有统计学意义(P<0.05)。此前有研究认为,年龄是导致透析患者血管钙化的因素之一[9],本研究结果与之一致。国内一项研究证实,高血糖可通过氧化应激、晚期糖基化终产物、内皮功能障碍等机制影响血管钙化,而2 型糖尿病患者多因胰岛素抵抗导致骨保护素这一抑制冠脉钙化的因素效果减弱,最终导致血管钙化发生[10],本研究结果佐证了糖尿病可导致血管钙化这一观点。高血磷状态常见于MHD 患者,由于患者肾功能丧失,导致自身血磷代谢受影响,进而使血磷升高。一项研究证实,高血磷状态可导致血管钙化发生[11],本研究结果与之一致。全段甲状旁腺激素可调节钙磷代谢,高血磷低血钙会直接刺激其分泌,并与其他因子共同作用于肾脏-甲状旁腺-骨轴,可反映骨转换状态,持续高全段甲状旁腺激素状态可能通过调节基因转录,进而导致血管钙化。且本研究结果显示,经Logistic 回归分析证实,年龄≥80 岁、合并糖尿病、血清磷≥1.78 mmol/L,全段甲状旁腺激素≥600 pg/mL 是影响老年MHD 患者继发冠状动脉钙化的独立危险因素,则再次证实了前文的观点。
综上所述,老年MHD 患者继发冠状动脉钙化的危险因素包括高龄、合并糖尿病、高血清磷水平、高全段甲状旁腺激素水平,临床应尽量控制相关指标水平。本研究的局限之处在于:仅纳入老年患者进行分析,有待扩大患者纳入范畴,深入探究MHD患者继发冠状动脉钙化的危险因素。

