小麦麦谷蛋白高分子量亚基N端序列克隆及原核表达分析
王志成,王 琦,张长付,张聪聪,王泽濠,张 霞,王金水
河南工业大学 生物工程学院, 河南 郑州 450001
小麦粉的独特性质是形成黏弹性网络,主要归因于面筋蛋白的功能[1-3]。面筋蛋白可分为麦谷蛋白和醇溶蛋白[4]。在这些蛋白质中,麦谷蛋白高分子量亚基(HMW-GS)是面筋网络发育的关键成分,对小麦粉的功能特性尤为重要[5-6]。HMW-GS由3个结构域构成,包括非重复的N-末端结构域、非重复的C-末端结构域和中心重复结构域[7]。研究表明,HMW-GS在面粉加工方面对食品品质有着重要作用[8-9]。HMW-GS影响60%面包的烘焙品质[10-11]。
目前,关于HMW-GS缺失研究已有较多报道。由1D染色体组编码的1Dx5+1Dy10亚基组合与小麦的最优加工品质密切相关[12]。Zhang等[13]发现HMW-GS缺失显著降低了面团品质。1Dx2的缺失会影响小麦面筋的质量[14]。缺失1Dy12对面团性状和面粉加工质量产生负面影响[15]。Liu等[16]发现与Glu-A1缺失型相比,Glu-D1缺失显著降低了面团强度和延伸性。Suliman等[17]鉴定了MSD株系,发现Glu-D1位点(2.1 t+12 t和2t+12 t)两个不同等位基因可提高面粉品质。此外,1Dx5和1Bx7也是面团具有较高面筋强度和较好面包加工品质的重要因素[18]。因此,HWM-GS对面筋强度和面粉加工品质具有极其重要的作用。对HMW-GS亚基的研究,主要集中于基因沉默缺失方面,缺乏对面粉中回添HMW-GS的研究。
在此背景下,作者通过将1Dx5-N蛋白在大肠杆菌BL21(DE3)中组成型表达,纯化得到1Dx5-N蛋白,并分别以IPTG和乳糖作为诱导剂对其进行诱导表达,为进一步提高其诱导表达效率,对诱导条件进行优化。比较IPTG和乳糖两种诱导剂对1Dx5-N蛋白的表达量,尝试使用乳糖代替IPTG诱导表达蛋白,在降低成本的同时获得较好的表达效果。本研究为1Dx5-N对面筋蛋白的形成及作用机理提供依据。
1 材料与方法
1.1 主要材料与试剂
大肠杆菌BL21(DE3)、质粒pET-30a:河南工业大学生物工程学院实验室保藏;制胶液试剂盒、IPTG、Kana抗生素:北京索莱宝科技有限公司;质粒试剂盒:北京博迈德基因技术有限公司;SE无缝克隆试剂盒:北京庄盟国际生物基因科技有限公司;乳糖等为国产分析纯。
1.2 主要仪器与设备
6345HQ118566 PCR仪:Eppendorf AG;NANODROP 2000超微量分光光度计:ThermoFisher scientific;BIORIDGE离心机:郑州金友宁仪器有限公司;DYY-7C电泳仪:北京六一生物科技有限公司;Gel Doc XR凝胶成像系统:美国伯乐公司。
1.3 方法
1.3.1 1Dx5-N基因序列引物设计及目的基因的扩增
通过植物基因组网站phytozome(https://jgi.doe.gov/data-and-tools/data-systems/phytozome/)搜索1Dx5基因序列,以小麦基因组为模板,其中编码前89个氨基酸序列的基因序列为1Dx5-N,利用Oligo7.0软件设计引物,上游引物为TAATACGACTCACTATAGGG(0082),下游引物为TGCTAGTTATTGCTCAGCGG(0083);采用PCR方法扩增。PCR产物进行琼脂糖凝胶电泳检测。
1.3.2 回收目的基因及连接载体
参照Gel Extraction Kit(OMEGA)试剂盒说明书回收DNA片段,使用SE无缝克隆试剂盒进行重组反应,重组完成后,PCR 37 ℃保温30 min,冰浴5 min备用。
1.3.3 制备及转化大肠杆菌感受态细胞
挑取大肠杆菌BL21(DE3)接种至LB液体培养基,37 ℃、200 r/min振荡培养2 h。划线至LB平板,37 ℃倒置培养过夜。挑取单菌落接种至LB液体培养基,培养过夜。冰浴5 min,6 000 r/min离心5 min,收集菌体。0.1 mol/L CaCl2溶液(预冷)洗涤沉淀,6 000 r/min离心5 min,收集菌体。去离子水(预冷)洗涤沉淀,6 000 r/min离心5 min,收集菌体。加入预冷的0.05 mol/L CaCl2-15%甘油混合溶液,即为感受态细胞。加入1 μL重组质粒,冰浴30 min,42 ℃水浴热激90 s,冰浴3 min;加入LB-Kana液体培养基,37 ℃、170 r/min培养1 h,涂板,37 ℃倒置培养至出现单克隆菌落。
1.3.4 阳性克隆鉴定分析
随机挑取8个单菌落分别接种至800 μL LB-Kana液体培养基,编号1—8,37 ℃、200 r/min振荡培养2 h。以菌液为模板进行PCR检验。上述鉴定结果为阳性的菌液,按照质粒试剂盒说明书提取质粒。获得质粒后,以质粒为模板进行PCR检验。
1.3.5 1Dx5-N蛋白原核表达
将筛选出含有目的基因的大肠杆菌BL21(DE3)菌株,在5 mL LB-Kana液体培养基中37 ℃、200 r/min培养5 h,加入乳糖(终质量浓度为9 g/L),30 ℃、200 r/min培养16 h,将菌液10 000 r/min离心1 min,弃上清液,用100 μL Tris-HCl缓冲液重悬菌体,冰上超声破碎菌体。10 000 r/min离心1 min分离上清液和沉淀,分别进行SDS-PAGE检测。
1.3.6 诱导蛋白表达条件优化
参照李攀峰等[19]、师聪等[20]、王建洲等[21]的方法并稍加改进。以IPTG浓度0.6 mmol/L、乳糖质量浓度9 g/L、诱导温度30 ℃和诱导时间16 h为初始诱导条件,单因素试验分别考察IPTG浓度(0、0.2、0.4、0.6、0.8、1 mmol/L)、乳糖质量浓度(0、0.5、1、2.5、5、7、9、12、15 g/L)、IPTG诱导温度(15、20、25、30、35 ℃)、乳糖诱导温度(15、20、25、30、35 ℃)、IPTG诱导时间(0、2、4、6、8、10、12、16 h)和乳糖诱导时间(0、2、4、6、8、10、12、16 h)对1Dx5-N蛋白表达量的影响。
1.3.7 正交试验设计
根据以上6个单因素试验结果,设计L9(34)正交试验。
1.4 数据处理
采用IBM SPSS Statistics 26进行数据处理和分析。
2 结果与分析
2.1 目的基因扩增及转化结果检测
HMW-GS的1Dx5-N序列全长2 540 bp,共编码833个氨基酸。其中1Dx5-N序列基因占有267 bp,共编码89个氨基酸,相对分子质量为16.211 kDa。图1(a)中泳道1、2为目的基因,大小为269 pb。扩增效果良好,条带明亮,充分表明引物的稳定性。胶回收DNA,测得DNA质量浓度为173 ng/μL。采用相同方法对pET-30a线性载体进行胶回收,测得pET-30a线性载体质量浓度为51.9 ng/μL,二者回收浓度较高,回收效果符合预期。图1(b)表明,使用通用引物扩增获得基因片段的大小在500 bp附近,与阳性对照基因片段大小(589 bp)一致。通过测序表明载体连接成功,PCR扩增获得大小和序列正确的1Dx5-N基因。图1(c)表明,重组质粒经双酶切后得到大小在250 bp附近的条带,片段大小与目的基因片段(269 bp)相吻合。证明重组质粒pET-30a-1Dx5-N构建成功。

图中M为BM 2 000 DNA Marker;图(a)中泳道1、2均为目的基因;图(b)中泳道1—11为菌液、泳道12为阳性对照、泳道13为阴性对照;图(c)泳道1为pET-30a-1Dx5-N质粒双酶切。图1 1Dx5-N原核表达载体构建Fig.1 Construction of 1Dx5-N prokaryotic expression vector
2.2 1Dx5-N蛋白原核表达可溶性分析
图2表明,诱导后重组菌表达的蛋白条带中有条约为16.211 kDa的蛋白,与不带His标签的1Dx5-N基因对应的蛋白大小一致。未诱导的菌体在16.211 kDa处无明显条带,诱导后的菌体在16.211 kDa处有明显条带。表明重组菌经诱导后成功表达1Dx5-N蛋白。菌体破碎上清液中几乎没有1Dx5-N蛋白,大部分目的蛋白存在于沉淀中。表明重组蛋白主要以不可溶的包涵体形式存在。
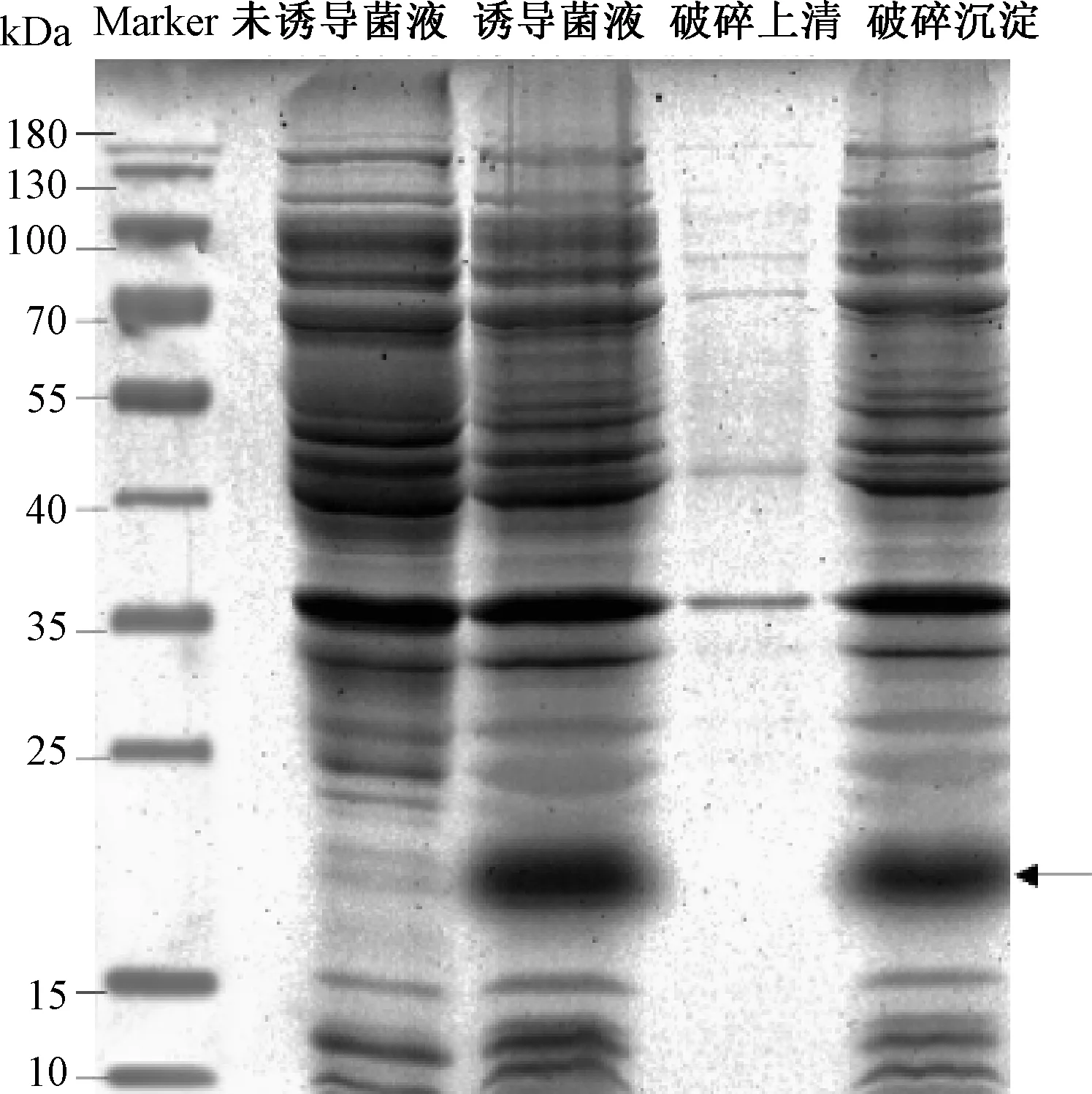
图2 原核表达的SDS-PAGE电泳图Fig.2 SDS-PAGE electrophoresis of prokaryotic expression
2.3 诱导浓度对诱导蛋白表达量影响
分别对IPTG诱导和乳糖诱导重组菌胞进行SDS-PAGE电泳分析。通过蛋白电泳,在15 kDa左右出现目的条带(图3)。乳糖本身也可以作为菌体的碳源供其生长代谢[22]。所以乳糖作为诱导剂时,目的蛋白表达量比IPTG诱导高(图3)。图3 (a)表明,随着IPTG浓度增加,蛋白表达量逐渐上升,目的条带颜色逐渐加深。IPTG浓度达到0.6 mmol/L时,Image 分析OD为448.59,目的条带颜色最深,蛋白表达量达到最大。当IPTG浓度超过0.6 mmol/L,目的条带颜色减弱,蛋白表达量开始逐渐降低。由于IPTG具有一定的毒性,抑制菌体生长进而抑制目标蛋白表达[23]。图3(b)表明,随着乳糖质量浓度增加,目的条带颜色逐渐加深,蛋白表达量逐渐地上升。乳糖质量浓度达到9 g/L时,Image分析OD为868.18,目的条带颜色最深,蛋白表达量最高。当乳糖质量浓度超过9 g/L,目的条带颜色不再增加。综上所述,IPTG最佳诱导浓度为0.6 mmol/L,乳糖最佳诱导质量浓度为9 g/L。
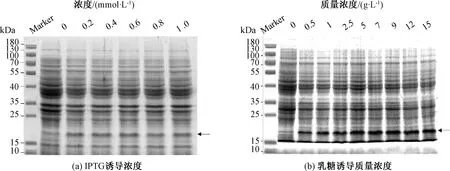
图3 不同诱导剂浓度对1Dx5-N蛋白表达影响的SDS-PAGE分析Fig.3 Effects of different inducer concentrations on 1Dx5-N protein expression by SDS-PAGE analysis
2.4 温度对诱导蛋白表达量影响
图4表明,当诱导温度为35 ℃时,温度较高,明显适合菌体生长,菌体生长过快,因此IPTG和乳糖诱导蛋白表达量均很低。图4 (a)表明,随着温度的降低,IPTG诱导蛋白表达量先升高后降低;当温度为30 ℃时,Image分析OD为229.39,目的条带颜色最深,蛋白表达量最高。图4(b)表明,乳糖诱导受温度的影响较小,蛋白表达量基本没有变化。乳糖的诱导效果比IPTG更加稳定。当温度为30 ℃时,Image分析OD为369.86,目的条带颜色最深,蛋白表达量最高。综上所述,IPTG和乳糖诱导蛋白表达最佳温度均为30 ℃。
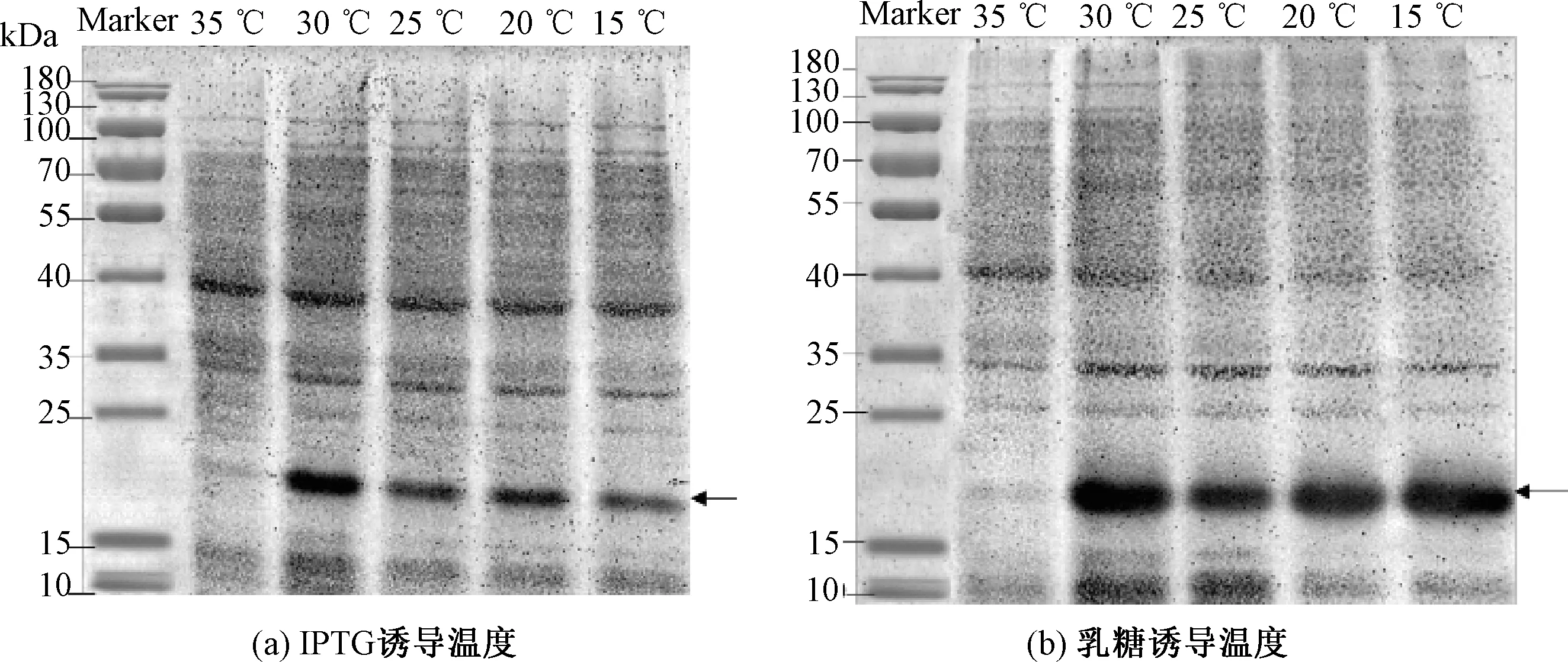
图4 两种诱导剂在不同温度对1Dx5-N蛋白表达影响的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the effect of two inducers on 1Dx5-N protein expression at different temperatures
2.5 时间对诱导蛋白表达量影响
图5(a)表明,IPTG诱导蛋白表达量随着诱导时间增加并无明显增加。图5(b)表明,乳糖诱导蛋白表达量随着诱导时间增加而增加,并在16 h时达到最大表达量,目的条带颜色最深。当时间为16 h时,Image分析OD为1 369.56,目的条带颜色最深,蛋白表达量最高。综上所述,IPTG和乳糖诱导表达时间均选择16 h。
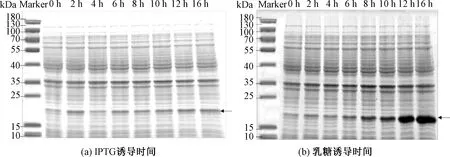
图5 两种诱导剂在不同时间对1Dx5-N蛋白表达影响的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the effects of two inducers on 1Dx5-N protein expression at different time periods
2.6 正交试验
通过分析影响1Dx5-N蛋白表达量的单因素试验,设计L9(33)正交试验,因素与水平见表1。

表1 正交试验因素与水平Table 1 Orthogonal test factors and levels
由表2、表3可知,各因素对IPTG诱导表达蛋白影响次序依次为IPTG诱导剂浓度>IPTG诱导时间>IPTG诱导温度。故可知IPTG诱导表达蛋白最优条件为A2B2C3(IPTG浓度0.6 mmol/L、温度30 ℃、时间16 h),此时,总蛋白质量浓度为1.04 mg/mL。由表4、表5可知,各因素对乳糖诱导表达蛋白影响次序依次为乳糖诱导剂浓度>乳糖诱导温度>乳糖诱导时间。故可知乳糖诱导表达蛋白最优条件为D2E2F3(乳糖质量浓度9 g/L、温度30 ℃、时间16 h),此时总蛋白质量浓度为1.62 mg/mL。
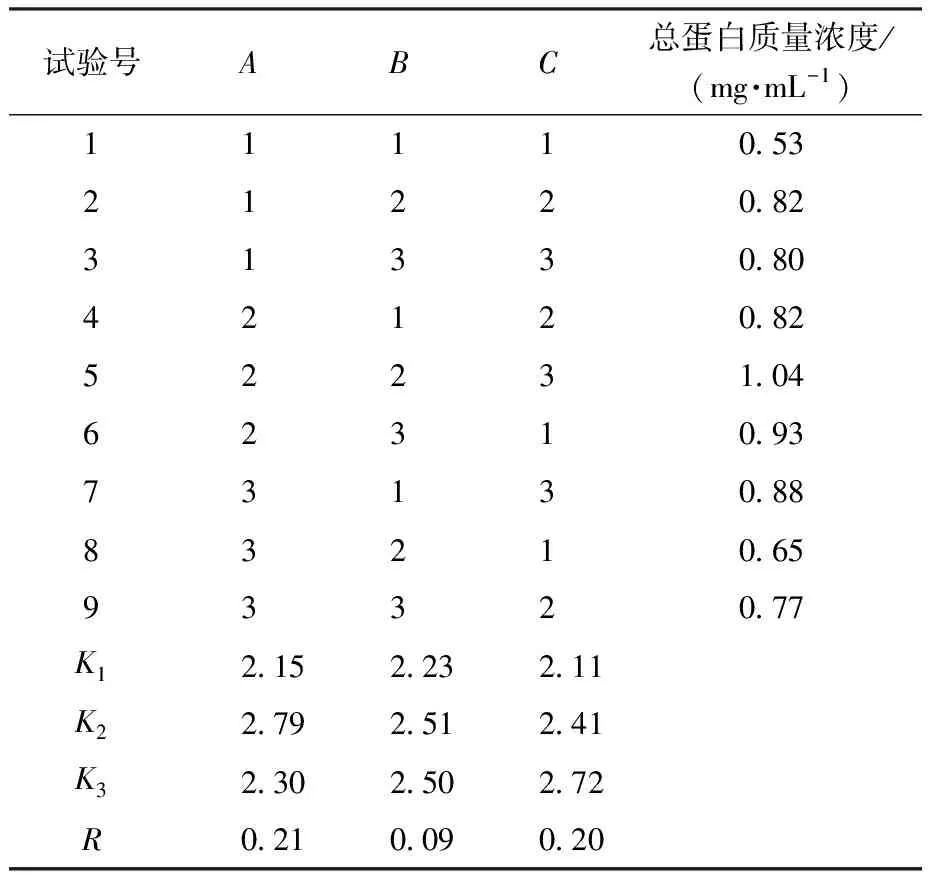
表2 IPTG诱导表达正交试验结果Table 2 Results of the orthogonal test of IPTG-induced expression

表3 IPTG诱导表达方差分析Table 3 Variance analysis of IPTG induced expression
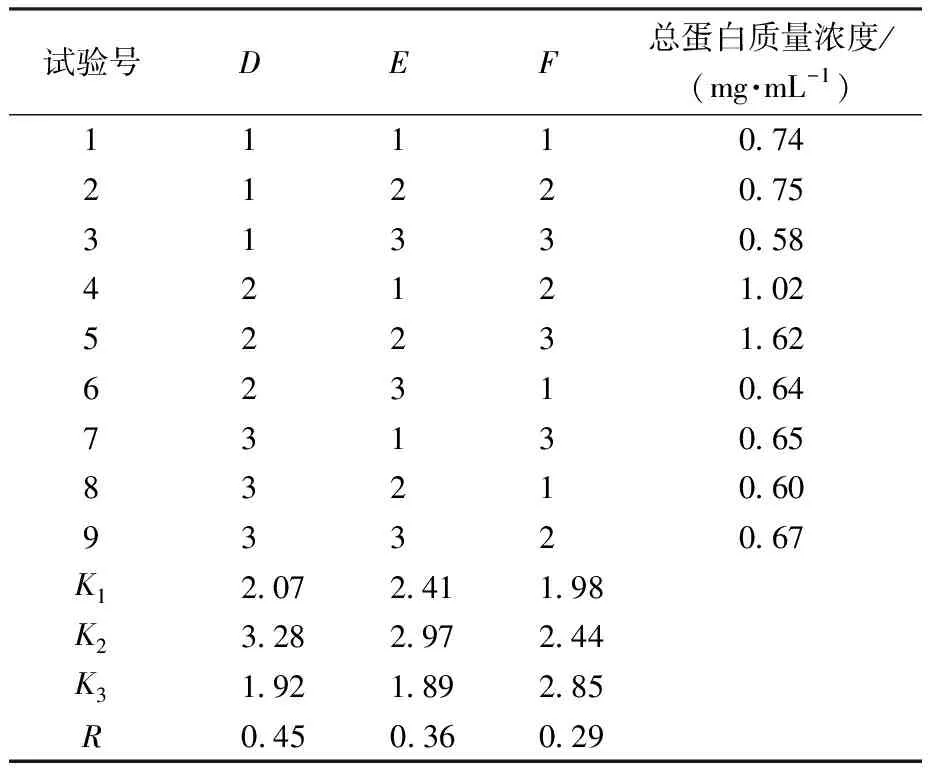
表4 乳糖诱导表达正交试验结果Table 4 Orthogonal test results of lactose-induced expression
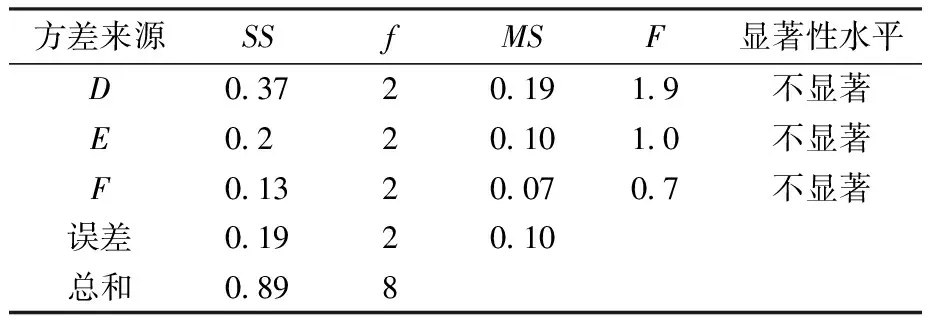
表5 乳糖诱导表达方差分析Table 5 Analysis of variance of lactose induced expression
3 结论
本研究成功实现1Dx5-N蛋白在大肠杆菌BL21(DE3)中表达,对构建质粒后的细胞进行克隆鉴定确保能够稳定地进行蛋白表达,并对诱导条件进行了优化。结果表明1Dx5-N能在大肠杆菌BL21(DE3)中稳定遗传并大量表达,IPTG诱导最佳条件:IPTG浓度0.6 mmol/L、温度30 ℃、时间16 h。乳糖诱导最佳条件:乳糖质量浓度9 g/L、温度30 ℃、时间16 h。乳糖作为诱导剂,表现出比IPTG更优越的特性,乳糖诱导表达总蛋白浓度为1.62 mg/mL,IPTG诱导表达总蛋白浓度为1.04 mg/mL,因此,采用乳糖代替IPTG进行大量诱导表达,是一种经济、安全和高效的选择。既可降低试验成本,又可减少IPTG作为有毒物质带来的不利影响。研究结果为后续获得具有足量的并具有生物活性的1Dx5-N蛋白及添粉试验奠定基础,为后期研究1Dx5-N对面筋蛋白特性的影响提供了依据。

