辽宁部分地区猪圆环病毒3 型cap 蛋白的测序和遗传进化分析
牛知音,姜 卓,龚商羽
(1.锦州市农业农村综合服务中心(锦州市植物保护中心),辽宁 锦州 121000;2.大连市金普新区动物疫病预防控制中心,辽宁 大连 116199;3.锦州市动物疫病预防控制中心(锦州市动物卫生监督中心),辽宁 锦州 121000)
最近发现的猪圆环病毒3 型(PCV3) 与其他三种猪圆环病毒PCV1、PCV2 和PCV4 一起属于圆环病毒科的圆环病毒属。据报道,PCV3 可以感染猪、野猪和其他几种中间宿主,导致受影响动物的单个或多个感染。PCV3 感染可导致呼吸系统疾病、消化系统疾病、生殖系统疾病、多系统炎症和免疫反应。到目前为止,PCV3 感染,以及由PCV3 引起的疾病,已经在世界范围内的许多养猪场中被报道,并且阳性率很高,这表明该病毒可能是养猪业中的另一种重要病原体。因此,了解辽宁地区猪PCV3 遗传变异情况,为辽宁地区PCV3 的疫苗研究、免疫防控提供参考。
1 材料与方法
1.1 材料
2019 年5 月至2020 年5 月,从辽宁省部分地区采集具有腹泻、呼吸或繁殖障碍等临床症状的仔猪、母猪或死胎中收集了435 份组织标本,包括淋巴结,脾脏,肾脏和肺脏。所有样品均送至昌图县现代农业发展服务中心实验室进行病原检测。
1.2 主要试剂配方
1.2.1 琼脂糖凝胶电泳用溶液 50xTAE 电泳缓冲液: 分别称量 Tris 碱24.2 g,EDTA 1.46 g,冰乙酸5.71 mL,蒸馏水定容至100 mL,常温避光保存。
1.2.2 Top10 (上海唯地生物DL1010) 感受态细胞制备及转化所需液体0.1 mol/L 氯化钙溶液: 取0.2g 的无水CaCh,用蒸馏水定容至200 mL,再用浓HCL 调节pH =6.5 后,高压灭菌。
氨苄青霉素(Amp) 贮存液(100 mg/mL):200 mL 灭菌去离子水完全溶解20 g Amp 粉剂,无菌处理后,-20 ℃条件下储存。
LB 培养基: 分别称量1g 的Tryptone,0.5g 的Yeast extract 和1g 的NaCb 溶于80 mL的去离子水中,用10 mol/L 的NaOH 调节pH 7.4,定容到100 mL,高压灭菌,4 ℃条件下保存备用。
Amp/LB 培养基 (100 μg/mL): 按1 ∶1 000比例向高压后的液体LB 培养基中加入Amp 贮存液,混匀后4 ℃保存。
1.3 荧光PCR 检测
1.3.1 样品前处理 每份组织样品剪取2 ~3 g,放入2 mL 圆底离心管中,每个离心管中加入5 cm 直径钢珠一个,放入Thermo 组织匀浆机中5 min。将研磨好的组织匀浆反复冻融3 次,12 000 r/min,离心10 min,收集上清液装入1.5 mL 离心管中,-20 ℃保存备用。
1.3.2 病毒DNA 提取 使用磁珠法病毒DNA/RNA 提取试剂盒提取组织样品中的DNA/RNA,操作按照试剂盒说明书进行。提取的DNA 或RNA,用封口膜封好并保存于-20 ℃或-80 ℃。
1.3.3 荧光PCR 检测 用TaqMan 的实时荧光PCR 检测试剂盒(上海之江) 检测PCV3 病毒DNA。此外,其他病原体包括猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病毒(PRV)、猪细小病毒(PPV)、猪流行性腹泻病毒(PEDV)、传染性胃肠炎病毒(TGEV) 使用商业化的荧光定量聚合酶链反应(PCR) 检测试剂盒或逆转录PCR (RT - PCR) 检测试剂盒 (世纪元亨)检测。
1.4 cap 基因序列分析
1.4.1 全基因引物设计与合成 基于Gen-Bank 中已发布的PCV3 分离株基因组进行多序列比对,用DNA Star 与Primer6.0 软件设计了1 对引物。引物 PCV3 - F (ATGAGACACAGAGCTATATTCAG)、PCV3 - R (TTCACTTAGAGAACGGACTTG) 用于扩增PCV3 完整的cap 基因组序列。引物由上海生工合成。合成的引物室温12 000 转离心5 min 后,用RNase free ddH2O 溶解为10 gmol/L 使用液备用。
1.4.2 样品总DNA 提取 对样品重新进行总DNA 提取,进行PCR 检测。
1.4.3 目的基因序列扩增 以1.3.2 步骤中提取的总DNA 为模板,使用全基因序列引物分别进行PCR 扩增,扩增反应20 μL 体系如下: 模板2 μL,Taq Master Mix 10 μL,上游引物1 μL,下游引物1 μL,RNase-Free dd H2O 6 μL。
扩增反应程序如下: 预反应95 ℃5 min;94 ℃30 s,55 ℃30 s,72 ℃30 s,35 个循环; 延伸72 ℃8 min。
1.4.4 全基因序列PCR 产物纯化回收 操作步骤参照SanPrep 柱式DNA 胶回收试剂盒(B518131) (上海生工)。
1.4.5 目的基因与克隆载体连接 将1.3.3中回收纯化后的PCR 产物分别与pUC -18T 载体(TAKARA 6011) 连接。建立的连接体系(10 μL) 如下:
连接反应体系:
16 ℃连接,前天17 点到第二天14 点。
1.4.6 连接产物转化 ①100 L 感受态细胞(上海唯地生物DL1010),置于冰上,完全解冻后轻轻将细胞均匀悬浮。②加入10L 连接液,轻轻混匀,冰上放置30 min。③42 ℃水浴热激60 s。冰上放置10 ~15 min。④加400 L LB 培养基,37 ℃220 rpm 振荡培养1 小时。⑤室温下4 000 rpm 离心5 分钟,用枪头吸掉400 L 上清液,用剩余的培养基将细胞悬浮。⑥将细菌涂布在预先用20 L 100 mmoL IPTG 和100 L 20 mg/mL X-gal 涂布的含有氨苄抗生素的平板上,倒置培养过夜。对菌液进行PCR检测: 将PCR 检测为阳性的菌液送往测序公司进行序列测定。
1.4.7 PCV3cap 基因序列分析 将测序结果在NCBI 网站上进行BLAST 比对,确定基因序列为正确序列后,将序列与从GenBank 数据库中下载的参考序列进行序列分析。使用MEGA6 程序中的最大似然法(10 000 次重复)构建PCV3 cap 基因序列的系统进化树,使用DNAStar 中的Megaligement 进行同源性分析。
2 结果与分析
2.1 PCV3 混合感染情况
对PCV3 混合感染情况进行统计分析,发现PCV3 与其他病原体存在2 种病感染和3 种病原混合感染。PCV3 与PCV2、PRV、PEDV、PPV、PRRSV 和TGEV 的两种病原混合感染率分别为14.43% (14/97)、7.22% (7/97)、7.22% (7/97)、5.15% (5/97)、2.06%(2/97) 和2.06% (2/97)。3 种病原混合感染中,PCV3、PCV2 和PPV 的合并感染率较高,为10.31% (10/97)。样本中PCV3 的单病原感染率为17.53% (17/97)。以上结果进一步显示了PCV3 对生猪养殖业的潜在威胁(表1)。

表1 不同临床症状中不同病原混合感染情况
2.2 PCV3 cap 基因序列分析
从检测为PCV3 阳性的病料中,选择部分材料进行PCV3 cap 基因扩增和序列测定。经过扩增和测序比对,共获得了3 条PCV3 cap基因序列。从GenBank 下载了17 条具有代表性的国内外的PCV3 cap 基因组序列,借助MEGA 6 软件中的最大似然法(10 000 次重复引导) 构建遗传进化树(图1)。Cap 基因序列的比对结果显示,本试验获得的3 条PCV3完整Cap 基因全长650bp,没有发生碱基的缺失或插入。PCV3 -2 和PCV3 -3 为一个分支,PCV3 -1 作为一个独立分支,他们三者之间亲缘关系很近,说明近年辽宁地区PCV3 毒株存在一种新的进化方向。
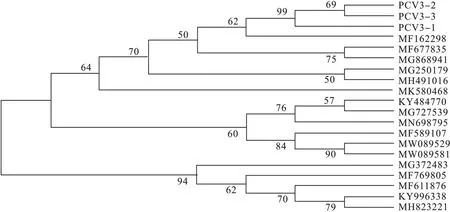
图1 PCV3 cap 全基因序列进化树PCV1、PCV2、PCV3 表示本实验获得的毒株
2.3 PCV3 cap 基因同源性分析
对3 株PCV3 分离株及17 条下载的参考毒株用DNAStar 软件中的MegAlignment 软件进行同源性分析(图2)。发现3 株PCV3 核苷酸序列的同源性为98.84% ~99.5%,与GeneBank下载的17 个参考毒株的核苷酸同源性为90.9% ~99.8%。PCV3 -2、PCV3 -3 序列与参考序列MW089581 的同源性最低(90.9%),PCV3 -2、PCV3 -3 序列与PCV3 -1 序列的同源性最高(99.8%) PCV3 的比对结果较PCV2来说同源性更高,说明变异程度较低,更加保守。

图2 PCV3 cap 基因序列同源性比较
3 小结与展望
PCV3 感染可能与生殖障碍、呼吸系统疾病和多器官炎症密切相关。与对养猪业造成巨大危害的PCV2 相似,PCV3 感染发生在猪和野猪以及众多中间宿主中,导致水平和垂直传播。值得注意的是,据报道该病毒可以感染经产母猪和活产仔猪,表现出明显的临床症状或亚临床症状,表明该病毒对养猪业也有潜在的危害。因此,我们应该继续密切监测PCV3 的流行和与其他猪病原体的混合感染,以及疾病表现的共同因素。应持续跟踪PCV3 优势毒株的遗传多样性和分子流行病学的动态变化。此外,最近有研究证明了使用原代猪肾细胞成功分离PCV3。然而,有限的病毒培养细胞限制了病毒的体外繁殖和研究。因此,通过反向遗传学可能为研究PCV3 的致病机制和防控该疾病提供有用的信息。