利妥昔单抗治疗弥漫大B细胞淋巴瘤患者的效果及其耐药的多因素分析
娄小飞,杜可朴
(郑州大学第一附属医院 a.药学部;b.放射科,河南 郑州 450052)
弥漫大B细胞淋巴瘤(diffuse large B cell lym-phoma,DLBCL)属侵袭性淋巴瘤,表现为无痛性淋巴结肿大,晚期可出现恶病质[1-2]。利妥昔单抗联合CHOP方案是其首选治疗方案,但仍有30%左右患者因利妥昔单抗耐药而出现复发、难治、不缓解[3]。据调查,初治对利妥昔单抗敏感DLBCL患者二次接受治疗时,有60%患者出现利妥昔单抗耐药,再次治疗缓解率较低且持续时间短,但目前其耐药机制尚不明确[4]。另外,更换化疗方案、联合中医或加用其他治疗手段后,仍有部分因不耐受或其他致死副作用而死亡[5]。因此,尽快明确DLBCL患者利妥昔单抗耐药影响因素具有现实意义。但迄今为止,我国仍未整理相关系统完整的流行病学资料。鉴于此,本研究重点分析利妥昔单抗耐药影响因素,旨在为做好利妥昔单抗耐药的预防及管理提供参考。
1 对象与方法
1.1 研究对象
本研究经医院医学伦理委员会审查,选取2018年7月至2022年10月郑州大学第一附属医院收治的147例DLBCL患者。纳入标准:符合DLBCL诊断标准[6],经病理组织学确诊为初治;在郑州大学第一附属医院接受系统、规范利妥昔单抗化疗;预计生存期≥3个月;病历信息、随访记录完整。排除标准:合并其他严重器官疾病者;血清学检测为HIV或HBV感染者;依从性差,不能判定疗效者;中途退出者。剔除标准:利妥昔单抗治疗后因病情变化病故者。
1.2 疗效评估标准
参考《中国弥漫性大B细胞淋巴瘤诊断和治疗指南(2013年版)》[6]评估,淋巴结、淋巴结肿块及骨髓检查均正常为完全缓解(complete response,CR);淋巴结正常,淋巴结肿块正常或缩小75%,骨髓正常或呈现不确定状态为不确定部分缓解(uncertain partial response,CRu);淋巴结正常或缩小>50%,淋巴结缩小>50%,骨髓阳性或无关为部分缓解(partial response,PR);出现新发病灶,淋巴结增大或新发淋巴结肿块,骨髓复发为复发或进展(relapse or progression,SD或PD)。将CR、CRu、PR纳入客观缓解率(objective response rate,ORR)。化疗后6个月内CRu、PR、SD或PD难治/复发/病死者列入耐药组,余病例列入对照组。
1.3 研究方法
1.3.1治疗方法
第1天,静脉注射750 mg·m-2环磷酰胺(国药准字H32020857,江苏恒瑞医药)、50 mg·m-2盐酸多柔比星注射液(国药准字H20130186,意法玛西亚)、1.4 mg·m-2硫酸长春新碱(国药准字H20043326,海正辉瑞制药);第1~5天,口服100 mg·m-2醋酸泼尼松片(国药准字H33021207,浙江仙琚制药);第1天,静脉注射375 mg·m-2利妥昔单抗(国药准字S20120004,上海罗氏制药)。21 d为1疗程,连续治疗6个疗程。
1.3.2资料收集
取得院方同意后,调取研究对象的电子病历档案,收集性别、年龄、肿瘤直径、B症状、肿瘤基因突变分型、免疫组织化学、免疫球蛋白、血红蛋白(hemoglobin,Hb)、白蛋白(albumin,ALB)、β2-微球蛋白(β2-microglobulin,β2-MG)、乳酸脱氢酶(lactate dehydrogenase,LDH)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、淋巴细胞与细胞计数比值(lymphocyte to cell count ratio,LMR)、中性粒细胞与淋巴细胞计数比值(neutrophil to lymphocyte count ratio,NLR)、钙离子通道A1C(calcium channel A1C,CACNA1C)、白细胞介素-17A(interleukin-17A,IL-17A)等相关资料。
1.4 质量保障
研究对象的选择严格遵循病例选取标准,以确保研究对象质量,资料收集前对研究员进行培训,讲解各要素评估方法和标准,确保资料真实性和客观性,患者各因子水平由2名医护人员独立测定,数据不一致时由护士长重新测定,以减少数据偏倚。质控员对数据进行核实校对,随机抽取5%研究对象进行抽样复查,一致率均超过98%。
1.5 统计学方法
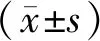
2 结果
2.1 临床疗效及预后
147例DLBCL患者中,有70例CR(47.62%),15例CRu(10.20%),20例PR(13.61%),42例SD或PD(28.57%),ORR为71.43%。化疗后6个月内病死14例,难治/复发37例,列入耐药组,余病例列入对照组。
2.2 两组资料比较
耐药组B症状患者比例高于对照组,Hb、ALB、LMR、CACNA1C低于对照组,β2-MG、ESR、LDH、NLR、IL-17A高于对照组(P<0.05)。见表1。

表1 两组资料比较
2.3 利妥昔单抗耐药的logistic回归方程分析
以发生利妥昔单抗耐药情况(赋值:是=1,否=0)为因变量,以单因素分析中P<0.05的10个变量作为自变量,采用多因素logistic回归分析显示,B症状、ALB、NLR、LMR、CACNA1C、IL-17A是利妥昔单抗耐药的相关影响因素(P<0.05)。见表2、3。

表2 自变量赋值

表3 利妥昔单抗耐药的logistic回归方程分析
3 讨论
本研究数据显示,ORR为71.43%,和耿素红等[7]研究报道(77.88%)相近,其治疗机制主要有:(1)诱导抗体、补体介导细胞毒作用;(2)增加肿瘤细胞化疗敏感性;(3)直接抑制细胞生长或诱导细胞凋亡。本研究随访显示,化疗后6个月内病死14例,难治/复发37例,产生此结果的原因可能是肿瘤细胞对利妥昔单抗产生多重耐药性,其中多种耐药基因过度表达是DLBCL化疗失败的主要原因,但其耐药机制尚未阐明。相关报道指出,初治DLBCL患者约40%最终会复发/难治,3 a无疾病进展生存率仅37%,总生存率49%,而获得性利妥昔单抗耐药在其中扮演重要角色[8]。因此,探索并阐明利妥昔单抗耐药机制,针对易诱发利妥昔单抗耐药因素进行及早预防,化疗后对患者自身加以管控,对降低利妥昔单抗耐药发生风险及改善预后具有重要现实意义。
NLR、LMR是构成肿瘤细胞生存微环境重要组成部分,参与各种免疫防御、应答、调节过程。相关报道指出,LMR升高可延长患者无进展生存期及总生存期[9]。分析认为,耐药组淋巴细胞减少,所承担产生和运载抗体功能下降,防御病毒感染能力亦随之下降。苟金玉等[10]报道,15例儿童及青少年间变性大细胞淋巴瘤伴随B症状中位最大标准摄取值高于9例不伴随患者。本研究显示,伴随B症状妥昔单抗耐药发生风险是不伴随B症状5.809倍。相关研究指出,CACNA1C水平升高可引起肿瘤细胞内钙离子内流,造成内钙超载,促进细胞凋亡[11]。另有研究指出,CACNA1C介导L型钙电流具有细胞质钙持续上升钙瞬态特性,这在一定程度上能提高利妥昔单抗药物疗效[12]。本研究数据显示,耐药组CACNA1C水平低于对照组,分析原因,利妥昔单抗通过作用于CD20,导致脂质筏运动,促进TRPCI活动,引起细胞去极化而激活CACNA1C基因,介导钙离子内流[13]。已有报道证实,在利妥昔单抗基础上加用钙离子通道阻滞剂,可进一步阻止细胞凋亡,这也为靶向治疗提供参考[3]。ALB合成于肝脏,受机体营养状况、血浆渗透压及激素平衡等因素影响,可分解为氨基酸,以供组织合成其他蛋白质。本研究发现,随着ALB下降,利妥昔单抗耐药风险呈0.454倍增长。受众多因素影响,耐药组患者机体免疫、水解代谢等功能损伤,细胞毒性和炎症状态增强,短时间内病情恶化[14]。相关研究证实,利妥昔单抗可促进肿瘤微环境IL-17A表达,IL-17A水平升高可抑制DLBCL细胞株凋亡,引起利妥昔单抗耐药,和本研究论点相符[15]。因此,抑制肿瘤微环境IL-17A释放对改善利妥昔单抗耐药及提高生活质量有着积极意义。朱园等[16]报道,华蟾素可通过促进cleaved caspase-3、cleaved PARP表达,加快DLBCL细胞株凋亡,阻止肿瘤微环境Th17和IFT细胞分化,抑制IL-17A释放,最终逆转IL-17A引起的利妥昔单抗耐药。
4 结论
利妥昔单抗治疗DLBCL效果确切,但仍有34.69%患者因利妥昔单抗耐药难治/复发/病死。B症状、ALB、NLR、LMR、CACNA1C、IL-17A是导致利妥昔单抗耐药的独立危险因素。但本研究样本量相对较少,加之随访时间较短,研究结果可能存在一定偏倚,未来仍需要开展多中心、前瞻性研究,扩大样本量,延长随访时间,获得更加准确数据,以进一步完善利妥昔单抗耐药机制,更好地指导临床治疗。

