脂多糖对绵羊输卵管上皮Claudin-1和Occludin表达的影响
曾建林 吕建树 段宏伟 杨 帅 张 榕 张 勇 胡俊杰
(甘肃农业大学动物医学院/甘肃省动物生殖生理及繁殖调控重点实验室,甘肃 兰州 730070)
输卵管是女性生殖系统的一部分,是连接卵巢和子宫的管道,为精卵结合提供适宜的环境,是输送卵母细胞以及合子初步发育的重要场所。输卵管内环境紊乱可能影响输卵管功能,导致雌性动物生产性能下降[1]。输卵管上皮细胞之间通过紧密连接(tight junction,TJ)蛋白相连。紧密连接蛋白广泛存在于输卵管上皮,参与上皮细胞间的紧密连接及细胞粘附,调节细胞间物质转运、防止细菌、内毒素等侵染,构成了一种上皮特有的初级防御屏障[2]。封闭蛋白-1(Claudin-1)和闭合蛋白(Occludin)是紧密连接蛋白家族中两个重要的跨膜蛋白,参与调节细胞旁通透性、介导离子选择性扩散及细胞迁移[3-4]。输卵管上皮紧密连接蛋白构成的上皮屏障是维持输卵管正常生理功能和管内环境稳态不可或缺的。
脂多糖(lipopolysaccharides,LPS)是革兰氏阴性菌释放的内毒素。当机体受脂多糖刺激会产生一系列免疫防御机制,诱机体发炎症反应[5-6]。反刍动物异常代谢和炎症性疾病是外周循环LPS的主要来源。研究表明,亚急性瘤胃酸中毒期间产生的大量LPS会造成瘤胃上皮炎症反应,破坏上皮屏障,导致LPS易位至外周循环,诱发乳腺、子宫等部位炎症反应[6-8]。如患有子宫内膜炎的奶牛血清中的LPS浓度上升,卵泡液中的LPS浓度比正常时期高出2 900倍[9-11];肠道菌群紊乱造成肠道炎症和肠上皮损伤,导致LPS或病原菌通过血液从肠道迁移到子宫造成子宫炎[11-12];家兔耳缘静脉注射LPS可诱发输卵管炎症反应[13]。上述研究均表明,外周循环中的LPS是造成输卵管炎症反应的潜在诱因,但在反刍动物饲养管理过程中,亚急性瘤胃酸中毒等疾病造成的大量LPS 易位易被忽视,从而可能增加诱发输卵管炎症的风险。
然而,Claudin-1、Occludin 在绵羊输卵管中的表达特性,以及LPS是否会通过影响Claudin-1、Occludin 的表达,进而造成输卵管上皮细胞间信号传导及屏障功能障碍,最终造成绵羊生殖性能下降,均鲜见文献报道。因此,本研究首先明确Claudin-1、Occludin在绵羊输卵管中的表达特性,其次通过LPS 诱导的绵羊输卵管炎症模型阐明LPS 对输卵管上皮Claudin-1、Occludin 表达的影响,试图阐明LPS 对绵羊输卵管屏障损伤的机制,以期为反刍动物饲养管里的科学发展及提高绵羊生殖机能的相关研究提供基础资料。
1 材料与方法
1.1 试验材料与试剂
苏木精(D10393,Bioss,北京)、伊红(S0159,Bioss,北京)、TRIzol 裂解液(R1100,Solarbio,北京)、RIPA裂 解 液(radio immunoprecipitation assay lysis buffer)(R0010,Solarbio,北京)、胎牛血清(fetal bovine serum,FBS)(Hycione,美国)、DMEM/F12细胞培养基(Hycione,美国)、反转录试剂盒(Promega,北京)、脂多糖(Cat.No.L2880,Sigma,美国)、角蛋白18(18708-1-AP,Proteintech Group,武汉)、Claudin-1(28674-1-AP,Proteintech Group,武汉)、Occludin(66378-1-Ig,Proteintech Group,武汉)、β-actin(bs-0061R,Bioss,北京)、荧光二抗(ab150077、ab150115)(Abcam,美国)、免疫印迹二抗(bs-0295GHRP、bs-40296G-HRP,Bioss,北京)、反转录试剂盒(TaKaRa Bio, 大连)。
1.2 样品采集
于甘肃省兰州市当地屠宰场采集健康成年绵羊的输卵管组织。部分置于37 ℃、含青链霉素的磷酸盐缓冲液(phosphate buffer saline,PBS)中,迅速运回实验室用于细胞培养(n=10);部分用4%多聚甲醛固定输卵管组织(n=5)用于石蜡包埋;其余样品(n=10)在液氮中保存备用。
1.3 绵羊输卵管组织的苏木精-伊红染色
将4%多聚甲醛固定的输卵管组织,按照伞部、壶腹部、峡部分割,石蜡包埋后制作成5 μm石蜡切片,在60 ℃条件下烘片2 h,二甲苯、梯度酒精脱蜡,苏木精染色2 min,流水冲洗,后利用1%(v/v)的盐酸酒精分化液分化3 s后取出,伊红染色1 min。梯度酒精浸泡脱水,后通过二甲苯浸泡透明,封片。使用Olympus-dp73 光学显微镜(Olympus,日本)观察拍照。
1.4 组织免疫荧光
将4%多聚甲醛固定的输卵管组织,按照伞部、壶腹部、峡部分割,石蜡包埋,制作成5 μm 石蜡切片,60 ℃烘片2 h,二甲苯、梯度酒精脱蜡,0.01 mol·L-1的柠檬酸钠溶液98 ℃抗原修复15 min,自然冷却至室温,PBS洗涤,3% H2O2室温孵育15 min,PBS洗涤,5%的山羊血清37 ℃封闭30 min,4 ℃一抗孵育过夜(1∶250)。PBS 洗涤,荧光二抗37 ℃避光孵育1 h,PBS 洗涤,1 μg·mL-1的4′,6-二脒基-2-苯基吲哚(diamidino-2-phenylindole,DAPI)染核后,使用Revolve Omega 荧光显微镜(Apex Bio, 美国)拍照。
1.5 蛋白免疫印迹(western blot, WB)
将输卵管组织按照伞部、壶腹部、峡部混合(n=10),液氮研磨并各自称取相同重量样本。分别在组织及细胞样本中加入等量RIPA 裂解液及苯甲磺酰氟(phenylmethanesulfonyl fluoride, PMSF)进行充分裂解。4 ℃、12 000 r·min-1条件下离心15 min 提取上清液,加入4×蛋白上样缓冲液混匀后,在98 ℃、15 min条件下处理获得变性蛋白。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),目的蛋白转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDE),Tris-HCl缓冲盐溶液+Tween(Tris buffered saline with Tween, TBST)洗涤,5%脱脂奶粉室温孵育30 min,一抗4 ℃孵育过夜(1:500),β-actin(1:3 000)作为内参。TBST 洗涤,二抗37 ℃孵育1 h(1:3 000),TBST 洗涤。通过增强化学发光溶液检测免疫复合物,并用Image-J 软件分析目的蛋白灰度值,参照β-actin 计算灰度值,即为目的蛋白相对表达量。
1.6 原代输卵管上皮细胞培养
用37 ℃含有青链霉素的PBS 和75%酒精依次清洗输卵管,重复3 次,将输卵管壶腹部两端用无菌棉线结扎,管腔内注入0.2% IV 型胶原酶37 ℃孵育10 min,收集管腔内容物并用培养液冲洗,1 200 r·min-1离心5 min 后弃去上清。在含有100 IU·mL-1青霉素、100 IU·mL-1链霉素及10%胎牛血清的DMEM/F12 完全培养基中重悬,转移至细胞培养瓶置于37 ℃、95% O2和5% CO2培养箱中培养。每2 d 换一次培养基,细胞密度达到70%~80%时用0.25%胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)重悬,1 200 r·min-1离心弃去上清,重悬转移至每孔含2 mL完全培养基的6 孔板中进行培养。处理前DMEM/F12 原培处理12 h,换液后以终浓度为0、10、50和100 ng·mL-1的LPS 处理12 h,弃上清,用4 ℃预冷的PBS 洗涤3 遍后,在-80 ℃条件下保存备用。
1.7 细胞免疫荧光
6 孔板中细胞密度至70%~80%时弃去培养液,在预冷至4 ℃的PBS 中洗涤,4%多聚甲醛固定30 min,PBS洗涤,后用0.1%的曲拉通室温处理15 min,PBS洗涤,5%山羊血清37 ℃孵育30 min,一抗孵育过夜(1∶250)。PBS 洗涤,荧光二抗37 ℃避光孵育1 h,PBS 洗涤,1 μg·mL-1的DAPI 染核后用Revolve Omega 荧光显微镜拍照。
1.8 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)
TRIzol处理细胞样品,提取总RNA,微量核算测定仪(Pultton,美国)测定OD260/OD280值在1.8~2.0之间,调整浓度后使用反转录试剂盒步骤进行cDNA链的合成,引物参考NCBI(www.ncbi.nlm.nih.gov)上已经公布的绵羊TLR4、NFκB、TNF-α和β-actin基因序列(表1)。反转录后使用LightCycler 480 Real-time Detection System(Roche, 瑞士)检测目的基因相对表达量,反应体系20 μL:cDNA 1 μL、正反向引物各0.4 μL、2×TransStart Tip Green qPCR SuperMix 10 μL、ddH2O 8.2 μL。将样品充分混匀,每个样品重复3 次,反应程序:95 ℃预变性300 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸20 s,45 个循环。采用2-ΔΔct法计算相对表达量。

表1 引物序列Table 1 Primer sequences
1.9 数据分析
使用SPSS 21.0(IBM)进行统计分析。对所有数据进行正态性和同方差检验、单因素方差分析和邓肯多重检验。P<0.05水平表示数据差异显著。
2 结果与分析
2.1 绵羊输卵管峡部、壶腹部、伞部的结构及免疫荧光检测
利用苏木精-伊红染色法对绵羊输卵管组织切片进行染色观察。峡部和壶腹部从内而外由粘膜层、肌层及外膜组成,黏膜层包含上皮层和固有层并向内突出褶皱,黏膜上皮紧贴管壁基底部呈单层柱状纤维上皮、顶部为假复层柱状纤毛上皮。伞部为膜结构由外侧假复层柱状纤毛上皮和内侧疏松的结缔组织构成,箭头标记为上皮细胞(图1)。免疫荧光检测Claudin-1、Occludin发现两种蛋白主要存在于黏膜上皮的柱状上皮中(图2、3)。
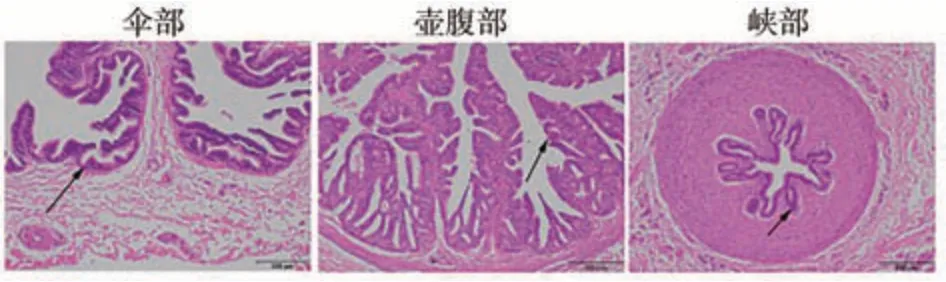
图1 绵羊输卵管峡部、壶腹部、伞部的HE染色(100×)Fig.1 HE staining (100×) photoes of sheep oviduct isthmic portion, ampulla and fimbriae

图3 绵羊输卵管峡部、壶腹部、伞部的Occludin免疫荧光染色分析(×100)Fig.3 immunofluorescence staining analysis of Occludin in the isthmic portion, ampulla and fimbriae of sheep oviduct (100×)
2.2 Claudin-1、Occludin 在峡部、壶腹部、伞部的表达差异
通过WB 检测绵羊输卵管峡部、壶腹部、伞部中Claudin-1、Occludin 的相对表达。结果显示,Claudin-1、Occludin 在伞部的表达显著高于峡部和壶腹部(P<0.05)(图4)。
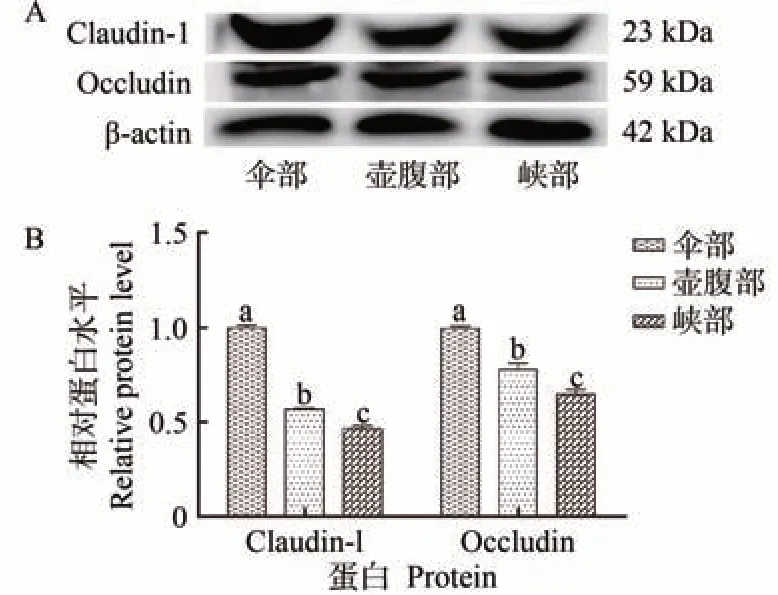
图4 Claudin-1、Occludin在峡部、壶腹部、伞部的表达差异Fig.4 Claudin-1 and Occludin in isthmic portion, ampulla and fimbriae expressi on differences
2.3 体外培养原代输卵管上皮细胞的鉴定
如图5 所示,通过免疫荧光染色检测细胞角蛋白18(cytokeratin18,CK18),在细胞质中可见绿色荧光激发。
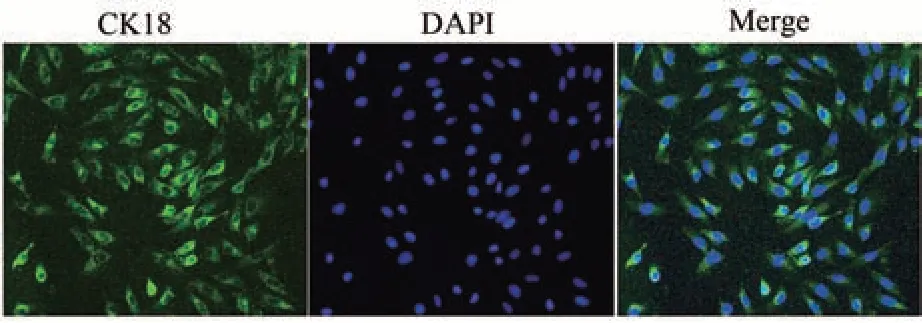
图5 体外培养绵羊输卵管壶腹部上皮细胞角蛋白18的免疫荧光染色(200×)Fig.5 Immunofluorescence staining of cytokeratin18 in sheep ampulla epithelial cells cultured in vitro (200×)
2.4 脂多糖诱导输卵管上皮炎症模型的鉴定
利用终浓度为0、10、50和100 ng·mL-1的LPS分别处理原代输卵管上皮细胞,qRT-PCR 检测TLR4、NFκB及TNFα的mRNA表达,结果如图6所示。与0 ng·mL-1处理组相比,10、50 和100 ng·mL-1的LPS 均可显著促进TLR4、NFκB及TNFα的mRNA表达水平(P<0.05)。
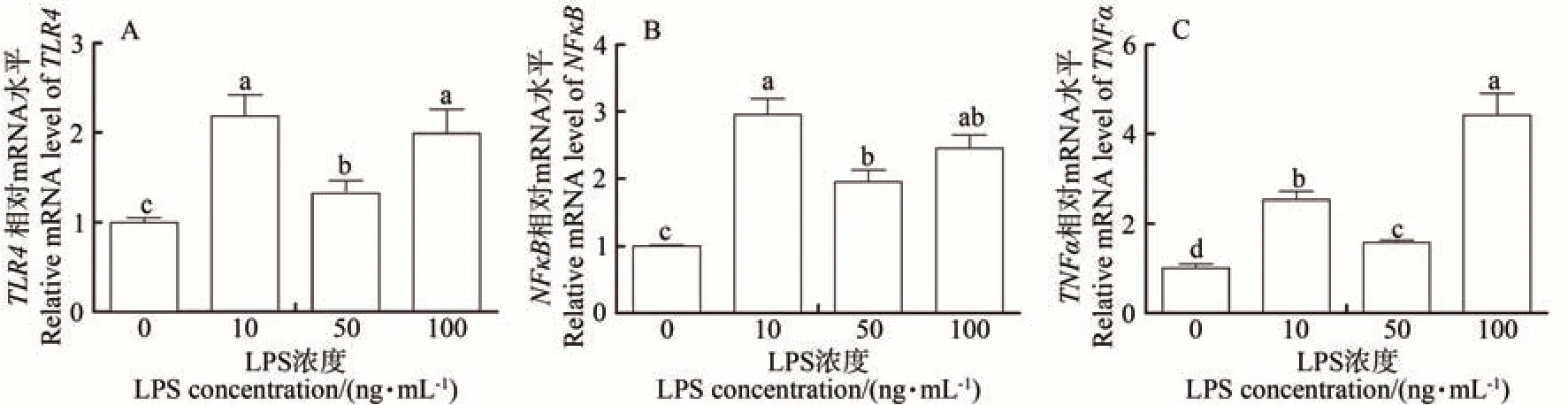
图6 LPS诱导输卵管上皮细胞TLR4、NFκB及TNFα 的mRNA相对表达水平Fig.6 Relative mRNA expression levels of LPS induced epithelial cells TLR4, NFκB and TNFα
2.5 脂多糖对输卵管上皮Claudin-1、Occludin 表达的影响
WB 检测LPS 处理原代细胞Claudin-1、Occludin的相对蛋白表达水平,结果如图7 所示。10、50 和100 ng·mL-1浓度的LPS 不同程度地促进了Claudin-1表达,但抑制了Occludin 表达,并与0 ng·mL-1处理组表达量均差异显著(P<0.05)。
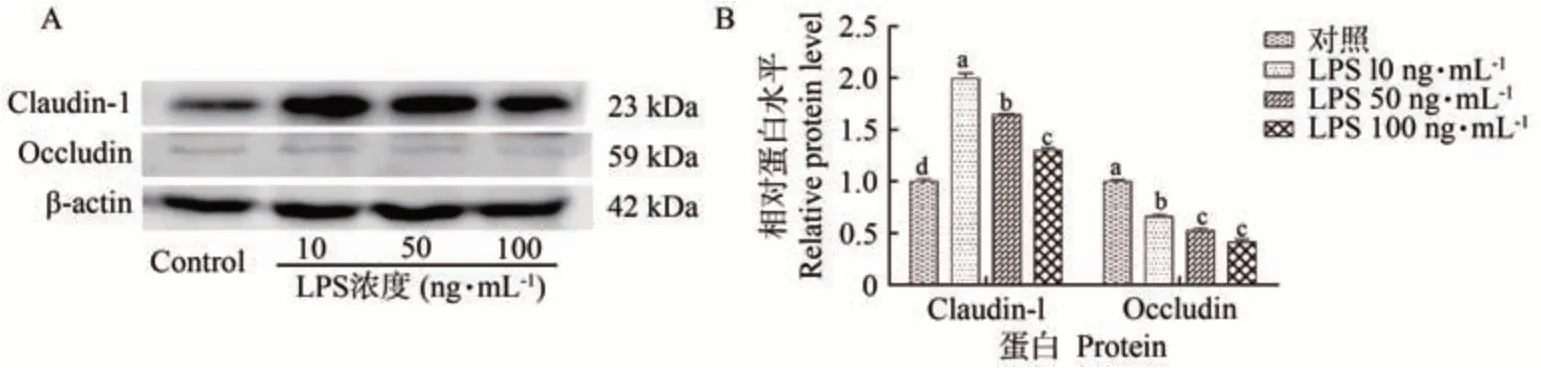
图7 LPS诱导输卵管上皮细胞Claudin-1、Occludin的蛋白相对表达水平Fig.7 Relative protein expression levels of LPS induced epithelial cells Claudin-1、Occludin
3 讨论
输卵管伞部为漏斗状,呈不规则褶皱,由外侧假复层柱状纤毛上皮和内侧疏松的结缔组织构成(图1),主要功能是将卵巢排出的卵子运输至输卵管内;壶腹部是输卵管中长度最长、管腔最粗的一段(图1),壶腹部上皮具有分泌功能维持输卵管内微环境稳态。输卵管峡部是连接壶腹部与子宫的一段较短直、且细的部位,主要发挥运输功能[14-16]。构成输卵管上皮TJ 的关键蛋白Claudin-1、Occludin表达于峡部、壶腹部及伞部上皮(图2、3),且Claudin-1、Occludin 在伞部的蛋白表达水平显著高于壶腹部及峡部(图4)。由此推测,Claudin-1、Occludin 在输卵管维持上皮屏障完整性及维持内环境稳态中发挥着重要的作用。
TLR4可识别LPS刺激激活TLR4-NFκB炎症通路,导致机体炎症反应发生[5-6]。前人用LPS处理大鼠肠黏膜微血管内皮细胞,发现不同处理时间的TLR4的mRNA 表达均上升,无时间依赖性;而不同浓度LPS 处理9 h后,TLR4表达呈剂量依赖性升高[17]。奶牛乳腺上皮细胞的相关研究发现,不同浓度LPS处理不同时间后NFκB的表达水平均升高,但是未出现时间和浓度依赖性[18]。本研究通过不同浓度LPS处理输卵管上皮细胞12 h,发现LPS可刺激输卵管上皮TLR4、NFκB、TNFα的mRNA 表达水平上升,无剂量依赖性,这可能与LPS 处理的浓度、时间以及细胞种类有关(图6)。结合上述前人研究结果表明,LPS 可刺激绵羊输卵管上皮激活TLR4-NFκB炎症通路,从而发生炎症反应。TNFα是一种多效应炎症因子,参与炎症反应,抑制精子及卵子在输卵管中的进一步发育、阻碍精卵结合、诱发输卵管黏连和阻塞、阻碍胰岛素信号传导造成多囊卵巢综合征,诱发其他盆腔器官炎症反应[19-20]。结合本研究结果表明,低浓度LPS 刺激输卵管上皮细胞短时间内就可引发输卵管上皮细胞的炎性反应,造成输卵管损伤。
前人在LPS诱导的犬子宫内膜炎中发现子宫内膜中的Occludin 蛋白表达水平[21],大肠杆菌处理的小鼠子宫内膜Occludin 蛋白和mRNA 的表达水平均显著降低[22]。TNFα 可过度活化子宫内膜上皮中性粒细胞造成其损伤[23],TNFα 可诱导Alport 小鼠及马的肾小管TJs中Claudin-1表达升高[24-25]。本研究结果显示,LPS刺激输卵管上皮细胞的炎症反应导致上皮细胞Claudin-1 蛋白表达水平上升,Occludin 蛋白表达降低(图7)。表明LPS可通过影响Claudin-1、Occludin的表达破坏输卵管上皮屏障。子宫颈鳞状上皮和喉鳞癌病程发展过程中Claudin-1 表达都呈现出较高的水平[26-27],Claudin-1 缺失会导致皮肤等多个部位上皮细胞收紧[28-29]。Occludin 参与调节跨上皮中性粒细胞迁移,Occludin 缺失导致组织上皮分化缺陷[30-31],其表达水平与细胞旁通透性成反比[32]。表明Claudin-1、Occludin 表达的改变和上皮细胞增殖、旁通透性、细胞间信号传导、物质运输及胞间连接等密切相关。推测LPS 刺激输卵管炎症反应造成上皮紧密连接蛋白表达紊乱,可能造成输卵管上皮细胞增殖、上皮通透性增大及信号转导紊乱导致输卵管堵塞、充血、黏连等,影响输卵管生理功能,从而影响绵羊经济价值。
4 结论
本研究结果表明,Claudin-1、Occludin 表达于绵羊输卵管上皮并参与维持输卵管上皮微环境稳态。低浓度的LPS 在短时间内便可诱发输卵管上皮炎症反应,造成输卵管上皮Claudin-1、Occludin表达紊乱,破坏输卵管上皮紧密连接,造成输卵管上皮损伤,进而导致输卵管生理机能下降。

