意义不明的克隆性造血对老年射血分数降低心力衰竭患者预后的影响
祖晓麟 叶明 曾亚平 高海
100029 首都医科大学附属北京安贞医院心内急诊冠脉病房
研究证实,超过10%的70岁以上老年人群的外周血携带单克隆细胞,约占外周血细胞总量的20%[1-2]。Steensma等[3]将这种与年龄相关的不符合骨髓增生异常综合征诊断、且外周血基因突变细胞比例至少为2%的状态定义为不确定潜能的克隆性造血(clonal hematopoiesis with indeterminant potential,CHIP)。既往研究显示,CHIP在老年人中很常见,与恶性血液病风险增加有关[4-5]。
CHIP作为血液系统恶性肿瘤癌前状态,是继发血液病的强危险因素。然而,携带克隆性突变患者全因死亡率比未检出突变细胞者高出40%,这种全因死亡风险增加并不能用血液系统肿瘤发病解释[6]。在此基础上,Jaiswal等[2]发现携带外周血单克隆细胞的个体罹患心血管疾病风险增加,为心血管疾病危险因素的研究提供了新思路。在<50岁的人群中,携带外周血克隆性细胞比例者<0.5%,而在>80岁的老年人群中为2.7%[7]。CHIP年轻携带者发生心肌梗死的风险是非携带者的4倍,CHIP发生率及携带者外周血突变细胞比例均随年龄增长而增加[8]。因此,虽然CHIP是血液系统肿瘤的癌前状态,与年龄增长相关,但其增加心血管疾病风险的作用独立于年龄。CHIP相关突变位点以DNMT3A、TET2、ASXL1、JAK2、TP53最为常见[9]。一些研究提示,他们通过调节DNA甲基化水平、细胞表型转化、炎性细胞因子表达等途径增加心力衰竭(heart failure,HF)的发生风险[10-11]。
CHIP可作为连接心血管疾病风险管理与衰老的重要纽带[12]。研究显示,在缺血性射血分数降低心力衰竭(heart failure with reduced ejection fraction,HFrEF)的患者中,CHIP可能与心血管不良结局相关[13]。目前CHIP对老年HFrEF进展和预后的影响尚不清楚。因此,本研究连续选取2020年1月至2022年1月我院收治的老年HFrEF患者145例,探讨CHIP对老年HFrEF患者随访发生主要不良心脑血管事件(major adverse cardiac and cerebrovascular event,MACCE)的影响。
1 对象和方法
1.1 研究对象
前瞻性队列研究。连续选取2020年1月至2022年1月在北京安贞医院收治的老年HFrEF患者145例,年龄65~90岁,平均为(78.1±10.4)岁。入院后根据从外周血提取的DNA中获得的全基因组序列的CHIP状态分组,分为CHIP组[变异等位基因频率(variant allele frequency,VAF)≥2%,48例]和非CHIP组(VAF<2%,97例)。
纳入标准:(1)年龄65~90岁,性别不限;(2)HFrEF的诊断依据《老年人慢性心力衰竭诊治中国专家共识(2021)》,包括有HF症状或体征,且左室射血分数(left ventricular ejection fraction,LVEF)<40%[14];(3)所有患者均进行全基因组测序,且数据完整;(4)基线资料无缺失;(5)知情同意,配合随访。排除标准:(1)射血分数保留或中间值HF;(2)伴有急性HF;(3)入院前6个月合并肺栓塞、主动脉夹层、脑血管事件或急性心肌梗死等;(4)合并严重肺脏、肝脏和或肾脏功能衰竭;(5)合并晚期恶性肿瘤等,且预期存活时间<6个月;(6)全基因组测序等基线资料缺失;(7)不同意随访,或随访数据缺失。
本研究符合赫尔辛基医学研究伦理学要求,已经在中国临床试验注册中心注册,研究内容并获得患者的知情同意和北京安贞医院的伦理委员会批准(KS2022068)。
1.2 方法
入院后当天或次日凌晨,抽取静脉血,完善血常规、生化和炎症标记物检查。入院后3 d内完善超声心动图检查。应用自建的数据收集表,收集患者的基线资料,包括年龄、性别、体质指数、目前吸烟、HF病程、缺血性HF、再灌注治疗、糖尿病、高血压、慢性肾脏病、心房颤动、高血脂、肿瘤、白细胞、血红蛋白、空腹血糖、C反应蛋白、白介素6(interleukin 6,IL-6)、N末端B型利钠肽原(N-termianl pro-B-type natriuretic peptide,NT-proBNP)、血肌酐、LVEF、左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end-dystolic diameter,LVESD)。同时,记录两组的治疗资料,包括噻嗪类利尿剂、地高辛、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors,ACEI)/血管紧张素Ⅱ受体阻滞剂(angiotensin II receptor blockers,ARB)/盐皮质激素受体拮抗剂(mineralcorticoid receptor antagonists,MRA)、胺碘酮、β受体阻滞剂、抗凝、他汀和植入式心脏转复除颤器(implantable cardioverter defibrillator,ICD)/心脏再同步化治疗(cardiac resynchronization therapy,CRT)等。
1.3 全基因测序检测体细胞变异[15-16]
从外周血白细胞中分离总DNA,质控合格后进行测序。应用GATK MuTect2软件检测体细胞变异。设定MuTect2的覆盖率为10,VAF为0.05,最小变异读取计数为3来调用体细胞变异。使用了先前在文献中报道的体细胞突变目录[4,9]。根据先前报道的方法,进行了精确的二项式检验以去除可能的种系变异。对于杂合种系变异,假定替代等位基因频率约为0.5。VAF≥2%定义为CHIP。
1.4 随访情况
随访截至2023年1月31日,主要通过随访门诊或电话或微信进行,由我科的2名主治医师负责。主要观察终点是MACCE,为死亡、HF加重再入院、非致死性心肌梗死和非致死性卒中的复合结局。其中,心肌梗死的诊断主要依据患者的临床症状、心电图和心肌酶结果,卒中(出血性或缺血性卒中)的诊断主要依据患者的临床表现和脑CT或MR影像结果。
1.5 统计学方法

2 结果
2.1 CHIP组情况
48例(33.1%)合并有CHIP的老年HFrEF患者中,11例(22.9%)为混合突变。突变基因中,最常见的是DNMT3A或TET2,分别占所有突变的47.9%(23/48)和37.5%(18/48),ASXL1、JAK2、TP53分别占20.8%(10/48)、10.4%(5/48)和6.3%(3/48)。
2.2 两组患者的基线资料情况
如表1所示,与非CHIP患者相比,CHIP组患者年龄更大,心功能更差,血肌酐、NT-proBNP和IL-6水平更高(均为P<0.05)。
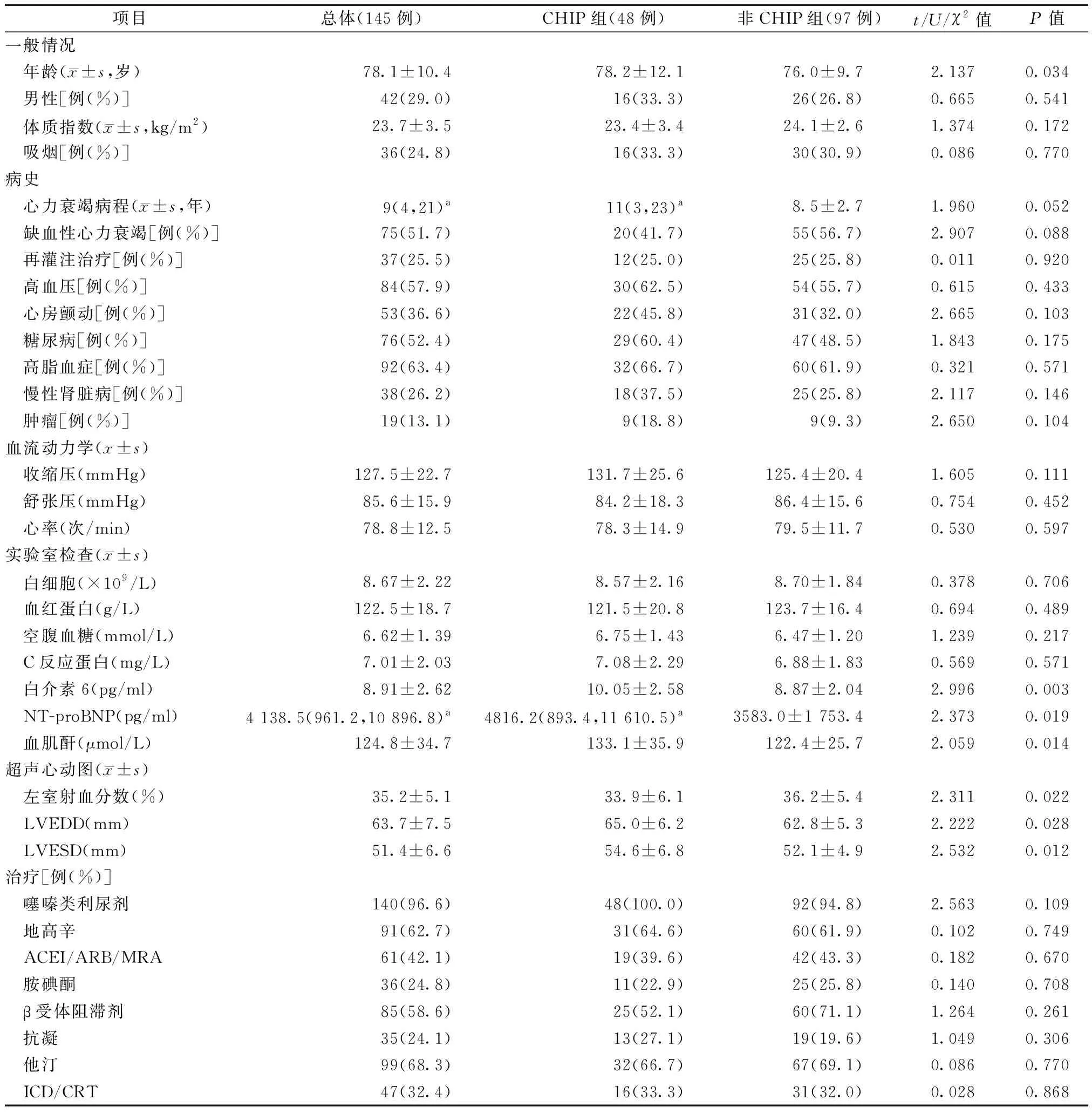
表1 两组患者的基线临床资料情况
2.3 两组患者的预后情况
如表2所示,中位随访16个月(12~33个月),失访8例(5.5%)。随访期间,51例患者(35.2%)发生MACCE,包括死亡6例(4.1%),22例(15.2%)因HF加重入院,13例(9.0%)发生心肌梗死,10例(6.9%)发生卒中。与非CHIP组比较,CHIP组的因HF加重入院(HR=1.768,95%CI:1.073~2.837,P=0.025)、心肌梗死(HR=1.551,95%CI:1.049~2.236,P=0.042)、卒中(HR=1.538,95%CI:1.082~2.439,P=0.035)和MACCE事件(HR=1.737,95%CI:1.052~2.493,P=0.032)均显著增高。但是,两组的全因死亡(HR=1.295,95%CI:0.991~1.683,P=0.067)风险没有显著统计学差异(图1、2)。
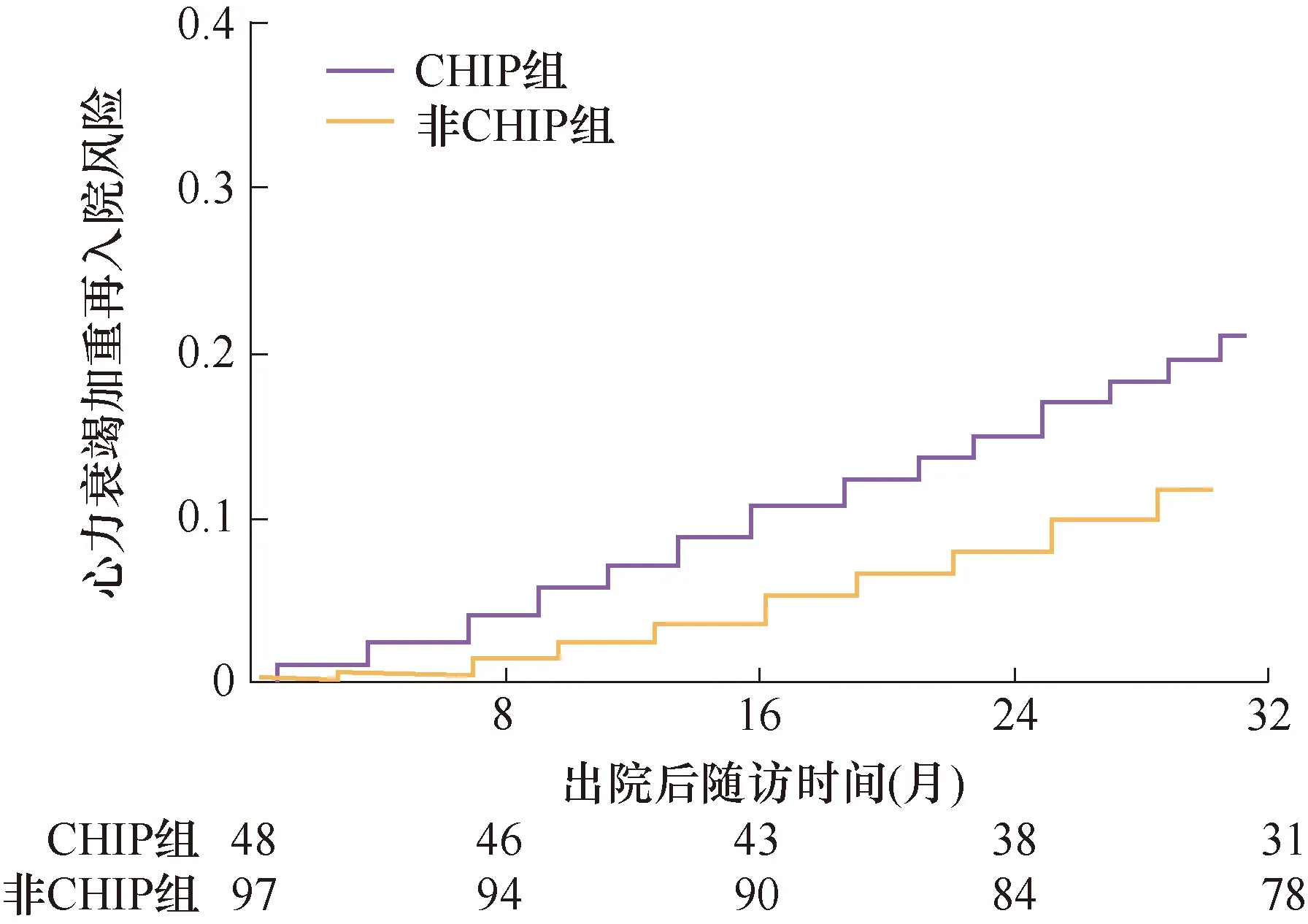
图1 两组随访发生HF加重再入院的风险比较
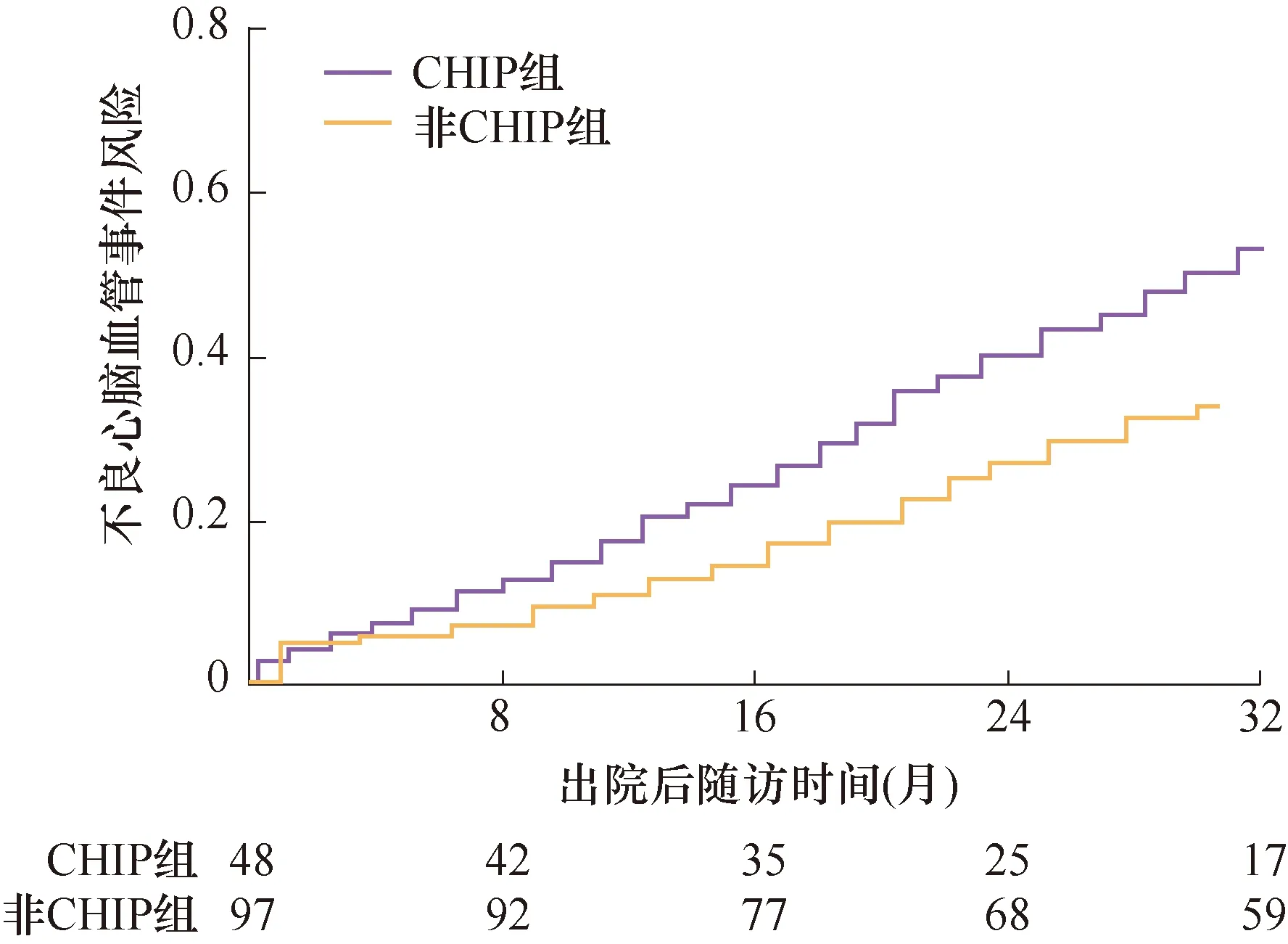
图2 两组随访发生不良心脑血管事件的风险比较
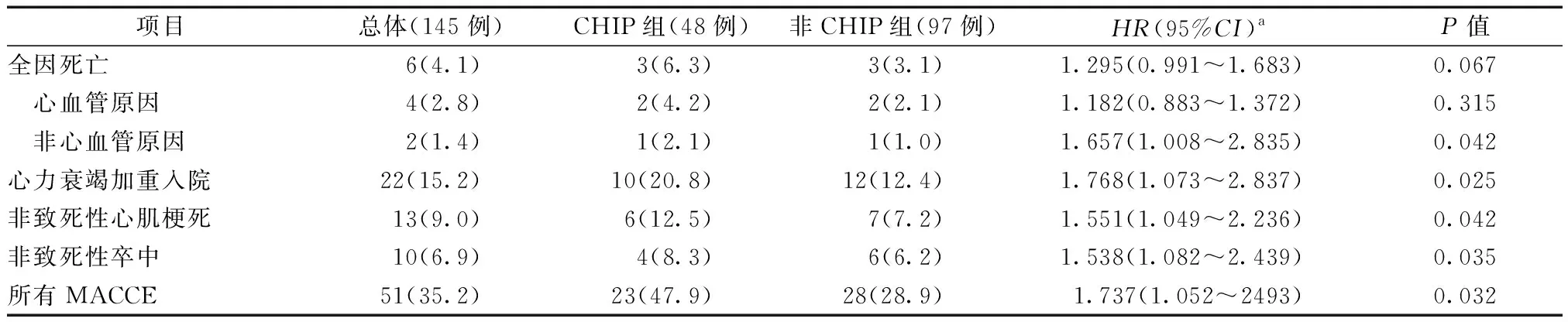
表2 两组患者的MACCE事件比较[例(%)]
2.4 Cox风险比例回归分析
将表1基线临床资料组间比较P<0.2的变量纳入Cox多因素回归分析,结果显示,校正相关因素后,CHIP仍与MACCE显著正相关(HR=1.737)。此外,年龄(HR=1.642)、HF病程(HR=1.869)、IL-6(HR=1.756)、NT-proBNP(HR=2.211)和血肌酐水平(HR=1.528)都是发生MACCE的独立影响因素(表3)。

表3 多因素Cox风险比例回归分析
2.5 增加CHIP前后的模型预测价值
ROC曲线结果显示,与加入CHIP前比较,加入CHIP后,模型预测MACCE的准确性明显提高(AUC分别为0.822和0.796,P=0.038)。
3 讨论
血细胞老化相关突变(CHIP等)可成为老年HF患者的新风险因素。我们发现,33.1%老年HFrEF患者合并有CHIP,CHIP显著增加老年患者的因HF加重入院、心肌梗死、卒中和MACCE事件的发生风险。因此,需要重视评估老年HF患者血细胞老化相关突变情况[17]。
CHIP与动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)相关。2017年,Jaiswal等[8]报道了一项大样本前瞻性队列研究结果,证实了CHIP可成倍增加患者发生冠心病的风险。共纳入来自4个大型临床研究患者,使用全基因组测序检测外周血细胞CHIP,发现携带CHIP导致患者的冠心病风险提高1.9倍,心肌梗死风险提高4倍。此外,DNMT3A、TET2、ASXL1和JAK2突变均与冠心病相关[8]。在HF患者中,近期的一项研究共纳入了62例LVEF<45%的HF患者(平均年龄74岁,非缺血性占52%,平均LVEF 30%)[18]。发现有24例(38.7%)患者检测到了CHIP突变。随访3.5年后发现,虽然CHIP组和非CHIP组的全因死亡率差异无统计学意义(P=0.151),但在调整危险因素后,DNMT3A或TET2突变的患者存在显著增加的死亡风险(HR=2.79,95%CI:1.30~5.92)、死亡或HF住院风险(HR=3.84,95%CI:1.80~8.04)以及与HF相关的死亡或住院风险(HR=3.84,95%CI:1.80~8.04)。在单基因特异性分析中,DNMT3A或TET2的体细胞突变对HF相关死亡或住院有一定的预后意义(DNMT3A突变:HR=4.50,95%CI:2.07~9.74;TET2突变:HR=3.18,95%CI:1.50~6.66)。这种相关性与缺血性还是非缺血性病因无关[18]。因此,驱动克隆性造血的体细胞突变在HFrEF患者中很常见,并且与HF加速进展有关。近期研究还发现,CHIP与卒中的高风险有关。在一项国内前瞻性队列中,研究人员纳入了6 016例首发急性缺血性卒中患者,在3个月的随访中,在调整了患者的高敏C反应蛋白水平后,CHIP的存在与复发性卒中(HR=1.62)、复发性缺血性卒中(HR=1.64)和合并血管事件(HR=1.58)有关[19]。同既往研究类似,本研究结果显示,33.1%老年HFrEF患者合并有CHIP,CHIP组的因HF加重入院、心肌梗死、卒中和MACCE事件均显著增高。因此,CHIP与临床预后不佳有关,会增加患者不良心血管结局发生风险。
CHIP评估可能有助于改善老年HFrEF人群的预后风险分层。既往的ASCVD危险因素的研究中,一般着重于吸烟、饮食、运动以及高血压、糖尿病、高血脂、基础心功能、基础肾功能等,而衰老作为心血管疾病重要的独立危险因素不受环境因素影响。目前,采用基于组织细胞的DNA甲基化的年龄检测可预测个体的衰老水平,而CHIP相关突变与DNA甲基化水平强相关,故携带CHIP和外周血突变细胞比例增加可作为评估衰老的指标[20-21]。新型外显子测序可以准确检测出外周血突变率<0.03%的克隆突变,故95%研究对象中可检测到DNMT3A或TET2突变的克隆造血[22],而CHIP相关突变在HF人群广泛存在[23]。我们的研究结果显示,加入CHIP后,模型预测MACCE的准确性明显提高(AUC分别为0.822和0.796,P=0.038)。临床中,随着血液全外显子组测序价格的下降,CHIP在心血管疾病风险评估中的应用成为可能。
炎症可能是介导CHIP增加HF患者不良预后发生风险的重要机制。在小鼠模型中,通过突变与克隆造血相关的TET2功能,发现TET2敲除小鼠的主动脉根部和主动脉有较大的粥样硬化病变,TET2基因敲除小鼠巨噬细胞分析显示多种趋化因子和细胞因子的动脉粥样硬化相关基因高表达。部分临床研究也表明,CHIP在高炎症水平患者中与MACCE相关(OR=3.10,95%CI:1.92~5.00),在低炎症水平患者中不相关(OR=0.18,95%CI:0.03~1.04)[8]。因此,在CHIP和MACCE间的关系中,过度炎症可能是重要的介导因素。对英国生物银行(UKB)的5 041个健康特征分析发现,DNMT3A是整个CHIP表型中最常见的突变基因,具有最多的显著相关位点;CHIP基因突变携带者大多数相关表型来自心血管、血液、肿瘤、感染、肾脏和吸烟等。ASXL1与数量最多和范围最广的特征有关,其中许多关联可以追溯到吸烟的相关性。白细胞计数、血小板计数和中性粒细胞计数等均与DNMT3A呈正相关,与TET2呈负相关;CHIP与心血管疾病、血液学特征、恶性肿瘤、吸烟、肥胖、感染和全因死亡率均有关[24]。在人类中,CHIP与心肌梗死相关。在小鼠中,CHIP可加重动脉粥样硬化,增加IL-6/IL-1β的表达,因此,IL-6通路拮抗剂或可降低CHIP携带者的心血管疾病风险?近期一项研究显示,IL6Rp.Asp358Ala可降低携带CHIP克隆个体的MACCE发生风险(HR=0.46,95%CI:0.29~0.73),但不影响无CHIP个体的MACCE风险。在9 951例独立的受试者中,CHIP状态与心肌梗死的相关性也随着IL6Rp.Asp358Ala状态而改变[22]。对于CHIP克隆的携带者,从基因上减弱IL-6信号可以消除或明显减弱发生MACCE风险。
本研究的局限性包括单中心小样本研究,纳入的均为老年HFrEF患者,未纳入其他类型的HF患者。此外,随访时间短,且主要依靠门诊进行,可能会遗漏一些终点事件,故还需要更多的高质量大样本研究证实。总之,CHIP在老年HFrEF患者很常见,与临床预后不佳有关。CHIP评估可能有助于患者预后的进一步风险分层。因此,在老化过程中出现的一系列血细胞遗传突变可能是老年HFrEF患者预后不佳的新危险因素[25-30]。
利益冲突:无