尿白蛋白与肌酐比值升高对老年2型糖尿病患者随访新发心力衰竭的预测价值分析
刘爱英 杨静 冯利娜
075001 张家口市妇幼保健院普通内科
心力衰竭(heart failure,HF)被视为各种心血管疾病的终末期。由于人口老龄化以及冠心病和瓣膜性心脏病诊断和治疗方法的改进,HF的全球患病率随着时间的推移而增加[1]。流行病学数据显示,在发达国家,HF患病率估计在普通成年人群中占1%~2%,在70岁以上人群中高达10%。2003年和2012—2015年中国成人HF患病率分别为0.9%和1.3%,与2003年数据相比增加了近500万例。HF患者预后差,表现出较高的再住院率,生存率和与恶性肿瘤患者的5年生存率相似,估计为50%。
在一般人群中蛋白尿与HF发生风险有关[2]。糖尿病患者常规测量估计的肾小球滤过率(estimated glomerular filtration rate,eGFR)和通过尿白蛋白/肌酐比(urinary albumin/creatinine ratio,uACR)测量的蛋白尿程度,并被认为是肾脏转归、心血管转归和死亡的预后指标[3-4]。虽然在一般人群中蛋白尿与HF有关,但2型糖尿病患者uACR与新发心力衰竭(new-onset HF,NOHF)之间的关系尚不清楚[5]。因此,本研究通过纳入2015年1月至2019年2月我院收治的老年T2DM患者,分析uACR升高对老年T2DM患者随访NOHF的预测价值,并分析将uACR纳入现有模型是否可以提高预测性能。
1 对象和方法
1.1 研究对象
单中心回顾性队列研究。连续纳入2015年1月至2019年2月在张家口市妇幼保健院住院治疗的632例老年T2DM患者。检测基线的尿白蛋白和血肌酐水平计算uACR,并根据uACR分为三组,包括正常蛋白尿组(<3 mg/mmol,310例)、微量白蛋白尿组(3~30 mg/mmol,215例)和大量白蛋白尿组(>30 mg/mmol,107例)。
1.2 纳入和排除标准
纳入标准:(1)60~80岁,性别不限;(2)根据中国老年糖尿病诊疗指南(2021年版)[6]诊断为T2DM,包括典型糖尿病症状(烦渴多饮、多尿、多食、不明原因体重下降)+随机静脉血葡萄糖≥11.1 mmol/L;或空腹静脉血浆葡萄糖≥7.0 mmol/L;或加上葡萄糖负荷后2 h静脉血浆葡萄糖≥11.1 mmol/L;或糖化血红蛋白(glycated hemoglobin A1c,HbA1c)≥6.5%;(3)尿白蛋白和肌酐数据完整;(4)同意参与本研究,随访数据完整。
排除标准:(1)年龄<60岁,或>80岁;(2)既往合并HF病史;(3)入院前6个月合并急性心肌梗死;(4)合并瓣膜性心脏病或先天性心脏病;(5)合并认知障碍等,无法完成研究;(6)合并肿瘤等恶性疾病,预期存活期不到1年;(7)拒绝参与本研究,或拒绝随访。本研究符合医学研究的伦理学要求,通过本院的医学伦理委员会批准(伦理编号:FY-20140713-010)。
1.3 方法
检索并记录人口学资料(年龄、性别、体重、身高)、危险因素和合并症(吸烟、酗酒、糖尿病病程、高血压、高血脂、心绞痛、卒中、心房颤动、外周动脉疾病、慢性肾脏病)、实验室检查结果[血常规、高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)、空腹血糖、餐后2 h血糖、HbA1c、血脂、血肌酐、尿蛋白、uACR、eGFR、N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)]、超声心动图结果[左室射血分数(left ventricular ejection fraction,LVEF)、左室舒张末期内径、收缩末期内径、左室整体纵向应变(global longitudinal strain ,GLS)、左室质量指数(LV mass index,LVMI)]、降糖药[胰岛素、二甲双胍、钠-葡萄糖共转运蛋白2抑制剂(sodium glucose cotransporter 2 inhibitor,SGLT2i)、胰高糖素样肽1受体激动剂(glucagon like peptide-1 receptor agonist,GLP-1 RA)]、心血管药[β受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors,ACEI)/血管紧张素Ⅱ受体阻滞剂(angiotensin Ⅱ receptor blockers,ARB)、螺内酯、钙通道拮抗剂、抗血小板、抗栓、他汀类]。
1.4 随访及终点事件
随访截至2022年12月。随访由我科2名研究生专门负责,主要通过随访门诊进行,一般在出院后6个月、12个月、24个月、36个月和48个月时随访。主要观察NOHF情况。NOHF定义是根据老年人慢性心力衰竭诊治中国专家共识(2021)[7],包括(1)有心力衰竭症状或体征(呼吸困难、心悸、乏力、水肿等);(2)LVEF<50%;(3)NT-proBNP> 900 ng/L(60~75岁)或>1 800 ng/L(>75岁)。
1.5 统计学方法

2 结果
2.1 不同组患者的基线临床资料比较
共纳入632例患者,年龄平均为(66.4±7.2)岁,男性421例(66.6%)。三组患者的年龄、体质指数、糖尿病病程、合并高血压、hs-CRP、空腹血糖、餐后2 h血糖、HbA1c、血肌酐、uACR、eGFR、左室GLS、LVMI、SGLT2i和ACEI/ARB等均有差异,差异均有统计学意义(均为P<0.05)(表1)。
2.2 不同组患者的预后比较
平均随访时间为(43.0±5.9)个月,有35例(5.5%)NOHF,三组分别有8例(2.6%)、13例(6.0%)和14例(13.1%)。生存分析曲线显示,三组的NOHF风险差异有统计学意义(log-rankχ2=15.121,P=0.001)。调整协变量后,与正常组比较,微量白蛋白尿组(HR=2.324,95%CI:1.117~4.835,P=0.024)和大量白蛋白尿组(HR=5.116,95%CI:1.403~18.655,P=0.013)的NOHF风险均显著增高(图1)。
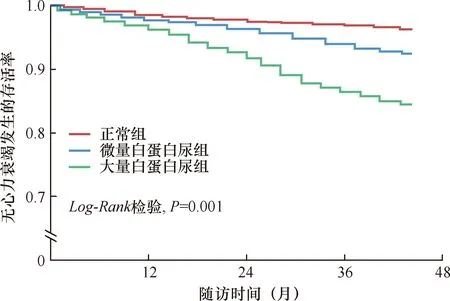
图1 不同组患者的新发心力衰竭风险比较
2.3 NOHF的相关因素
将表1中P<0.10的变量纳入多因素Cox回归分析,显示年龄(HR=1.516)、糖尿病病程(HR=2.414)、hs-CRP(HR=1.711)、HbA1c(HR=1.318)、eGFR(HR=0.865)、uACR(HR=1.933)和左室GLS(HR=0.892)是预测NOHF的相关因素(均为P<0.05)(表2)。
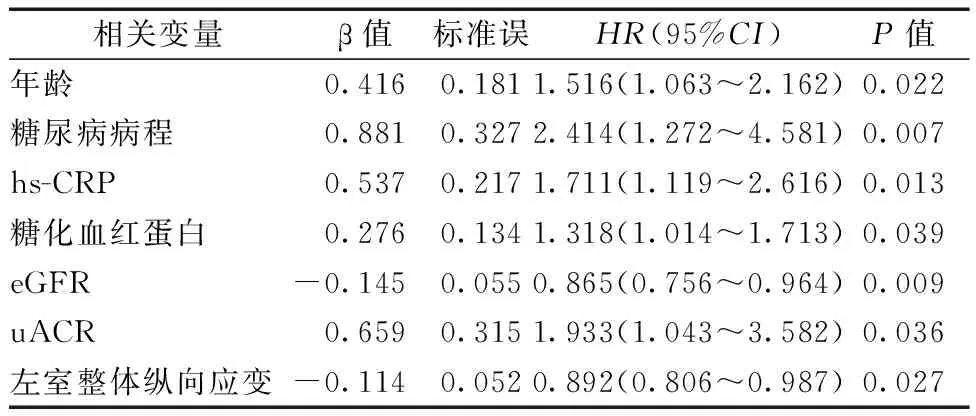
表2 多因素Cox回归分析
限制性三次样条曲线结果显示,随着uACR的增加,NOHF的风险在逐渐增加(P趋势<0.05)(图2)。
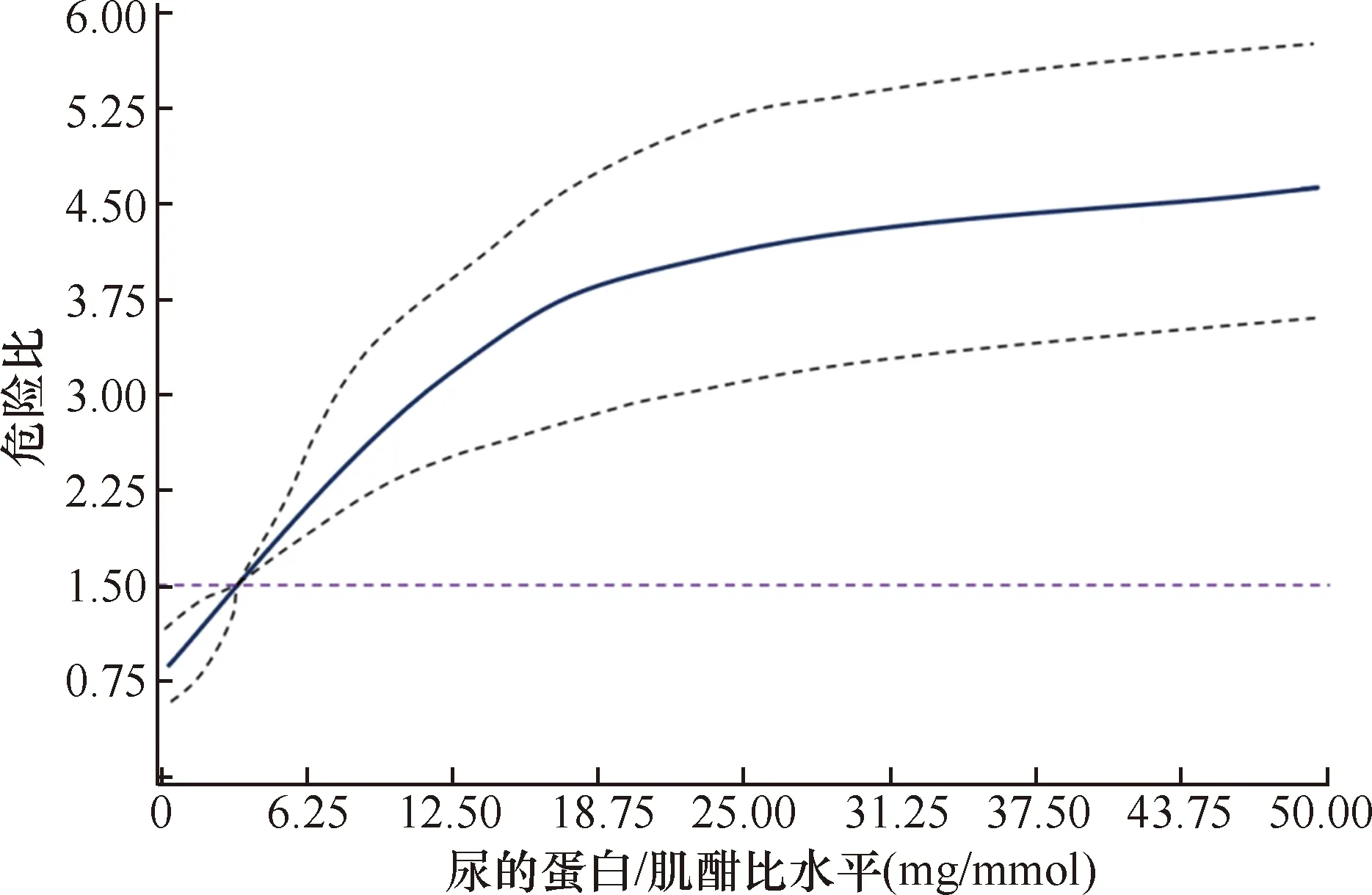
图2 尿白蛋白/肌酣比与新发心力衰竭风险的关系
2.4 增加uACR前后的模型预测价值
根据多因素Cox回归分析结果,年龄、糖尿病病程、hs-CRP、糖化血红蛋白、eGFR、uACR和左室GLS是发生心力衰竭的相关因素,据此建立预测NOHF的模型(1.727+0.416×年龄+0.881×糖尿病病程+0.537×hs-CRP+0.276×糖化血红蛋白-0.145×eGFR+0.659×uACR-0.114×左室GLS)。ROC曲线结果显示,加入uACR后,模型预测NOHF的准确性明显提高(AUC分别为0.692和0.785,P<0.001)。同时,计算了NRI和IDI后显示,当将uACR值添加到模型后,NRI为0.343(95%CI:0.101~0.585,P=0.006),IDI为0.032(95%CI:0.013~0.051,P=0.001)。因此,uACR值可显著改善患者预后的分类。
3 讨论
uACR水平增加是发生心血管事件或心血管死亡的强烈预测因素。既往研究显示,尿微量蛋白是全身血管内皮功能损害的独立标志物[8]。在一项回顾性研究中,纳入了66 311例既往无心血管疾病的T2DM患者,结果发现uACR与随访发生心血管疾病或死亡风险呈线性正相关。与正常蛋白尿组比较,微量蛋白尿组患者的心血管疾病发生风险(HR=1.58)和死亡风险(HR=2.08)均显著增加[9]。此外,王华斌等[10]探讨uACR与急性缺血性卒中的关系,结果发现ACR是既往无糖尿病、高血压及心血管疾病患者随访发生缺血性脑卒中的独立风险因素。迟丽屹等[11]在一项横断面研究中分析高血压患者的uACR与认知障碍的关系,共纳入404例高血压患者,二分类logistic回归分析结果显示uACR是患者发生认知功能障碍的独立风险因素(HR=1.158)。近期的一项回顾性研究中,Tao等[12]纳入9 287例无心力衰竭的T2DM患者。中位随访4.05年期间,共有216例(2.33%)NOHF。与正常uACR相比,uACR升高与发生HF的风险增加明显相关。其中,与正常蛋白尿组比较,微量白蛋白尿和大量白蛋白尿患者的HF风险均显著增加。同时,亚组分析结果也显示,在不同的亚群中,uACR水平增加均是随访发生HF的重要预测因素(均为P<0.05)[12]。与既往研究结果类似,我们的发现也证实,与正常组比较,微量白蛋白尿组和大量白蛋白尿组的NOHF风险均显著增高。限制性三次样条曲线结果显示,随着uACR的增加,NOHF的风险在逐渐增加。由此可见,uACR升高,也是T2DM人群出现NOHF的独立危险因素。因此,在老年T2DM患者中,随着uACR水平的增高,患者发生NOHF的风险越高。
联合uACR和其他指标或风险模型有助于提高预后预测的准确性。eGFR也是肾功能分级的重要指标,联合uACR和eGFR有助于进一步评估早期肾功能受损患者的不利预后风险。Fung等[9]研究发现,同时合并uACR 1~1.4 mg/mmol和eGFR≥90 ml·min-1·1.73 m-2的男性T2DM患者的心血管疾病发生风险显著增加(HR=1.25),同时合并uACR 2.5~3.4 mg/mmol和eGFR≥90 ml·min-1·1.73 m-2的女性T2DM患者的心血管疾病发生风险显著增加(HR=1.45)。Gerstein等[13]将uACR和eGFR合并为一个新的预后评估指标KDI。研究者通过分析REWIND研究中的9 901例T2DM患者的基线uACR和eGFR等指标和中位随访5.4年的预后,包括不良心血管事件(major adverse cardiac event,MACE)、肾脏结局或死亡。结果显示,1/eGFR与三种预后均呈非线性关系,ln[uACR×100]与肾脏预后呈非线性关系;在MACE和死亡方面,1/eGFR和ln[uACR×100]之间存在负向交互作用;而KDI和三种结果之间均存在线性关系。按照KDI的五分位数分组,KDI值最高组MACE发生率、死亡率和肾脏结局的风险最高(HR分别为4.43、4.56和5.55/100人年)[13]。此外,将uACR补充至传统风险模型有助于改善预后评估。Tao等[12]将uACR补充到WATCH-DM等心力衰竭风险模型中,发现可显著提高预测NOHF风险的能力(AUC=0.744比0.802),NRI和IDI也均有明显提高。同既往研究类似,我们发现加入uACR后,ROC曲线显示模型预测NOHF的准确性明显提高,可显著改善患者预后的分类。同时联合应用eGFR和uACR能提高预测T2DM患者心血管疾病或死亡风险的准确性。此外,联合WATCH-DM等心力衰竭模型,uACR可以改善社区T2DM患者的NOHF风险预测,显著改善患者预后的分类。
本研究的局限性包括:单中心的研究,没有多次随访观察uACR变化,随访时间为4年,还需要更多研究证实其对长期预后的价值。总之,本研究显示, uACR是预测老年T2DM患者随访发生NOHF的预测因素,加入uACR后预测NOHF的准确性提高,并显著改善患者预后的分类。
利益冲突:无